
- •Конспект лекций по дисциплине «Коллоидная химия»
- •Значение коллоидной химии
- •Основные признаки дисперсных систем
- •Изменение удельной поверхности
- •Классификация дисперсных систем
- •Классификация дисперсных систем по
- •Лекция 2. Получение коллоидных систем (кс) и их очистка.
- •Методы конденсации.
- •Методы диспергирования.
- •Метод пептизации.
- •Очистка коллоидных растворов.
- •Очищаемый раствор, 2 – растворитель (вода),
- •Оптические свойства коллоидных систем.
- •Броуновское движение.
- •Диффузия
- •Осмотическое давление коллоидных растворов.
- •Седиментация в дисперсных системах.
- •Оптические свойства дисперсных систем
- •Явление рассеяния света.
- •Поглощение (адсорбция) света.
- •Теории образования и строения дэс.
- •Электрокинетический потенциал.
- •Влияние электролитов на электрокинетический потенциал
- •Строение мицеллы.
- •Электрокинетические явления.
- •Коагуляция
- •Действие электролитов на коагуляцию
- •Совместное действие электролитов при коагуляции
- •Теория устойчивости гидрофобных дисперсных систем длфо
- •Скорость коагуляции
- •Концентрации электролита
- •Старение золей
- •Защитное действие молекулярных адсорбирующих слоев
- •Оценка пн жидкостей из родственных характеристик
- •Межфазное натяжение на поверхности раздела твердое тело-жидкость. Смачивание.
- •Краевой угол является мерой смачивания. Он определяется как угол между твердой поверхностью и касательной в точке соприкосновения трех фаз. Угол отсчитывается в сторону жидкой фазы.
- •Адсорбция. Изотерма адсорбции. Уравнение Гиббса.
- •Построение изотермы адсорбции и нахождение величин .
- •Теории адсорбции.
- •Комплекс
- •Полимолекулярная сорбция
- •Частные случаи адсорбции. Адсорбция на границе жидкость-газ.
- •Адсорбция на границе раствор-газ
- •Применение пав
- •Адсорбция на границе твердое тело-раствор
- •Молекулярная адсорбция из растворов
- •Влияние природы среды
- •Ионная адсорбция
- •Обменная адсорбция
- •Адсорбция на границе твердое тело-газ
- •Системы (молекулярные коллоиды)
- •Общая характеристика растворов полимеров
- •Набухание полимеров
- •Осмотическое давление и вязкость растворов полимеров
- •- Для раствора низкомолекулярного вещества;
- •Классификация студней
- •Условия образования студней
- •Механизм процессов гелеобразования и структура полимерных гелей
- •Реология гелей
- •Реологические теории.
- •Теория Эйринга
- •Структурные теории.
- •Гидродинамические теории
- •Теория Грессли
Полимолекулярная сорбция
На практике часто встречаются изотермы, имеющие вид:
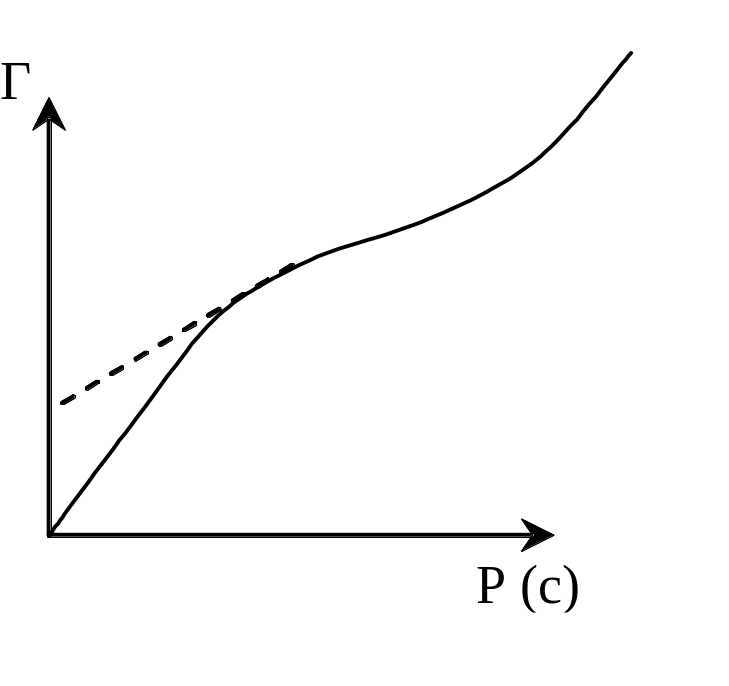 Рис.
7.6. Изотерма полимолекулярной сорбции.
Рис.
7.6. Изотерма полимолекулярной сорбции.
Такой вид изотерм свидетельствует о том, что связывание адсорбтива адсорбентом не прекращается после образования мономолекулярного слоя, т.е. свидетельствует о полимолекулярной сорбции.
Теорию полимолекулярной адсорбции предложил Поляни (1915 г).
Исходные положения этой теории:
Адсорбция обусловлена чисто физическими силами.
На поверхности адсорбента нет активных центров. Адсорбционные силы действуют вблизи от поверхности и образуют около этой поверхности непрерывное силовое поле.
Адсорбционные силы действуют на сравнительно большие расстояния, благодаря чему образуется у поверхности адсорбента адсорбционный объем.
Действие адсорбционных сил по мере удаления от поверхности уменьшается и на некотором расстоянии становится равным нулю.
Притяжение молекулы адсорбтива поверхностью не зависит от наличия в адсорбционном, пространстве других молекул.
Адсорбционные силы не зависят от температуры, т.е. с изменением температуры адсорбционный объем не изменяется.
Силовое поле у поверхности по этой теории сравнивают с гравитационным полем.

Рис. 7.7. Схема адсорбционного объема.
В зависимости от условий адсорбции и природы адсорбента и адсорбтива применима теория Ленгмюра или Поляни. Обобщенная теория была развита Брунауэром, Эмметом и Теллером (1935-1940 г.). Их теория получила название БЭТ.
Основные положения теории БЭТ:
На поверхности адсорбента имеется определенное количество равноценных в энергетическом отношении центров, способных удерживать молекулы адсорбтива.
Допускается, что взаимодействие между соседними адсорбированными молекулами отсутствует.
Каждая молекула первого слоя является активным центром для адсорбции и образования второго адсорбционного слоя, и т.д.
Предполагается, что все молекулы во втором и более далеких слоях имеют такую же сумму статических состояний как в жидком состоянии, которое отличается от суммы состояний первого слоя.

Рис. 7.8. Схема полимолекулярной адсорбции,
принятая по теории БЭТ.
На основе этих представлений Брунауэр, Эммет и Теллер предложили уравнение изотермы адсорбции паров:
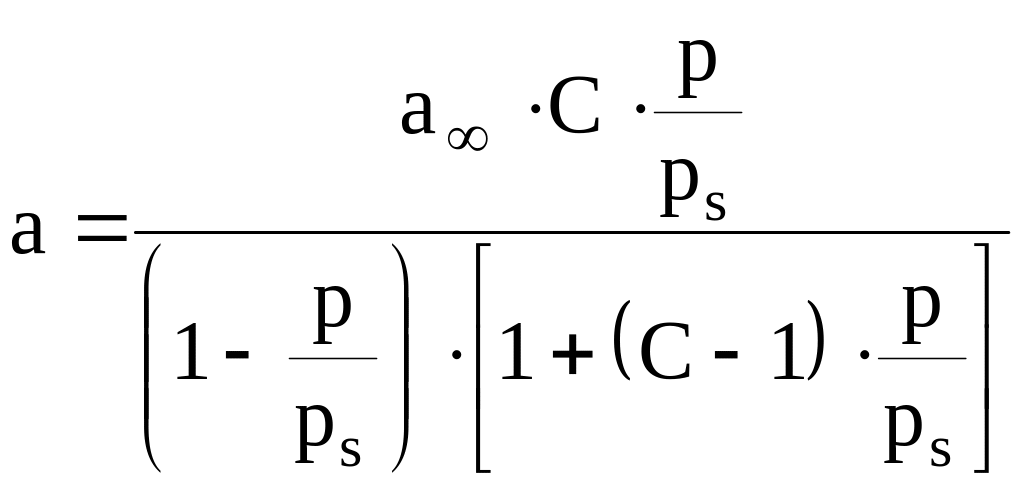
где - давление пара;
![]() - давление насыщенного пара при данной
температуре;
- давление насыщенного пара при данной
температуре;
![]() -
относительное давление пара;
-
относительное давление пара;
С - константа равновесия полимолекулярной сорбции.
При далеких от и С1, адсорбция мономолекулярная и уравнение БЭТ переходит в уравнение Лэнгмюра.
По мере приближения
к
число свободных активных центров
сокращается. При
![]() происходит объемная конденсация
пара.
происходит объемная конденсация
пара.
Уравнение БЭТ легко приводится к линейной форме:
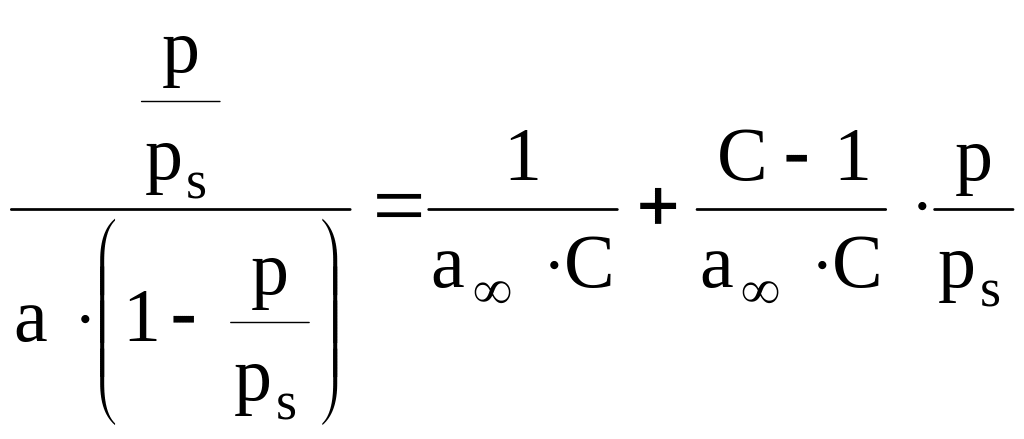
По наклону прямой и отсекаемому на оси
ординат отрезку находят
![]() и
.
Найдя
можно вычислить удельную поверхность
адсорбента
и
.
Найдя
можно вычислить удельную поверхность
адсорбента
![]() ,
где
,
где![]() - площадь, занимаемая одной молекулой;
- площадь, занимаемая одной молекулой;
![]() - число Авогадро.
- число Авогадро.
![]() найденное с помощью теории БЭТ, совпадают
со значениями, полученными неадсорбционными
методами, что свидетельствует о
правильности теории БЭТ.
найденное с помощью теории БЭТ, совпадают
со значениями, полученными неадсорбционными
методами, что свидетельствует о
правильности теории БЭТ.
