
- •Тепловое излучение: основные понятия и законы. Квантовая гипотеза Планка и формула Планка
- •Корпускулярные свойства света. Корпускулярно-волновой дуализм свойств света
- •Волновые свойства частиц вещества
- •Дискретность состояний микрообъектов. Постулаты Бора, опыты Франка и Герца, опыты Штерна и Герлаха
- •Механизм распадов
- •Ядерные реакции, их классификации. Деление ядер под действием нейтронов, цепная реакция деления. Ядерные реакторы
Дискретность состояний микрообъектов. Постулаты Бора, опыты Франка и Герца, опыты Штерна и Герлаха
Для объяснения закономерностей в линейчатых спектрах Бор объединил планетарную модель атома Резерфорда с гипотезой Планка о квантовой природе света. Теория атома Бора основывается на двух постулатах:
Первый постулат Бора (постулат стационарных состояний): атомная система может находиться только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенное (дискретное) значение энергии En. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. В стационарных состояниях атом не излучает
Правило квантования орбит Бора утверждает: в стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь квантованные значения момента импульса, удовлетворяющие условию
meυrn = nh (n =1, 2, 3, …) ,
где me — масса электрона, υ — его скорость на n -й орбите радиуса rn , h = h/ (2π ).
n - главное квантовое число, которое определяет энергетические уровни электрона в атоме.
Второй постулат Бора (правило частот): при переходе атома из одного состояния в другое испускается или поглощается один фотон с энергией
hν = En − Em ,
равной разности энергий соответствующих стационарных состояний.
Набор всевозможных дискретных частот квантовых переходов:
hν = En − Em
определяет линейчатый спектр атома.
Э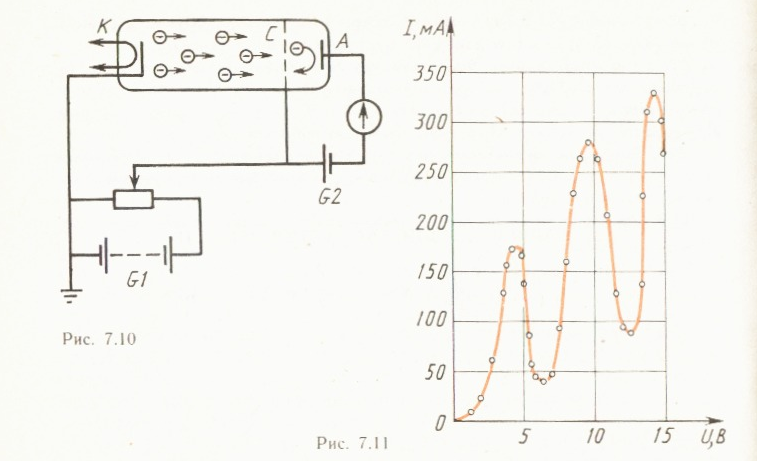 кспериментально
существование в атомах стационарных
состояний было
доказано в
опытах Франка и Герца.
кспериментально
существование в атомах стационарных
состояний было
доказано в
опытах Франка и Герца.
Э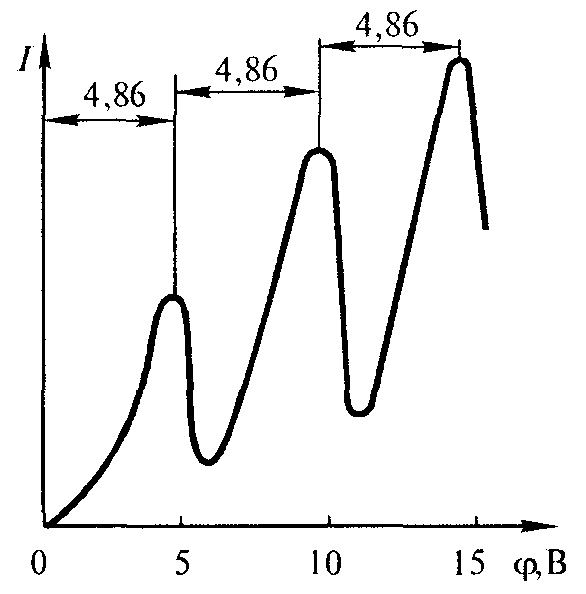 лектроны,
эмитированные катодом K
, разгоняются
в области 1 под
действием ускоряющей разности потенциалов
ϕ между катодом и сеткой C1
. В области 2 электроны проходят через
пары ртути и достигают анода A.
Первое возбужденное состояние атома
ртути имеет энергию 4,86 эВ. При увеличении
ускоряющего потенциала ϕ до этой
величины, соударения электронов с
атомами становятся неупругими: электрон
отдает кинетичес кую
энергию атому, возбуждая переход из
основного энергетического состояния
в первое возбужденное состояние
(поглощение
энергии
атомами ртути) — ток
в установке резко уменьшается.
При дальнейшем увеличении ϕ , подобное
же поведение т ока наблюдается при
энергиях, кратных
ΔE
=4,86 эВ, когда
электроны испытывают 2, 3, … неупругих
соударений. Таким образом, в атоме
действительно существуют стационарные
состояния (подтверждение первого
постулата Бора). Возбужденные атомы
ртути, переходя в основное состояние,
излучают
кванты
света с длиной волны λ = 255нм (подтверждение
второго постулата Бора).
лектроны,
эмитированные катодом K
, разгоняются
в области 1 под
действием ускоряющей разности потенциалов
ϕ между катодом и сеткой C1
. В области 2 электроны проходят через
пары ртути и достигают анода A.
Первое возбужденное состояние атома
ртути имеет энергию 4,86 эВ. При увеличении
ускоряющего потенциала ϕ до этой
величины, соударения электронов с
атомами становятся неупругими: электрон
отдает кинетичес кую
энергию атому, возбуждая переход из
основного энергетического состояния
в первое возбужденное состояние
(поглощение
энергии
атомами ртути) — ток
в установке резко уменьшается.
При дальнейшем увеличении ϕ , подобное
же поведение т ока наблюдается при
энергиях, кратных
ΔE
=4,86 эВ, когда
электроны испытывают 2, 3, … неупругих
соударений. Таким образом, в атоме
действительно существуют стационарные
состояния (подтверждение первого
постулата Бора). Возбужденные атомы
ртути, переходя в основное состояние,
излучают
кванты
света с длиной волны λ = 255нм (подтверждение
второго постулата Бора).
Теория Бора сыграла огромную роль в создании атомной физики, в развитии атомной и молекулярной спектроскопии, но ее внутренняя противоречивость — соединение классических и квантовых представлений — не позволили на ее основе объяснить спектры многоэлектронных атомов (даже простейшего из них — атома гелия, содержащего помимо ядра два электрона). Дальнейшее развитие теория Бора получила на основе дополнительных квантовых ограничений введением еще трех квантовых чисел.
Орбитальное (азимутальное) квантовое число l при заданном n принимает значения:
l = 0,1, 2,… (n −1)
и определяет величину момента импульса (механического орбитального момента) электрона в атоме:
 )
)
Состояние электрона, обладающего различными значениями орбитального квантового числа, принято обозначать следующим образом:
l= 0 s- состояние, l= 1 p- состояние, l= 2 d- состояние,
l= 3 f- состояние. И т.д.
Кроме механического
орбитального момента импульса
 электрон обладает и орбитальным магнитным
моментом
электрон обладает и орбитальным магнитным
моментом .
Между ними
существует связь
.
Между ними
существует связь
 ,
,

При этом существует так называемое пространственное квантование – момент импульса электрона может иметь лишь такие ориентации в пространстве, при которых проекция вектора момента импульса на направление z внешнего магнитного поля принимает квантованные значения
Lz
= m .
.
При этом m - магнитное квантовое число при данном l принимает значения:
m = 0, ±1, ± 2,…, ± l
и определяет величину момента импульса электрона в заданном направлении.
Таким образом, вектор может принимать 2l +1 ориентаций в пространстве. Соответственно, в магнитном поле уровень с главным квантовым числом n расщепляется на 2l +1 подуровней — эффект Зеемана.
В квантовой механике квадрат модуля волновой функции определяет вероятность обнаружения электрона в единице объема. Вероятность обнаружения электрона в разных частях атома различна. Электрон при своем движении как бы "размазан" по всему объему, образуя электронное облако, плотность (густота) которого характеризует вероятность нахождения электрона в различных точках объема атома. Квантовые числа n и l характеризуют размер и форму электронного облака, а квантовое число m характеризует ориентацию электронного облака в пространстве.
С. Гаудсмит и Дж.Уленбек высказали предположение о том, что электрон обладает собственным неуничтожимым механическим моментом импульса, не связанным с движением электрона в пространстве, - спином.
С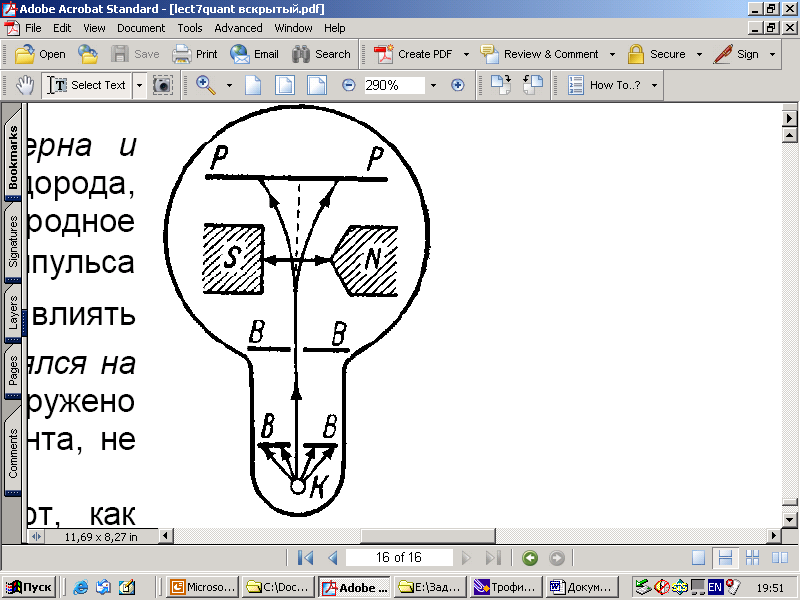 пин
был обнаружен в экспериментах
Штерна и Герлаха при
прохождении узкого пучка атомов водорода,
находящихся в s
-состоянии
через сильное неоднородное магнитное
поле. В этом состоянии l
= 0, момент
импульса L0
= h l(l
+1) = 0 и магнитное
поле не должно было влиять на движение
атомов. Однако пучок атомов расщеплялся
на два пучка,
следовательно, было обнаружено
пространственное квантование механического
момента, не связанного с орбитальным
движением электрона.
пин
был обнаружен в экспериментах
Штерна и Герлаха при
прохождении узкого пучка атомов водорода,
находящихся в s
-состоянии
через сильное неоднородное магнитное
поле. В этом состоянии l
= 0, момент
импульса L0
= h l(l
+1) = 0 и магнитное
поле не должно было влиять на движение
атомов. Однако пучок атомов расщеплялся
на два пучка,
следовательно, было обнаружено
пространственное квантование механического
момента, не связанного с орбитальным
движением электрона.
Спин электрона (и всех других микрочастиц) - внутреннее неотъемлемое квантовое свойство микрочастицы: подобно тому как частицы имеют массу, а заряженные частицы — заряд, они имеют еще и спин.
Из общих выводов квантовой механики следует, что спин должен быть квантован по закону

Где s – спиновое квантовое число
Из опытов Штерна-Герлаха следует, что для спина электрона возможны две ориентации в магнитном поле, значит

При
этом проекция вектора
 на направление внешнего магнитного
поля также квантованная величина и
определяется по формуле
на направление внешнего магнитного
поля также квантованная величина и
определяется по формуле
Lsz = ms
где
 - магнитное
спиновое квантовое число.
- магнитное
спиновое квантовое число.
Таким образом, состояние электрона в атоме определяется набором четырех квантовых чисел:
- главного n (n =1, 2, 3,…)
- орбитального l (l = 0, 1, 2, …, n −1)
- магнитного m (m = 0, ±1, ± 2,…, ± l )
- магнитного
спинового ms

