0-й закон — нулевое начало термодинамики: Постулирует существование термодинамического равновесия и вводит понятие абсолютной температуры.
Термодинамическое
равновесие. Для
каждой изолированной термодинамической
системы существует состояние
термодинамического равновесия, которого
она при фиксированных внешних условиях
с течением времени самопроизвольно
достигает. Если две изолированные
системы ![]() и
и ![]() приведены
в контакт друг с другом, то после
достижения термодинамического равновесия
полной системой
приведены
в контакт друг с другом, то после
достижения термодинамического равновесия
полной системой ![]() системы
и
находятся
в состоянии теплового (термического)
равновесия друг с другом. При этом каждая
из систем
и
в
отдельности также находится в состоянии
термодинамического равновесия. Это
равновесие не нарушится, если устранить
контакт между системами, а затем
восстановить его. Следовательно, если
установление контакта между двумя
системами
и
,
которые до этого были изолированными,
не приводит ни к каким изменениям, то
эти системы находятся в тепловом
равновесии друг с другом.
системы
и
находятся
в состоянии теплового (термического)
равновесия друг с другом. При этом каждая
из систем
и
в
отдельности также находится в состоянии
термодинамического равновесия. Это
равновесие не нарушится, если устранить
контакт между системами, а затем
восстановить его. Следовательно, если
установление контакта между двумя
системами
и
,
которые до этого были изолированными,
не приводит ни к каким изменениям, то
эти системы находятся в тепловом
равновесии друг с другом.
* 1-й закон — первое начало термодинамики: Представляет собой формулировку обобщённого закона сохранения энергии для термодинамических процессов. В наиболее простой форме его можно записать как
![]() ,
,
где ![]() есть
полный дифференциал внутренней энергии
системы, а
есть
полный дифференциал внутренней энергии
системы, а ![]() и
и ![]() есть
элементарное количество теплоты,
переданное системе, и элементарная
работа, совершенная системой соответственно.
Нужно учитывать, что
и
нельзя
считать дифференциалами в обычном
смысле этого понятия, поскольку эти
величины существенно зависят от типа
процесса, в результате которого состояние
системы изменилось.
есть
элементарное количество теплоты,
переданное системе, и элементарная
работа, совершенная системой соответственно.
Нужно учитывать, что
и
нельзя
считать дифференциалами в обычном
смысле этого понятия, поскольку эти
величины существенно зависят от типа
процесса, в результате которого состояние
системы изменилось.
* 2-й закон — второе начало термодинамики: Второй закон термодинамики исключает возможность создания вечного двигателя второго рода. Имеется несколько различных, но в то же время эквивалентных формулировок этого закона.
1 — Постулат Клаузиуса. Процесс, при котором не происходит других изменений, кроме передачи теплоты от горячего тела к холодному, является необратимым, то есть теплота не может перейти от холодного тела к горячему без каких-либо других изменений в системе. Это явление называют рассеиванием или диссипацией энергии.
Приведем
второе начало термодинамики в ещё одной
формулировке Рудольфа
Юлиуса Клаузиуса (1865):
для любой квазиравновесной термодинамической
системы существует однозначная функция
термодинамического состояния ![]() ,
называемая энтропией, такая, что ее
полный дифференциал
,
называемая энтропией, такая, что ее
полный дифференциал ![]() . [3]
. [3]
2 — Постулат Кельвина. Процесс, при котором работа переходит в теплоту без каких-либо других изменений в системе, является необратимым, то есть невозможно превратить в работу всю теплоту, взятую от источника с однородной температурой, не проводя других изменений в системе.
* 3-й закон — третье начало термодинамики: Теорема Нернста: энтропия любой равновесной системы при абсолютном нуле температуры всегда равна нулю (традиционная формулировка). Здесь важно различать аксиомы, отражающие законы природы, и имеющие исторические корни соглашения, необходимые для построения шкалы измерения соответствующей термодинамической величины. Так, аксиомами являются утверждения, что и энтропия, и температура есть односторонне ограниченные величины, и что своих граничных значений обе величины достигают одновременно. Согласно стандартным соглашениям принято, что и энтропия, и температура ограничены снизу, т. е. не могут быть меньше некоторых предельных значений. Из этого логично вытекают следующие соглашения, согласно которым наименьшее значение энтропии принято равным нулю, а наименьшее (нулевое) значение температуры служит реперной точкой для построения термодинамической шкалы температур.
2-3 Изменения состояния
Вы можете проследить изменения состояния газа при переходе от одной до другой точки на графике р/V. В действительности были бы нужны три оси для переменных р, V и Т. При изменении состояния вы перемещаетесь вдоль кривой на поверхности, которая при этом образуется в пространстве. Однако обычно вы рассматриваете проекцию кривой на одну из трех плоскостей, чаще всего на плоскость р/V. В основном различают между собой пять изменений состояния: изохорный процесс (при постоянном объеме), изобарный процесс (при постоянном давлении), изотермический процесс (при постоянной температуре), изоэнтропический или адиабатический процесс (без теплообмена с окружающей средой) и политропический процесс(когда теплообмен с окружающей средой описывается простыми математическими функциями).
|
|
Изохорное изменение состояния представляет собой изменение давления при постоянном объеме |
|
|
|
Нагрев газа в закрытом резервуаре является примером изохорного процесса. Для определения количества подводимой теплоты используется следующее соотношение:
|
|
|
|
|
|
Где: q - количество теплоты, Дж m - масса, кг cv - теплоёмкость при постоянном объёме, Дж/(кг×K) T - абсолютная температура, К
|
|
Изобарное изменение состояния представляет собой изменение объема при постоянном давлении |
|
|
|
Примером изобарного процесса является нагрев газа в цилиндре, когда к поршню приложено постоянное усилие. Для определения количества подводимой теплоты используется следующее соотношение:
|
|
|
|
|
|
Где: q - количество теплоты, Дж m - масса, кг cp - теплоёмкость при постоянном объёме, Дж/(кг×K) T - абсолютная температура, К
|
|
Изотермическое изменение состояния представляет собой процесс, в котором при постоянной температуре газовой смеси изменяются давление и объем. |
|
|
|
Если газ в цилиндре сжимается изотермически, нужно постепенно отводить количество теплоты, равное работе приложенной силы. Это практически невозможно, так как такой медленный процесс трудно реализовать. Для определения количества отводимой теплоты используются следующие соотношения:
|
|
|
|
|
|
Где: q - количество теплоты, Дж m - масса, кг R - индивидуальная газовая постоянная, Дж/(кг×K) T - абсолютная температура, К p - абсолютное давление, Па Политропический процесс
Изотермический процесс идет при полном теплообмене с окружающей средой, а изоэнтропический процесс происходит совсем без теплообмена. В действительности любой процесс является чем-то промежуточным между этими предельными случаями, а такой общий процесс называется политропическим. Этот процесс описывается следующим выражением:
|
|
|
|
|
|
Где: p - абсолютное давление, Па V - объём, м3 n - 0 для изобарного процесса n - 1 для изотермического процесса n - æ для изоэнтропического процесса n - ∞ для изохорного процесса
Физический смысл адиабатического процесса
Если
термодинамический процесс в общем
случае являет собой три процесса —
теплообмен, совершение системой (или
над системой) работы и изменение её
внутренней энергии[5],
то адиабатический процесс в силу
отсутствия теплообмена (![]() )
системы со средой сводится только к
последним двум процессам[6].
Поэтому, первое
начало термодинамики в
этом случае приобретает вид
)
системы со средой сводится только к
последним двум процессам[6].
Поэтому, первое
начало термодинамики в
этом случае приобретает вид
![]() где
где ![]() —
изменение внутренней
энергии тела,
—
изменение внутренней
энергии тела, ![]() — работа,
совершаемая системой.
— работа,
совершаемая системой.
Изменения энтропии S системы
в обратимом адиабатическом процессе
вследствие передачи тепла через границы
системы не происходит[8]:![]()
Здесь ![]() —
температура системы,
—
температура системы, ![]() —
теплота, полученная системой. Благодаря
этому адиабатический процесс может
быть составной частью обратимого
цикла[8].
—
теплота, полученная системой. Благодаря
этому адиабатический процесс может
быть составной частью обратимого
цикла[8].
![]()

График
адиабаты (жирная линия) на ![]() диаграмме
для газа.
диаграмме
для газа.
![]() —
давление газа;
—
давление газа;
![]() —
объём.
—
объём.
4 Вода́ (оксид водорода) — бинарное неорганическое соединение, химическая формула Н2O. Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеет цвета (в малом объёме), запаха и вкуса.
Водяной пар — газообразное состояние воды. Не имеет цвета, вкуса и запаха. Содержится в тропосфере.
Образуется молекулами воды при её испарении. При поступлении водяного пара в воздух он, как и все другие газы, создаёт определённое давление, называемое парциальным.[1] Оно выражается в единицах давления — паскалях. Водяной пар может переходить непосредственно в твёрдую фазу — в кристаллы льда. Количество водяного пара в граммах, содержащегося в 1 кубическом метре, называют абсолютной влажностью воздуха.
h, s-диаграммы

H, s-диаграммы чаще всего содержат в себе данные о свойствах воды в жидком и газообразном состояниях, так как они представляют наибольший интерес с точки зрения теплотехники.
Степень сухости - это параметр, показывающий массовую долю насыщенного пара в смеси воды и водяного пара. Значение x = 0 соответствует воде в момент кипения (насыщения). Значение х = 1, показывает, что в смеси присутствует только пар. При нанесении соответствующих точек в координатах (h,s), взятых из таблиц насыщения справочников свойств воды и водяного пара, при их соединении получаются кривые, соответствующие определённым степеням сухости. В таком случае, линия х = 0 является нижней пограничной кривой, а х = 1 - верхней пограничной кривой. Область, заключённая между этими кривыми, является областью влажного пара. Область ниже кривой х = 0, которая стягивается практически в прямую линию (не показана), соответствует воде. Область выше кривой х = 1 - соответствует состоянию перегретого пара.
Критическая точка (К). При определённом, достаточно высоком давлении, называемом критическим, свойства воды и пара становятся идентичными. То есть исчезают физические различия между жидким и газообразным состояниями вещества. Такое состояние называют критическим состоянием вещества, которому соответствует положение критической точки. Следует заметить, что она на пограничной кривой лежит гораздо левее максимума этой кривой.
Изотерма - изолиния, построенная методом объединения точек по значениям энтальпии и энтропии, соответствующих определённой температуре. Изотермы пересекают пограничные кривые с изломом и, по мере удаления от верхней пограничной кривой, асимптотически приближаются к горизонтали. На схеме для упрощения представлены только три изотермы:
5 Цикл Карно́ — идеальный термодинамический цикл. Тепловая машина Карно, работающая по этому циклу, обладает максимальным КПД из всех машин, у которых максимальная и минимальная температуры осуществляемого цикла совпадают соответственно с максимальной и минимальной температурами цикла Карно. Состоит из 2 адиабатических и 2 изотермических процессов.
Одним из важных свойств цикла Карно является его обратимость: он может быть проведён как в прямом, так и в обратном направлении, при этомэнтропия адиабатически изолированной (без теплообмена с окружающей средой) системы не меняется.
Описание цикла
 Цикл
Карно состоит из четырёх стадий:
Цикл
Карно состоит из четырёх стадий:
Изотермическое расширение (на рисунке — процесс A→Б). В начале процесса рабочее тело имеет температуру
 ,
то есть температуру нагревателя. Затем
тело приводится в контакт с нагревателем,
который изотермически (при постоянной
температуре) передаёт ему количество
теплоты
,
то есть температуру нагревателя. Затем
тело приводится в контакт с нагревателем,
который изотермически (при постоянной
температуре) передаёт ему количество
теплоты  .
При этом объём рабочего тела увеличивается.
.
При этом объём рабочего тела увеличивается.Адиабатическое (изоэнтропическое) расширение (на рисунке — процесс Б→В). Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника.
Изотермическое сжатие (на рисунке — процесс В→Г). Рабочее тело, имеющее к тому времени температуру
 ,
приводится в контакт с холодильником
и начинает изотермически сжиматься,
отдавая холодильнику количество
теплоты
,
приводится в контакт с холодильником
и начинает изотермически сжиматься,
отдавая холодильнику количество
теплоты 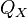 .
.Адиабатическое (изоэнтропическое) сжатие (на рисунке — процесс Г→А). Рабочее тело отсоединяется от холодильника и сжимается без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя.
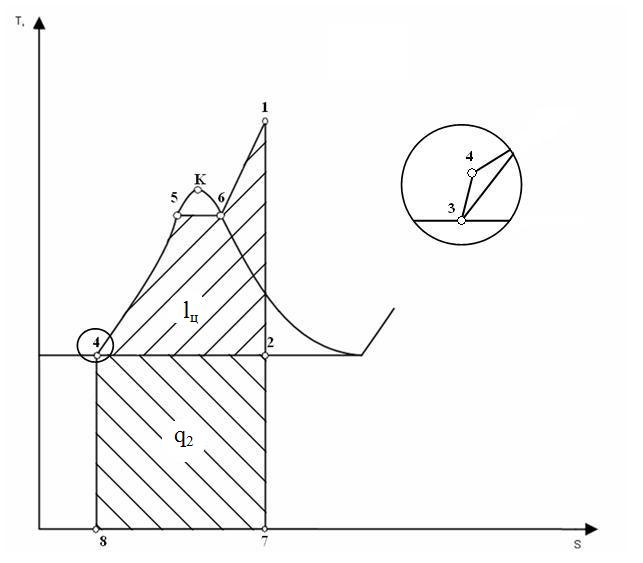
6 Цикл Ренкина — термодинамический цикл преобразования тепла в работу с помощью водяного пара
Термодинамические исследования цикла Ренкина показывают, что его эффективность в большей степени зависит от величин начальных и конечных параметров (давления и температуры) пара.
Цикл
Ренкина состоит из следующих процессов:
![]()
изобара линия 4-5-6-1. Происходит нагрев и испарение воды, а затем перегрев пара. В процессе затрачивается теплота
 .
.
адиабата линия 1-2. Процесс расширения пара в турбине, то есть её вращение паром (
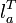 ).
).
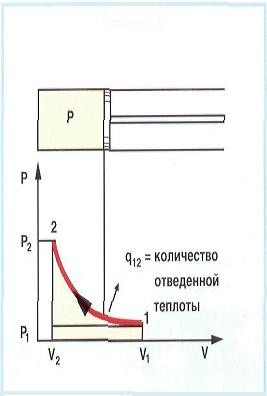
изобара линия 2-3 Конденсация отработанного пара с отводом теплоты
 охлаждающей
водой.
охлаждающей
водой.
адиабата линия 3-4. Сжатие сконденсировавшейся воды до первоначального давления в парогенераторе с затратой работы
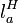 фреоном
фреоном
 .
.
7 Цикл Брайтона/Джоуля — термодинамический цикл, описывающий рабочие процессы газотурбинного, турбореактивного и прямоточного воздушно-реактивного двигателей внутреннего сгорания, а также газотурбинных двигателей внешнего сгорания с замкнутым контуром газообразного (однофазного) рабочего тела.
Цикл назван в честь американского инженера Джорджа Брайтона, который изобрёл поршневой двигатель внутреннего сгорания, работавший по этому циклу.
Иногда этот цикл называют также циклом Джоуля — в честь английского физика Джеймса Джоуля, установившего механический эквивалент тепла.

Идеальный цикл Брайтона состоит из процессов
1—2 Изоэнтропическое сжатие.
2—3 Изобарический подвод теплоты.
3—4 Изоэнтропическое расширение.
4—1 Изобарический отвод теплоты.
КПДпоказатель адиабаты
Таким
образом, КПД цикла Брайтона зависит от
начальной (![]() )
и конечной температур (
)
и конечной температур (![]() )
процесса сжатия ровно так же, как и КПД
цикла Карно. При бесконечно малой
величине нагрева рабочего тела по линии
(2-3) процесс можно считать изотермическим
и полностью эквивалентным циклу Карно.
Величина нагрева рабочего тела
)
процесса сжатия ровно так же, как и КПД
цикла Карно. При бесконечно малой
величине нагрева рабочего тела по линии
(2-3) процесс можно считать изотермическим
и полностью эквивалентным циклу Карно.
Величина нагрева рабочего тела ![]() при
изобарическом процессе определяет
величину работы отнесённую к количеству
использованного в цикле рабочего тела
и не влияет на рассчитанный по вышеуказанной
формуле термический КПД цикла.
при
изобарическом процессе определяет
величину работы отнесённую к количеству
использованного в цикле рабочего тела
и не влияет на рассчитанный по вышеуказанной
формуле термический КПД цикла.
8 Цикл Отто — термодинамический цикл, описывающий рабочий процесс двигателя внутреннего сгорания с воспламенением сжатой смеси от постороннего источника энергии, цикл бензинового двигателя. Назван в честь немецкого инженера Николауса Отто.Идеальный цикл Отто состоит из четырёх процессов:
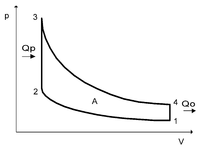 p-V
диаграмма цикла Отто
p-V
диаграмма цикла Отто
1—2 адиабатное сжатие рабочего тела;
2—3 изохорный подвод теплоты к рабочему телу;
3—4 адиабатное расширение рабочего тела;
4—1 изохорное охлаждение рабочего тела.
КПД
цикла Отто ![]() ,
где
,
где ![]() —
степень сжатия,
—
степень сжатия,
![]() —
показатель адиабаты.
—
показатель адиабаты.
8 Цикл Дизеля — термодинамический цикл, описывающий рабочий процесс двигателя внутреннего сгорания с воспламенением впрыскиваемого топлива от разогретого рабочего тела, цикл дизельного двигателя. Идеальный цикл Дизеля состоит из четырёх процессов:

p-V диаграмма цикла Дизеля
1—2 адиабатное сжатие рабочего тела;
2—3 изобарный подвод теплоты к рабочему телу;
3—4 адиабатное расширение рабочего тела;
4—1 изохорное охлаждение рабочего тела.
КПД
цикла Дизеля  ,
где
—
степень сжатия,
,
где
—
степень сжатия,
![]() —
коэффициент
предварительного расширения,
—
коэффициент
предварительного расширения,
— показатель адиабаты.
8 Цикл Тринклера — термодинамический цикл, описывающий рабочий процесс дизельного двигателя со смешанным сгоранием. Объединяет в себе цикл Отто и цикл Дизеля. Носит имя своего изобретателя Густава Тринклера.Идеальный цикл Тринклера состоит из процессов:

p-V диаграмма цикла Тринклера
1—2 В рабочем цилиндре воздух адиабатически сжимается за счет инерции маховика, сидящего на валу двигателя, нагреваясь при этом до температуры, обеспечивающей воспламенение топливно-воздушной смеси.
2—3 Сгорание части топлива в небольшом объеме форкамеры (V=const).
3—4 Догорание оставшегося топлива в рабочем цилиндре (P=const).
4—5 Адиабатическое расширение продуктов сгорания.
5—1 Удаление выхлопных газов (V=const).
Жидкое топливо, введенное в форкамеру при сравнительно невысоком давлении, распыляется струей сжатого воздуха, поступающего из основного цилиндра. Вместе с тем цикл со смешанным сгоранием частично сохраняет преимущества цикла Дизеля перед циклом Отто — часть процесса сгорания осуществляется при постоянном давлении.
Термический КПД цикла
Тринклера ![]() ,
,
где — степень сжатия,
![]() —
степень
предварительного расширения,
—
степень
предварительного расширения,
![]() —
степень
повышения давления при изохорном
процессе сгорания,
—
степень
повышения давления при изохорном
процессе сгорания,
— показатель адиабаты.
9 Теплопередача — физический процесс передачи тепловой энергии от более горячего тела к более холодному либо непосредственно (при контакте), либо через разделяющую (тела или среды) перегородку из какого-либо материала. Когда физические тела одной системы находятся при разной температуре, то происходит передача тепловой энергии, или теплопередача от одного тела к другому до наступления термодинамического равновесия. Самопроизвольная передача тепла всегда происходит от более горячего тела к более холодному, что является следствием второго закона термодинамики
Теплопрово́дность — это процесс переноса внутренней энергии от более нагретых частей тела (или тел) к менее нагретым частям (или телам), осуществляемый хаотически движущимися частицами тела (атомами, молекулами, электронами и т. п.). Такой теплообмен может происходить в любых телах с неоднородным распределением температур, но механизм переноса теплоты будет зависеть от агрегатного состояния вещества.Иногда теплопроводностью называется также количественная характеристика способности конкретного вещества проводить тепло. Численно эта характеристика равна количеству теплоты, проходящей через материал площадью 1 кв.м за единицу времени (секунду) при единичном температурном градиенте.
10 Закон теплопроводности Фурье
В установившемся режиме плотность потока энергии, передающейся посредством теплопроводности, пропорциональна градиенту температуры:
![]()
где ![]() —
вектор плотности теплового потока —
количество энергии, проходящей в единицу
времени через единицу площади,
перпендикулярной каждой оси,
—
вектор плотности теплового потока —
количество энергии, проходящей в единицу
времени через единицу площади,
перпендикулярной каждой оси, ![]() — коэффициент
теплопроводности-
параметр, характеризующий интенсивность
процесса теплопроводности в материале;
численно равен количеству теплоты,
переносимому через единицу поверхности
за единицу времени, при градиенте
температуры, равном единице. Рассчитывается
как отношение плотности теплового
потока к градиенту температуры. Выражают
в Вт/(мм К) или Вт/(м °С).,
—
температура. Минус в правой части
показывает, что тепловой поток направлен
противоположно вектору grad T (то есть в
сторону скорейшего убывания температуры).
Это выражение известно как закон
теплопроводности Фурье.[1]В
интегральной форме это же выражение
запишется так (если речь идёт о стационарном
потоке тепла от одной грани параллелепипеда к
другой):
— коэффициент
теплопроводности-
параметр, характеризующий интенсивность
процесса теплопроводности в материале;
численно равен количеству теплоты,
переносимому через единицу поверхности
за единицу времени, при градиенте
температуры, равном единице. Рассчитывается
как отношение плотности теплового
потока к градиенту температуры. Выражают
в Вт/(мм К) или Вт/(м °С).,
—
температура. Минус в правой части
показывает, что тепловой поток направлен
противоположно вектору grad T (то есть в
сторону скорейшего убывания температуры).
Это выражение известно как закон
теплопроводности Фурье.[1]В
интегральной форме это же выражение
запишется так (если речь идёт о стационарном
потоке тепла от одной грани параллелепипеда к
другой):
![]() где
где ![]() —
полная мощность тепловых потерь,
—
полная мощность тепловых потерь, ![]() —
площадь сечения параллелепипеда,
—
площадь сечения параллелепипеда, ![]() —
перепад температур граней,
—
перепад температур граней, ![]() —
длина параллелепипеда, то есть расстояние
между гранями.Коэффициент теплопроводности
измеряется в Вт/(м·K).
—
длина параллелепипеда, то есть расстояние
между гранями.Коэффициент теплопроводности
измеряется в Вт/(м·K).
11 Конве́кция (от лат. convectiō — «перенесение») — явление переноса теплоты в жидкостях или газах, или сыпучих средах потоками вещества. Существует т. н. естественная конвекция, которая возникает в веществе самопроизвольно при его неравномерном нагревании в поле тяготения. При такой конвекции нижние слои вещества нагреваются, становятся легче и всплывают, а верхние слои, наоборот, остывают, становятся тяжелее и опускаются вниз, после чего процесс повторяется снова и снова. При некоторых условиях процесс перемешивания самоорганизуется в структуру отдельных вихрей и получается более или менее правильная решётка из конвекционных ячеек.Различают ламинарную и турбулентную конвекцию.
Естественной конвекции обязаны многие атмосферные явления, в том числе, образование облаков. Благодаря тому же явлению движутся тектонические плиты. Конвекция ответственна за появление гранул на Солнце.
При вынужденной (принудительной) конвекции перемещение вещества обусловлено действием каких-то внешних сил (насос, лопасти вентилятора и т. п.). Она применяется, когда естественная конвекция является недостаточно эффективной.Конвекцией также называют перенос теплоты, массы или электрических зарядов движущейся средой.
12 Теплово́е излуче́ние или лучеиспускание — передача энергии от одних тел к другим в виде электромагнитных волн за счёт их тепловой энергии. Тепловое излучение в основном приходится на инфракрасный участок спектра, т.е на длины волн от 0,74 мкм до 1000 мкм. Отличительной особенностью лучистого теплообмена является то, что он может осуществляться между телами, находящимися не только в какой-либо среде, но и вакууме.
Примером теплового излучения является свет от лампы накаливания.
Мощность теплового излучения объекта, удовлетворяющего критериям абсолютно чёрного тела, описывается законом Стефана — Больцмана.Отношение излучательной и поглощательной способностей тел описывается законом излучения Кирхгофа.Тепловое излучение является одним из трёх элементарных видов переноса тепловой энергии (помимо теплопроводности и конвекции).Равновесное излучение — тепловое излучение, находящееся в термодинамическом равновесии с веществом.
Основные свойства теплового излучения
Тепловое излучение происходит по всему спектру частот от нуля до бесконечности
Интенсивность теплового излучения неравномерна по частотам и имеет явно выраженный максимум при определенной частоте
C ростом температуры общая интенсивность теплового излучения возрастает
C ростом температуры максимум излучения смещается в сторону больших частот (меньших длин волн)
Тепловое излучение характерно для тел независимо от их агрегатного состояния
Отличительным свойством теплового излучения является равновесный характер излучения. Это значит, что если мы поместим тело в термоизолированный сосуд, то количество поглощаемой энергии всегда будет равно количеству испускаемой энергии.
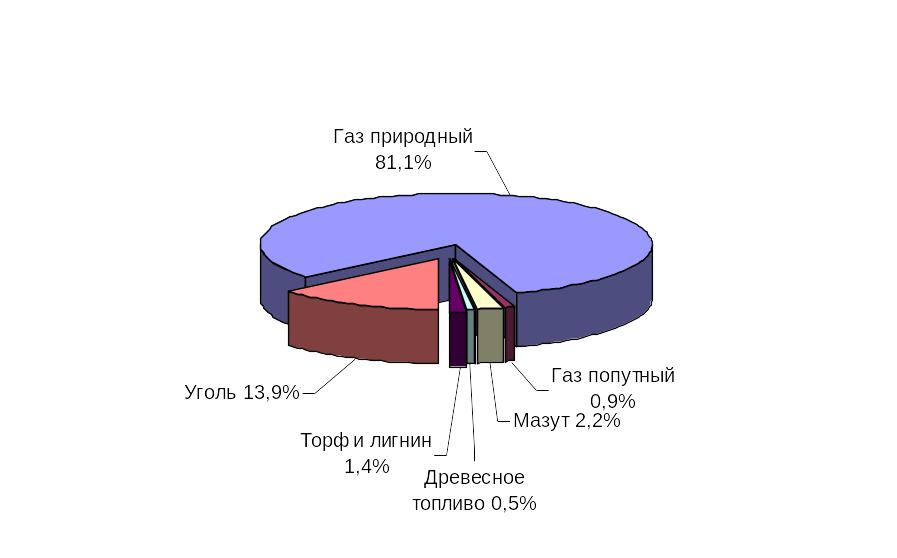
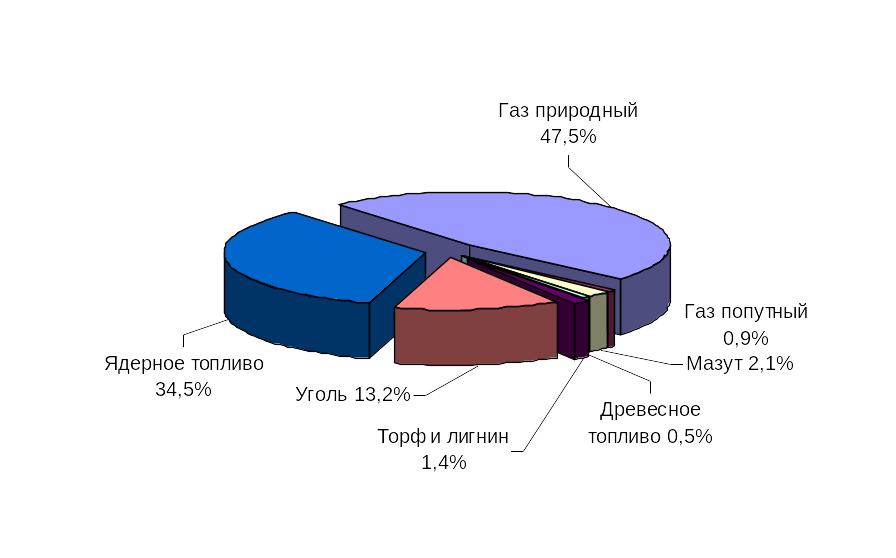
13 Структура топливного баланса рб
2010 2020
14 Топливно-энергетический комплекс Беларуси, его структура.Топливно-энергетический комплекс Беларуси, его структура. Топливно-энергетический комплекс (ТЭК) Беларуси состоит из топливной промышленности, электроэнергетики, и предприятий обеспечения потребителя электро- и тепловой энергией. Топливная промышленность - отрасль внутреннего значения. Она добывает и перерабатывает горючие полезные ископаемые: нефть, сопутствующий газ, торф. До середины 60-х гг. главным видом топлива Беларуси был торф. В последнее десятилетие вследствие истощения запасов торфа прекращено его сжигание на электростанциях. Он стал использоваться в основном как органическое удобрение и топливо для бытовых нужд (торфобрикеты). Ведущее место в топливном балансе республики принадлежит нефти и газу. В Ново-полоцке и Мозыре работают нефтеперерабатывающие заводы, производящие моторное топливо, смазочные масла, мазут для ТЭЦ. Своего топлива в Беларуси не хватает. В частности, природный газ республика получает из России по трем нитям газопровода Торжок-Минск-Ивацевичи. Строится газопровод Ямал-Европа, который пройдет по территории Беларуси. По трубопроводам "Дружба", Сургут-Полоцк из России поступает нефть. Электроэнергетика почти целиком представлена электростанциями (тепловыми). Среди них - государственные районные электростанции (ГРЭС). Имеется два их вида: ТЭЦ (теплоэлектроцентрали) дают горячую воду, пар; ТЭС - только электричество. Всего в Беларуси 11 электростанций, мощнейшие из них -Лукомльская ГРЭС (8,4 млн. кВт), Березовская ГРЭС, Минская ТЭЦ-4. Работает 16 небольших гидроэлектростанций (ГЭС). Наиболее крупная - Осиповичская на Свислочи. Единая энергосистема (передача энергии на расстояние) включает электростанции (всех видов), трансформаторные подстанции, соединенные (окольцованные) линиями электропередач. Единая энергосистема позволяет экономить энергию, рационально расходовать энергетические ресурсы, бесперебойно обеспечивать потребителей энергией, отключать станции для проведения их ремонта. Белорусская энергосистема является частью единой энергосистемы СНГ. В настоящее время электроэнергии республике не хватает. Для ее восполнения разработан проект строительства Зельвенской ГРЭС. Имеются предложения о строительстве АЭС. Одна из электроэнергетических проблем -неумелое и нерациональное использование электроэнергии.
15 Классификация энергетических видов топлива
естественное и искусственное
Твёрдые топлива
Древесина, древесная щепа, древесные пеллеты.Горючий сланецСапропельТорфУгольБитуминозные пескиПорохСоединения азотаТвёрдое ракетное топливо
Жидкие топлива
Просты в транспортировке, но при этом велики потери при испарении, разливах и утечках.
Нефтяные топливаДизельное топливо (газойль, соляровое масло)топливо печное бытовоеКеросинЛигроинБензин, газолин
МаслаСланцевое маслоОтработавшее машинное маслоРастительные (рапсовое, арахисовое) или животные масла (жиры)
СпиртыЭтанолМетанолПропанол
Жидкое ракетное топливо
Эфиры(Изомеры) спиртовМетил-трет-бутиловый эфир (МТБЭ)Диметиловый эфир (ДМЭ)жирных кислотЭтерифицированные растительные масла (биодизель)
ЭмульсииВодотопливная эмульсияЭтиловый спирт в бензинахМасла в бензинах
Синтетические топлива, производимые на основе процесса Фишера-ТропшаИз угля (CTL)Из биомассы (BTL)Из природного газа (GTL)