
- •3. Задача. Какое количество вещества гидроксида калия потребуется для полной нейтрализации 0,3 моль сероводородной кислоты?
- •1.Строение атомов химических элементов и закономерности в изменении их свойств на примере: а) элементов одного периода; б) элементов одной главной подгруппы.
- •2.Непредельные углеводороды ряда этилена, общая формула состава. Электронное и пространственное строение, химические свойства этилена
- •1. Виды химической связи: ковалентная (полярная и неполярная), ионная; их сходство и различие. Типы кристаллических решеток. Примеры веществ с различными типами решеток.
- •3. Задача. Рассчитайте массу пропена, вступившего в реакцию с водой, если в результате реакции образовалось 3,5 моль спирта.
- •2. Диеновые углеводороды, их строение, свойства, получение и практическое значение
- •2.Ацетилен – представитель углеводородов с тройной связью в молекуле. Химические свойства, получение и применение ацетилена в органическом синтезе
- •2. Ароматические углеводороды. Бензол, структурная формула, свойства и получение. Применение бензола и его гомологов
- •2. Реакции ионного обмена. Условия их необратимости.
- •2. Использование их в качестве топлива и в химическом синтезе
- •3. Задача. Оксид кальция массой 14 г взаимодействует с раствором, содержащим 35 г азотной кислоты. Определите массу получившейся соли.
- •3. Гомологический ряд альдегидов и кетонов.
- •1. Водородные соединения неметаллов. Закономерности в изменении их свойств в
- •2. Карбоновые кислоты - органические соединения, содержащие одну или несколько карбоксильных групп –соон, связанных с углеводородным радикалом.
- •2. «Жиры» их состав и свойства. Жиры в природе, превращение жиров в организме. Продукты технической переработки жиров, понятие о синтетических моющих средствах. Защита природы от загрязнения cmc.
- •1. Соли – это продукт полного или частичного замещения атомов водорода в молекуле кислоты на металл или же продукт полного или частичного замещения гидроксигрупп в основании на кислотный остаток
- •2. Аминокислоты, их строение и химические свойства: взаимодействие с соляной кислотой, щелочами, друг с другом. Биологическая роль аминокислот и их применение.
- •3. Взаимодействие со спиртами с образованием сложных эфиров.
- •5. Гидролиз дипептидов:
- •2. Взаимосвязь между важнейшими классами органических соединений.
- •2. Взаимное влияние атомов в молекулах органических веществ на примере этанола и фенола.
- •1. Причины многообразия неорганических и органических веществ; взаимосвязь веществ.
2. Реакции ионного обмена. Условия их необратимости.
В растворах электролитов реакции протекают между ионами.
Реакции ионного обмена — окислительно-восстановительная реакция, которая идет в направлении связывания ионов, но при которой не происходит изменения
степеней окисления.
Условия течения реакций в растворах электролитов до конца:
1) в результате реакции выпадает осадок:
![]()
2) в результате реакции выделяется газ:
![]()
3) в результате реакции образуется малодиссоциирующее вещество:
![]()
Ионный обмен – это процесс, в результате которого ионы,
находящиеся в твердой фазе. обмениваются с ионами, находящимися в растворе.
Нерастворимое твердое вещество может представлять собой какой-либо природный
материал либо синтетическую смолу. Природные материалы, используемые для
ионного обмена, включают цеолиты (комплексные алюмосиликаты натрия) и
глауконитовый песок.
Катионообменники. Катионообменные материалы состоят из трех частей:
1) основная масса, или скелет, обычно обозначаемый символом R–;
2) активные центры (такие
группы, как —![]() либо —
либо —![]() );
);
3) катионы, подлежащие обмену (обычно это ионы Н+ или Н3О+).
Когда твердый катионообменник приходит в соприкосновение с раствором, в
котором содержатся какие-либо ионы, между ними устанавливается равновесие.
Например,
![]()
Если первоначально раствор содержит, например, хлорид натрия, то ионы натрия
обмениваются с ионами водорода и из нижней части колонки вытекает
разбавленный раствор соляной кислоты.
Анионообменники. Анионообменник удаляет из раствора анионы. Типичным
примером анионного обмена является следующее равновесие:
![]()
Для регенерации анионообменника может использоваться какое-либо основание,
например раствор гидроксида натрия. Это сдвигает указанное равновесие влево.
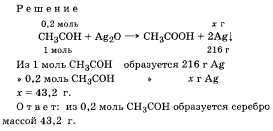
Задача.
Определите массу осадка, образовавшегося
в результате окисления 0,2 моль уксусного
альдегида избытком аммиачного раствора
оксида серебра.
БИЛЕТ 8
Главным элементом органических соединений является углерод, который может соединяться друг с другом с образованием прямых, разветвленных цепей, замкнутых циклов. Этим объясняется многообразие органических соединений, которых насчитывается около 18млн., а неорганических немногим более 100тыс. Атом углерода, получив квант энергии, перейдя в возбужденное состояние, может образовать четыре ковалентные малополярные связи, т.к. на последнем энергетическом уровне он имеет четыре непарных электрона в результате распаривания 2s – электронов и переходе одного из них на 2р – орбиталь. Такой атом углерода находится в sp3 – гибридном состоянии, т.к. подверглись гибридизации и образовали связи валентные электроны последнего уровня: один s – электрон и три р – электрона, отсюда и название “sp3 – гибридизация”.
Языком органической химии являются структурные формулы, в которых указан порядок соединения атомов друг с другом.
Черточка обозначает общую электронную пару, которую образовал углерод с непарным электроном атома водорода, и единицу валентности. Таким образом, атом углерода в органических соединениях четырехвалентен, а водород одновалентен.
Каждый последующий углеводород отличается от предыдущего на группу атомов СН2, которая называется гомологической разностью. Углеводороды образуют гомологический ряд, в котором гомологи имеют одинаковое строение, но отличаются друг от друга длиной цепи на одну или несколько групп СН2.
Общая формула таких углеводородов Сn Н 2n+2, где n – число атомов углерода.
Принята сокращенная форма записи структурных формул, в которых недостающее число черточек, т.е. валентностей атома углерода обозначается числом атомов водорода, присоединяющихся к нему по валентности.
Вывод: Структурные формулы веществ являются языком органической химии.
2 положение теории А.М. Бутлерова гласит: свойства веществ зависят не только от того, какие атомы и сколько входят в состав молекулы, но и от порядка их соединения друг с другом.
Второе положение теории А.М. Бутлерова объяснило явление изомерии – существование веществ с одинаковыми формулами, но разными свойствами.
Изомеры – вещества с одинаковым качественным и количественным составом, но разным строением, а, значит, и разными свойствами.
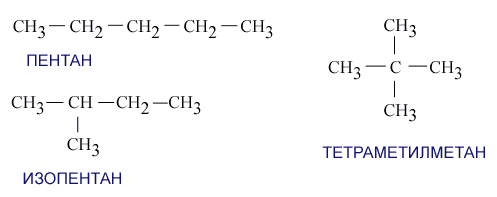
Алгоритм написания изомеров.
Написание изомеров начинают писать с углеводорода с неразветвленной цепью атомов углерода, т.е. с углеводорода нормального строения.
СН3 – СН2 – СН2 – СН2 – СН3
н - пентан
Все изомеры имеют одну и ту же формулу, значит число атомов углерода в них одинаково.
Основную углеродную цепь сокращают на один атом углерода и сокращенный атом присоединяют к одному из внутренних атомов углеродной цепи.
Изопентан
Исчерпывают все варианты написания изомеров с данной длиной цепи, затем снова сокращают основную углеродную цепь на один атом углерода и присоединяют его к одному из внутренних атомов цепи.
Так, углеводород формулы С5Н12 имеет три изомера.
Виды изомерии
Структурная изомерия:
1) изомерия углеродного скелета - изомеры отличаются строением углеродного скелета;
2) изомерия положения кратной связи – изомеры отличаются местом положения кратной связи;
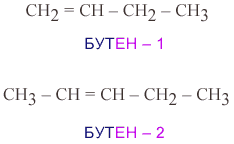
3) изомерия положения функциональной группы;
4) межклассовая изомерия. Соединения разных классов веществ с одинаковыми формулами, но разным строением. Пропен и циклопропан имеют формулу С3Н6.
межклассовая изомерия. Соединения разных классов веществ с одинаковыми формулами, но разным строением. Пропен и циклопропан имеют формулу С3Н6.
СН2
= СН – СН3
пропен
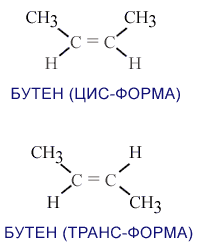
Геометрическая изомерия – изомеры отличаются тем, что одинаковые атомы или группы атомов располагаются по одну сторону от двойной связи (цис-изомеры) или по разные (транс-изомеры). Характерна для веществ с двойными связями и циклических соединений.
Оптическая изомерия. Характерна для веществ, содержащих асимметрический атом С, имеющий четыре различных заместителя. Такие молекулы несовместимы со своим зеркальным отражением. Примером такой молекулы является альфа – аланин.
2. Электролиз растворов и расплавов солей.Практическое значение электролиза.
Совокупность химических реакций, которые протекают на электродах в растворах
или расплавах при пропускании через них электрического тока, называется
электролизом.
Указанную совокупность реакций принято подразделять на первичные и
вторичные процессы. Первичные процессы — окислительно-восстановительные
реакции, протекающие на электродах и ведущие, как правило, к образованию
электрически нейтральных активных молекулярных или атомных частиц. Вторичные
процессы — реакции взаимодействия активных частиц, образовавшихся в первичных
процессах, со средой. Например, при электролизе раствора сульфата натрия
протекают следующие электродные реакции:
Первичные реакции
![]()
Вторичные реакции
![]()
Приведенная совокупность химических реакций может быть представлена
суммарным процессом:
![]()
Из этого примера видно, что при электролизе, как и при работе химического
источника тока, на аноде происходят процессы окисления, а на катоде —
восстановления. При этом анод заряжен положительно (+), а катод —
отрицательно (—). Отметим, что при работе химического источника тока,
напротив, анод заряжается отрицательно, а катод — положительно, поскольку в
этом случае протекают процессы, обратные электролизу.
При электролизе как на аноде, так и на катоде могут происходить конкурирующие
процессы.
При проведении электролиза с использованием инертного (нерасходуемого)
анода (например, графита), как правило, конкурирующими являются два
окислительных и два восстановительных процесса:
на аноде — окисление анионов и гидроксид-ионов
на катоде — восстановление катионов и ионов водорода
При проведении электролиза с использованием активного (расходуемого)
анода процесс усложняется и конкурирующими реакциями на электродах являются
следующие:
на аноде — окисление анионов и гидроксид-ионов;
анодное растворение металла — материала анода
на катоде — восстановление катиона соли и ионов водорода;
восстановление катионов металла, полученных при растворении анода
При выборе наиболее вероятного процесса на аноде и катоде следует исходить
из положения, что будет протекать та реакция, для которой требуется
наименьшая затрата энергии. Кроме того, для выбора наиболее вероятного
процесса на аноде и катоде при электролизе растворов солей с нерасходуемым
электродом используют следующие правила.
1. На аноде могут образовываться
следующие продукты: а) при окислении
анионов
![]()
выделяется кислород; б) при
окислении анионов
![]()
выделяются соответственно хлор, бром, иод; в) при окислении анконов органических
кислот происходит процесс:
![]()
2. Если конкурирующими процессами на катоде является восстановление катионов
(металл стоит в электрохимическом ряду напряжений металлов левее водорода) и
ионов водорода, то при этом выделяется водород.
В тех случаях, когда в процессе электролиза используется активный
(расходуемый) анод, то последний будет окисляться в ходе электролиза и
переходить в раствор в виде катионов. Энергия электрического тока при этом
расходуется ка перенос металла с анода на катод. Данный процесс широко
используется при рафинировании (очистка) металлов. Так, на этом принципе
основано, в частности, получение чистой меди из загрязненной. В раствор
медного купороса погружают пластины из очищенной и неочищенной меди.
Пластины соединяют с источником постоянного тока таким образом, чтобы первая
из них (очищенная медь) была отрицательным электродом (катод), а вторая —
положительным (анод). В результате пластина из неочищенной меди растворяется
и ионы меди из раствора осаждаются на катоде. При этом примесь остается в
растворе или оседает на дно ванны. Этот же принцип используется для защиты
металлов от коррозии путем нанесения на защищаемое изделие тонких слоев
хрома или никеля.
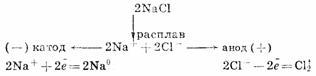
Для получения высокоактивных металлов (натрия, алюминия, магния, кальция и
др.), легко вступающих во взаимодействие с водой, применяют электролиз
расплава солей:

Зависимость количества вещества, образовавшегося под действием электрического
тока, от времени, силы тока и природы электролита может быть установлена на
основании обобщенного закона Фа-радея:
![]()
где m — масса образовавшегося при электролизе i-вещества (г); Э —
эквивалентная масса i-вещества (г/моль); М — молярная масса i-вещества
(г/моль); n — заряд i-иона; I — сила тока (A); t — продолжительность
процесса; F — константа Фарадея, характеризующая количество электричества,
необходимое для выделения 1 эквивалентной массы вещества (F = 96 500 К =
26,8 А•ч).
Опыт и
задача. Получите осадок гидроксида меди
(II). Рассчитайте массы сульфата меди
(II) и гидроксида натрия, необходимые для
получения 0,2 моль осадка.

Билет 9
1. Общая характеристика металлов главных подгрупп I – III групп (I-A – III-A
групп) в связи с их положением в периодической системе химических элементов Д.И. Менделеева и особенности строение их атомов, металлическая химическая связь,химические свойства металлов как восстановителей.
В периодической системе элементов металлы в основном располагаются в главных
подгруппах I—Ill групп, а также в побочных подгруппах.
![]()
В IA группе у атомов элементов на внешнем энергетическом уровне находится 1
электрон в состоянии s1, во IIA группе у атомов на внешнем ЭУ 2
электрона в состоянии s2. Эти элементы относятся к s-элементам. В
IIIA группе у всех элементов на внешнем Энергетическом Уровне 3 электрона в состоянии s2p1. Они относятся к p-элементам.
В I A группу входят щелочные металлы Li, Na, K, Rb, Cs, Fr, активность которых при движении сверху вниз увеличивается вследствие увеличения радиуса атомов, металлические свойства возрастают также, как и у щелочеземельных металлов IIA группы Be, Mg, Ca, Sr, Ba, Ra и металлов IIIA группы Al, Ga, In, Tl.Оксиды типа R2O характерны только для Li, для всех остальных щелочных
металлов характерны пероксиды R2O2, которые являются сильными окислителями.
Все металлы этих групп образуют основные оксиды и гидроксиды, кроме Be и Al,
которые проявляют амфотерные свойства.
Химические свойства. Атомы металлов имеют больший радиус, чем атомы
неметаллов, поэтому легко теряют валентные электроны. Вследствие этого металлы проявляют восстановительные свойства.
![]()
В химических реакциях металлы выступают в роли восстановителей:
1. При взаимодействии с кислородом металлы образуют оксиды, например, магний сгорает с образованием оксида магния:
2Mg + O2 = 2MgO
Наиболее активные металлы (щелочные) при горении на воздухе образуют пероксиды:
2Na + O2 = Na2O2 (пероксид натрия)
2. Активные металлы, например, натрий, реагируют с водой с образованием гидроксидов:
2Na + 2HOH = 2NaOH + H2↑
или оксидов, как магний при нагревании:
Mg + H2O = MgO + H2↑
Металлы, расположенные в электрохимическом ряду напряжений левее водорода (Н), вытесняют водород из кислот (кроме азотной). Так, цинк реагирует с соляной кислотой с образованием хлорида цинка и водорода:
Zn + 2HCl = ZnCl2 + H2↑
Металлы, в том числе правее водорода, за исключением золота и платины, реагируют с азотной кислотой, с образованием различных соединений азота:
Cu + 4HNO3 (конц.) = Cu(NO3)2 + 2H2O + 2NO2↑
Коэффициенты в этих уравнениях легче расставить методом электронного баланса. Проставляем степени окисления:
Cu0 + 4HN+5O3 = Cu+2(NO3)2 + 2H2O + 2N+4O2↑
Записываем элементы с изменившейся степенью окисления:
Cu0 – 2e– → Cu+2 |
2* |
1** |
- восстановитель |
N+5 + 1e– → N+4 |
2 |
- окислитель |
