
- •I. Огляд літератури
- •1. Дріжджі Saccharomyces cerevisiae – універсальний модельний організм.
- •1.1. Дріжджі Saccharomyces cerevisiae як експериментальна система молекулярної біології
- •1.2 Експериментальні підходи у молекулярній біології дріжджів
- •2.1 Структура Ту-елементів
- •2.2 Транспозиція Ту-елементів
- •3. Альтернативні системи мультикопійної інтеграції векторів у Saccharomyces cerevisiae
- •3.1 Альтернативна система мультикопійної інтеграції у Saccharomyces cerevisiae з використанням субтеломерних y’-елементів
- •2. Матеріали і методи досліджень
- •2.1. Матеріали досліджень
- •2.2. Організми
- •2.3. Поживні середовища та умови культивування
- •2.4. Визначення біомаси клітин
- •2.5. Методи досліджень
- •2.5.1. Рестрикційний аналіз днк
- •2.5.2. Дефосфорилювання
- •2.5.3. Елюція фрагментів днк з агарозного гелю
- •2.5.4. Лігування днк-вставки з днк-вектором
- •2.5.5. Електрофорез днк в агарозному гелі
- •2.5.6. Виділення плазмідної днк з клітин e.Coli
- •2.5.7. Електротрансформація клітин е. Сoli
- •2.5.8. Полімеразна ланцюгова реакція (плр)
- •2.5.9. Виділення хромосомної днк з клітин s. Сerevisiae
- •2.5.10. Довготривале зберігання бактерійних та дріжджових трансформантів
- •2.5.11. Трансформація дріжджів s. Сerevisiae Li-Ac методом (хімічна трансформація)
- •2.5.12. Визначення стабільності дріжджових трансформантів
- •2.5.13. Отримання безклітинного екстракту
- •2.5.14. Визначення концентрації білка у безклітинних екстрактах методом Лоурі
- •2.5.15. Визначення активності лужної фосфатази
- •3. Результати
- •3.1 Модифікація гена kanMx4, що забезпечує резистентність до антибіотика генетицину.
- •3.2. Конструювання рекомбінантних штамів s. Cerevisiae з надекспресією інтактної та вкороченої форми гена pho8.
1.2 Експериментальні підходи у молекулярній біології дріжджів
24 квітня 1996 року була зроблена заява, що S. cerevisiae став першим еукаріотичним організмом, чий геном, що складається з 12 млн. пар основ, був повністю секвенований у рамках геномного проекту. [Williams N Genome Projects: Yeast Genome Sequence Ferments New Research // Science. — Т. 272. — (April 26, 1996) (5261) С. 481–0]. У той час це був найскладніший організм, чий геном був секвенований, цей процес зайняв 7 років і залучав більш ніж 100 лабораторій. Наступним видом дріжджів, чий геном був секвенований, був Schizosaccharomyces pombe, завершений у 2002 році. Це був шостий геном еукаріотів розміром 13,2 млн. пар основ. На даний час повна послідовність геному S. cerevisiae складається з таких елементів:
6000 відкриті рамки зчитування, більшість з яких кодують специфічні білки. Встановлено, що на кожну другу тисячу нуклеотидів в геномі припадає білок-кодуючі гени [Dujon, 1996].
біля 120 генів рибосомальної РНК у великому тандемному масиві на XII хромосомі;
40 генів, що кодують малі ядерні РНК (мяРНК);
274 гени тРНК, розкидані по всьому геному;
біля 50 копій дріжджових транспозонів (Ту-елементів);
послідовності позахромосомних елементів: 6 тис. пар основ плазмідної ДНК, яку в деяких штамах складають кіллерні плазміди;
мітохондріальний геном (75 тис. пар основ)
Геном S. cerevisiae складається з 16-ти хромосом, розмір яких коливається в межах від 250-ти до 2500 тис. пар основ [Carle & Olson, 1985]. Таким чином, підбираючі відповідні умови, можна розділити всі 16 хромосом за допомогою гель-електрофорезу у пульсуючому полі. Це дає визначення поняттю „електрофоретичні каріотипи” штамів шляхом розділення їх хромосом ща розміром [Carle & Olson, 1985]. Отримані гелі можуть бути використані для проведення Саузерн-блот аналізу, що супроводжується гібридизацією, або для ізоляції хромосомної ДНК в чистому вигляді. Перша генетична карта S. cerevisiae була опублікована Ліндегреном у 1949 році [Lindegren, 19949] і з того часу зазнала багатьох переглядів та уточнень. Для картування генів дріжджів були розроблені як мейотичні, так і мітотичні підходи. Життєвий цикл S. cerevisiae поділяється на гапло- і диплофазу. Обидва плоїди можуть існувати у стабільних умовах.
Гаплоїдні аскоміцетні дріжджові клітини мають два типи спаровування: а і α. Термін «стать» не використовується, оскільки клітини морфологічно ідентичні і розрізняються тільки одним генетичним локусом MAT (від англ. mating — спаровування).
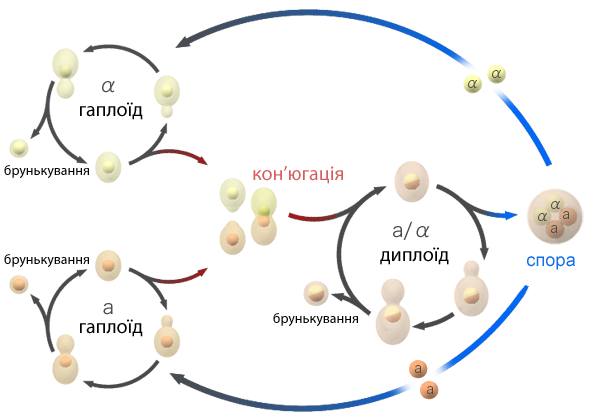
Рис 1. Життєвий цикл аскоміцетних гапло-діплоїдних дріжджів.
Клітини різних типів можуть зливатися і утворювати диплоїд a/α, який після мейозу дає 4 гаплоїдних аскоспори: дві а і дві α. Вегетативне розмноження аскоміцетних дріжджів можливе у різних видів або тільки на гаплоїдній стадії, або тільки на диплоїдній, або на обох (гапло-диплоїдні дріжджі). [Balasubramanian M., Bi E., Glotzer M. Comparative analysis of cytokinesis in budding yeast, fission yeast and animal cells // Curr Biol.. — Т. 14. — (2004) (18) С. R806-R818. PMID 15380095.]
За умов короткого часу клітинної генерації за дві доби можна виростити колонії, містять мільйони клітин. До того ж дріжджі можна підтримувати в гаплоїдній і диплоїдній формах, що різко спрощує їх генетичний аналіз. Як і бактерії, гаплоїдні клітини дріжджів можна використовувати для отримання ауксотрофних мутантів зі специфічними вимогами до складу поживного середовища. Рецесивні летальні мутації можна підтримувати в культурі гаплоїдних клітин у вигляді умовних летальних алелей (наприклад, термочутливих мутантів) або в культурі гетерозиготних диплоїдних клітин (що містять і аллель дикого типу і мутацію).
На даний час є доступною велика кількість протоколів для проведення генетичних маніпуляцій з клітинами дріжджів [Guthrie & Fink,1991;Johnston, 1994]. Встановлено, що час генерації дріжджів складає 90 хвилин і при цьому відбувається інтенсивне і швидке накопичення біомаси. Досить простими є процедури по виділенню з клітин таких високомолекулярних сполук, як ДНК, рДНК, мРНК і тРНК. Також є можливим ізоляція інтактного ядра або інших клітинних органел, таких як мітохондрії. За останні роки булла досягнена висока ефективність генетичної трансформації дріжджових клітин, наприклад застосування LiAc методики [Ito et al., 1983] або методом електропорації. Також було сконструйовано велику кількість векторів для введення і підтримання рекомбінантної ДНК в клітинах дріжджів [e.g. Guthrie &Fink,1991; Johnston, 1994].
Крім того, на даний час сконструйовані штами дріжджів, які несуть ауксотрофні маркери, гении стійкості до антибіотиків, а також ті, що містять в собі різноманітні індуковані мутації. Відбувається активне підтримання і накопичення колекцій культур дріжджів, наприклад у Фонді Генетики Дріжджів (англ. Yeast Genetic Stock Center - YGSC) або в Американській колекції типових культур (англ. American Type Culture Collection - ATCC). Штами мутантів з визначеними генними делеціями разом з клонами, що несуть відповідні генні касети походять з проектів EUROFAN та TRANSATLANTIC. Протягом останніх років, у рамках виконання проекту по секвенуванню геному дріжджів, були створені впорядковані космідні бібліотеки [e.g. Thierry et al., 1993; Riles et al., 1993; Stucka & Feldmann, 1994].
Прості генетичні порушення та однокрокові генні перебудови є унікальними у S.cerevisiae і відкривають широкі можливості для дослідження. При з’єднанні з геном зеленого флюорисцентного білка (англ. green fluorescent protein – GFP - репортер експресії генів та внутріклітинної локалізації білків) гени дріжджів функціонально експресуються і локалізацію їх продуктів можна визначити методом флюорисцентної мікроскопії [Niedenthal et al., 1996].
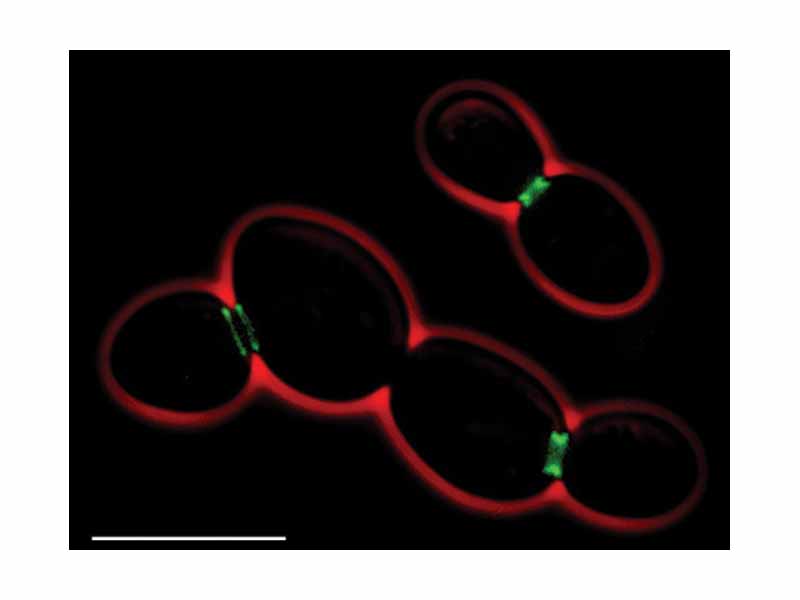
Рис 2. Фотографія з флюорисцентного мікроскопа: септи у S.cerevisiae . зеленим кольором септи, що містять GFP - зелений флюорисцентний білок
Дріжджам також відведена неоцінима роль у клонуванні і підтриманні величезних сегментів ДНК у геномі у штучних дріжджових хромосомах (англ. yeast artificial chromosomes – YACs), використання яких є надзвичайно активним у різноманітних проектах по секвенуванню а також вивченню білок-білкових взаємодій за допомогою двогібридного підходу [Fields & Song, 1989].
Наявність високоефективної системи гомологічної рекомбінації у дріжджів дозволяє довільно змінювати будь-яку обрану хромосомну послідовність ДНК. До того ж, можна здійснювати маніпуляції з ділянками хромосом у складі рекомбінантних плазмід, які стабільно підтримуються в діляться клітинах дріжджів, завдяки включенню до них коротких послідовностей центромери і точки початку реплікації ДНК. У дріжджах стабільно підтримуються навіть лінійні плазміди (мініхромосоми), що містять теломерні повтори по кінцях.
2. Ty-елементи дріжджів S. cerevisiae
