
- •I. Огляд літератури
- •1. Дріжджі Saccharomyces cerevisiae – універсальний модельний організм.
- •1.1. Дріжджі Saccharomyces cerevisiae як експериментальна система молекулярної біології
- •1.2 Експериментальні підходи у молекулярній біології дріжджів
- •2.1 Структура Ту-елементів
- •2.2 Транспозиція Ту-елементів
- •3. Альтернативні системи мультикопійної інтеграції векторів у Saccharomyces cerevisiae
- •3.1 Альтернативна система мультикопійної інтеграції у Saccharomyces cerevisiae з використанням субтеломерних y’-елементів
- •2. Матеріали і методи досліджень
- •2.1. Матеріали досліджень
- •2.2. Організми
- •2.3. Поживні середовища та умови культивування
- •2.4. Визначення біомаси клітин
- •2.5. Методи досліджень
- •2.5.1. Рестрикційний аналіз днк
- •2.5.2. Дефосфорилювання
- •2.5.3. Елюція фрагментів днк з агарозного гелю
- •2.5.4. Лігування днк-вставки з днк-вектором
- •2.5.5. Електрофорез днк в агарозному гелі
- •2.5.6. Виділення плазмідної днк з клітин e.Coli
- •2.5.7. Електротрансформація клітин е. Сoli
- •2.5.8. Полімеразна ланцюгова реакція (плр)
- •2.5.9. Виділення хромосомної днк з клітин s. Сerevisiae
- •2.5.10. Довготривале зберігання бактерійних та дріжджових трансформантів
- •2.5.11. Трансформація дріжджів s. Сerevisiae Li-Ac методом (хімічна трансформація)
- •2.5.12. Визначення стабільності дріжджових трансформантів
- •2.5.13. Отримання безклітинного екстракту
- •2.5.14. Визначення концентрації білка у безклітинних екстрактах методом Лоурі
- •2.5.15. Визначення активності лужної фосфатази
- •3. Результати
- •3.1 Модифікація гена kanMx4, що забезпечує резистентність до антибіотика генетицину.
- •3.2. Конструювання рекомбінантних штамів s. Cerevisiae з надекспресією інтактної та вкороченої форми гена pho8.
3.2. Конструювання рекомбінантних штамів s. Cerevisiae з надекспресією інтактної та вкороченої форми гена pho8.
Геномну ДНК S. cerevisiae BY4742 використовують як матрицю для ампліфікації δ-послідовностей за допомогою ПЛР: частину послідовності YJRWdelta12 (Saccharomyces Genome Database// www.yeastgenome.org/) розміром 154 пн ампліфікують з допомогою праймерів SM16/SM17 (Таблиця 1), іншу частину розміром 180 пн ампліфікують з допомогою праймерів SM18/SM19. В подальшому обидва фрагменти об’єднують з допомогою ПЛР з використанням праймерів SM16/SM19, обробляють рестриктазами EcoRI та HindIII і клонують у плазмідний вектор pUC57. Сконструйовану плазміду позначено pUC57-delta1_2. Фрагмент ДНК розміром 807 пн, що відповідає промотору гена ADH1 (кодує алкогольдегідрогеназу), ампліфікують з геномної ДНК штаму S. cerevisiae BY4742 за допомогою праймерів Ко419 і Ко420. Фрагмент ДНК розміром 269 пн, що відповідає термінатору гена CYC1 (що кодує цитохром С), ампліфікують з геномної ДНК штаму S. cerevisiae BY4742 за допомогою праймерів Ко453 та Ко454. Потім ці два фрагменти об’єднують з допомогою ПЛР з використанням праймерів Ко419 і Ко454. Отриманий фрагмент ДНК обробляють ендонуклеазами рестрикції SalI i XmaI і клонують по відповідних сайтах у плазміду pUC57-delta1_2. Отриману плазміду позначено pUC57-delta1_2-ADHpr-CYCt. Фрагмент ДНК розміром 1701 пн, що відповідає ВРЗ гена PHO8 S. cerevisiae, ампліфікують з використанням праймерів Ko508 і Ko509 і геномної ДНК BY4742 як матриці. Після очистки цей фрагмент обробляють ендонуклеазами рестрикції BamHI i NotI і клонують в плазміду pUC57-delta1_2-ADHpr-CYCt. Отриманий вектор названо pUC57-delta1_2-ADHpr-PHO8-CYCt. Модифікований ген kanMX4 у складі SacI/SmaI-фрагмента, обробленого Т4-ДНК-полімеразою для утворення «тупих» кінців клонують у Xba-лінеаризований та оброблений Т4-ДНК-полімеразою вектор pUC57-delta1_2-ADHpr-PHO8-CYCt. Отриману плазміду позначено pUC57-delta1_2-ADHpr-PHO8-CYCt-kanMXmut (Рис. 2). Також для порівняння конструюють вектор, що містить нативний ген kanMX4, його позначено pUC57-delta1_2-ADHpr-PHO8-CYCt-kanMX.
Таблиця 1
Перелік праймерів, використаних у роботі
Назва праймера |
Послідовність нуклеотидів |
SM16 |
5’-CCGGAATTCGACGGGCAGTCTGTTGGAATAGAAATCAACTATC-3 |
SM17 |
5’- CATCATTTTATATGTTTATATTCATCTAGACCCGGGGTCGAC TTGATCCTATTACATTATCAATCC - 3’ |
SM18 |
5’- GGATTGATAATGTAATAGGATCAAGTCGACCCCGGGTCTAGA TGAATATAAACATATAAAATGATG - 3’ |
SM19 |
5’-CCCAAGCTTGACGGGCAGTCTGAGAAATATGTGAATGTTGAG-3’ |
SM28 |
5’-CGCGGATCCATGTCTGCATCACACAAGAAGAAGAATGTC-3’ |
SM29 |
5’-TTTGCGGCCGCTCAATCTGATGTGTGTTTGGTGTCCCTAATC-3’ |
Ko419 |
5’- CGCGTCGACTTAATTAAAGTCCAATGCTAG - 3’ |
Ko420 |
5’- GATATCGACAAAGGAAAAGGGGCGGCCGCGGATCCCTCGAGT GTATATGAGATAGTTGATTG - 3’ |
Ko446 |
5’- CCGGGATCCTCTAGAGTGATGACGGTGAAAACCTCTG - 3’ |
Ko447 |
5’- CCGGGATCCTCTAGACTTACGCATCTGTGCGGTATTTC - 3’ |
Ko453 |
5’- CAATCAACTATCTCATATACACTCGAGGGATCCGCGGCC GCCCCTTTTCCTTTGTCGATATC - 3’ |
Ko454 |
5’- CCCCCCGGGGCAAATTAAAGCCTTCGAGC - 3’ |
Ko508 |
5’- CGCGGATCCATGATGACTCACACATTACCAAGC - 3’ |
Ko509 |
5’- TTTGCGGCCGCTCAGTTGGTCAACTCATGGTAGTATTC - 3’ |
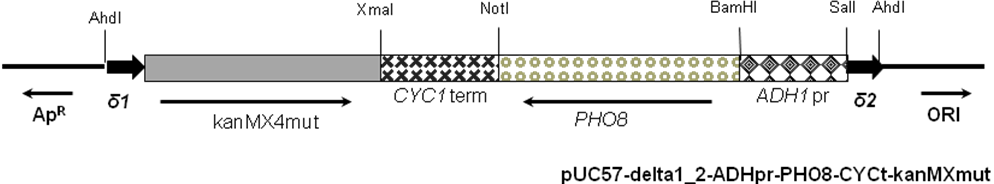
Рис. 2. Лінійна схема плазміди pUC57-delta1_2-ADHpr-PHO8-CYCt-kanMXmut.
Вектори pUC57-delta1_2-ADHpr-PHO8-CYCt-kanMXmut та pUC57-delta1_2-ADHpr-PHO8-CYCt-kanMX обробляють ендонуклеазою рестрикції AhdI (при цьому видаляється частина вектора, що відповідає плазміді pUC57) і використовують для трансформації штаму S. cerevisiae BY4742. Селекцію генетицин-резистентних трансформантів проводять на середовищі YPD з додаванням 200 мг/л G418. Наявність в геномі трансформантів експресійної касети ADHpr-PHO8 перевіряють за допомогою ПЛР з використанням відповідної пари праймерів (Ко419 та Ко509) (див. табл. 1). Визначення копійності гена PHO8 в геномі рекомбінантних штамів здійснюється за допомогою дот-блот гібридизації (Рис. 3). Вектор pUC57-delta1_2-ADHpr-PHO8-CYCt-kanMX забезпечує високу частоту трансформації S. cerevisiae, ~ 103 трансформантів/мкг ДНК, проте включається в геном найчастіше в 1-2 копіях, а вектор pUC57-delta1_2-ADHpr-PHO8-CYCt-kanMXmut, що забезпечує значно нижчу частоту трансформації, ~ 101 трансформантів/мкг ДНК, дозволяє отримати трансформанти, що містять від 3 до 7-9 додаткових копій гена PHO8. Визначення питомої активності лужної фосфатази у рекомбінантних штамів (Рис. 4) показало, що штами, які містять вектор pUC57-delta1_2-ADHpr-PHO8-CYCt-kanMXmut мають від 7 до 35 разів вищу відповідну ферментативну активність у порівнянні з реципієнтним штамом BY4742 та у 2-10 разів вищу у порівнянні зі штамами, що містять вектор pUC57-delta1_2-ADHpr-PHO8-CYCt-kanMX. Значення активності лужної фосфатази в отриманих рекомбінантних штамів S. cerevisiae добре корелюють з кількістю додаткових копій гена PHO8 у їх геномі. Отже, вектор pUC57-delta1_2-ADHpr-PHO8-CYCt-kanMXmut дійсно забезпечує мультикопійну інтеграцію гена PHO8 у геном S. cerevisiae.

Рис. 3. Дот-блот гібридизація, що проводилася для визначення кількості копій гена PHO8 у геномі рекомбінантних штамів, де BY4742 – штам дикого типу, що має 1 копію гена PHO8 в геномній ДНК; BY+PHO8 mut – рекомбінантні штами, що містять вектор pUC57-delta1_2-ADHpr-PHO8-CYCt-kanMXmut з модифікованим геном kanMX4; BY+PHO8 delta – рекомбінантні штами, що містять вектор з немодифікованим геном kanMX4.
Проте, незважаючи на досить значне підвищення активності лужної фосфатази в клітинах рекомбінантних штамів з надекспресією гена PHO8, вони не виявляли суттєвого зниження рівня накопичення біомаси (Рис. 5) В зв’язку з цим було вирішено здійснити також надекспресію вкороченої форми гена PHO8, в якій еліміновані нуклеотидні послідовності, що кодують сигнал з 60 амінокислот, який відповідає за доставку синтезованого білка у вакуолярний компартмент.
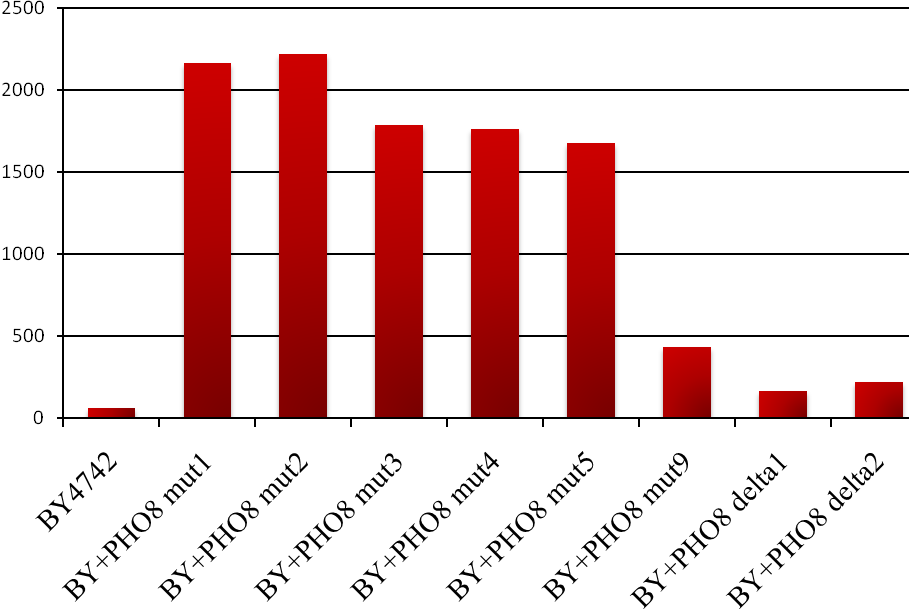
Рис. 4. Питома активність лужної фосфатази (мкмоль продукта/мг білка*хв.) в безклітинних екстрактах рекомбінантних штамів S. cerevisiae в порівнянні зі штамом дикого типу. Позначення штамів такі ж, як на Рис.3.
Проте механізм формування активної форми лужної фосфатази доволі складний і включає ряд посттрансляційних модифікацій. По-перше, було показано що лужна фосфатаза синтезується з іРНК як неактивний попередник, що містить C-кінцевий пропептид, який потім відщеплюється за рахунок дії вакуолярної протеази (Klionsky D. and Emr S.D., 1989). По-друге, під час доставки у вакуоль білок-попередник глікозилюється в ендоплазматичному ретикулумі. І, нарешті, також було показано, що одним з кофакторів лужної фосфатази є метал цинк, який зв’язується з ферментом власне у вакуолі (Qiao W. et al. 1985). Всі ці фактори можуть завадити отриманню ферментативно активної цитоплазматичної форми лужної фосфатази. Для того щоб елімінувати інгібуючий вплив С-кінцевого пептида, з вкороченої форми гена PHO8 було також виключено нуклеотидні послідовності, що кодують 22 термінальні амінокислоти.
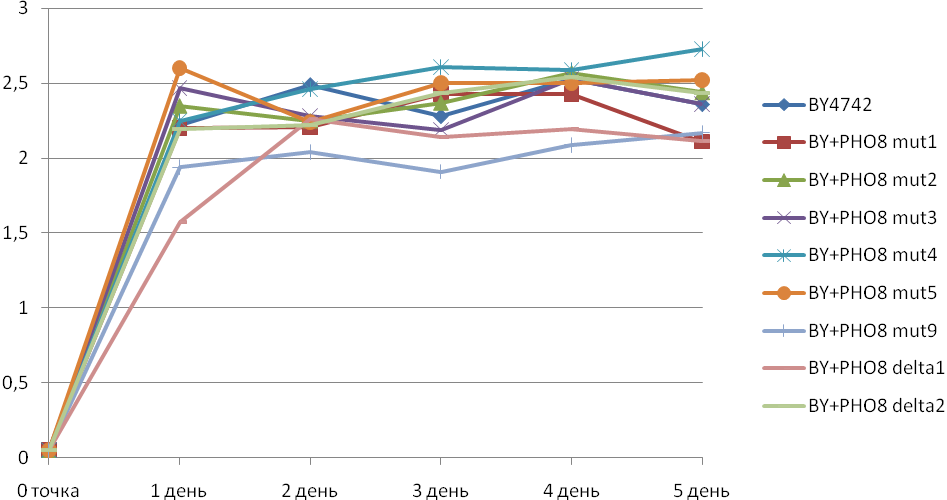
Рис. 5. Зміна оптичної густини суспензій клітин під час культивування WT і рекомбінантних штамів S. cerevisiae на середовищі YNB. Позначення штамів такі ж, як на Рис.3.
Для надекспресії вкороченої форми гена PHO8 фрагмент ДНК розміром 1452 пн, що відповідає ВРЗ гена PHO8 S. cerevisiae без початкових 180 і кінцевих 69 нуклеотидів, ампліфікують з використанням праймерів SM28 і SM29 і геномної ДНК BY4742 як матриці. Після очистки цей фрагмент обробляють ендонуклеазами рестрикції BamHI i NotI і клонують в плазміду pUC57-delta1_2-ADHpr-PHO8-CYCt-kanMXmut замість інтактної форми гена PHO8. Отриманий вектор названо pUC57-delta1_2-ADHpr-PHO8trunc-CYCt-kanMXmut. В подальшому його обробляють ендонуклеазою рестрикції AhdI і використовують для трансформації штаму S. cerevisiae BY4742. Селекцію генетицин-резистентних трансформантів проводять на середовищі YPD з додаванням 200 мг/л G418. Наявність в геномі трансформантів експресійної касети ADHpr-PHO8trunc перевіряють за допомогою ПЛР з використанням відповідної пари праймерів (Ко419 та SM29) (див. табл. 1).
Визначення питомої активності лужної фосфатази у отриманих рекомбінантних штамів (Рис. 6) показало, що штами, які містять вектор pUC57-delta1_2-ADHpr-PHO8trunc-CYCt-kanMXmut мають приблизно в 20-25 разів вищу відповідну ферментативну активність у порівнянні з реципієнтним штамом BY4742 та майже таку саму активність у порівнянні зі штамами, що містять вектор pUC57-delta1_2-ADHpr-PHO8-CYCt-kanMXmut з інтактною формою гена PHO8, однак, на відміну від останніх, рекомбінантні штами що містять вкорочену форму гена PHO8 виявляють значну затримку в накопиченні біомаси на перший день культивації (Рис. 7).
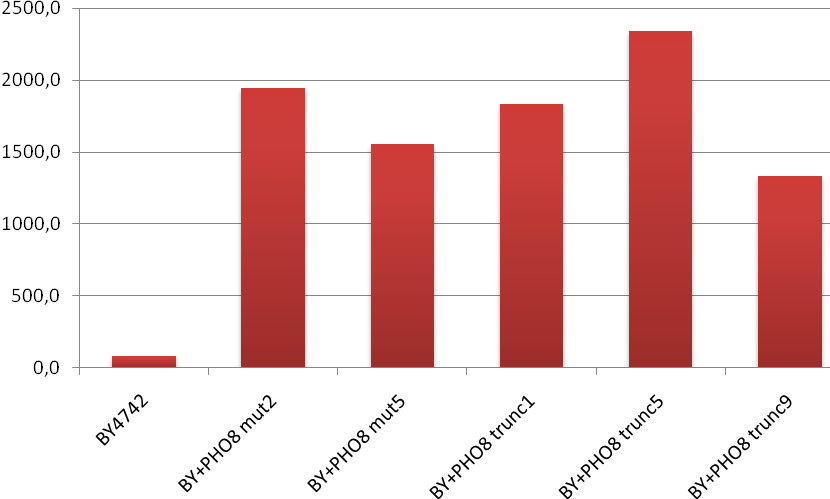
Рис. 6. Питома активність лужної фосфатази (мкмоль продукта/мг білка*хв.) в безклітинних екстрактах рекомбінантних штамів S. cerevisiae в порівнянні зі штамом дикого типу. BY4742 – штам дикого типу; BY+PHO8 mut – рекомбінантні штами, що містять вектор pUC57-delta1_2-ADHpr-PHO8-CYCt-kanMXmut з інтактною формою гена PHO8; BY+PHO8 trunc – рекомбінантні штами, що містять вектор з вкороченою формою гена PHO8.
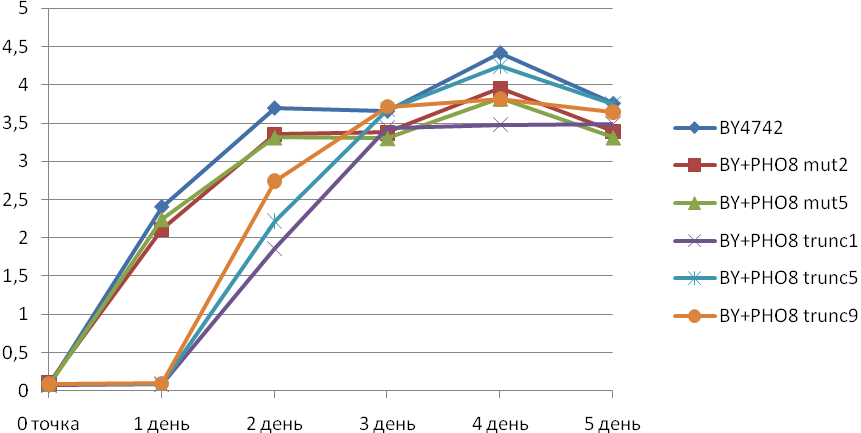
Рис. 7. Зміна оптичної густини суспензій клітин під час культивування WT і рекомбінантних штамів S. cerevisiae на середовищі YNB. Позначення штамів такі ж, як на Рис. 6.
.
