
16.
ФЕРМЕ́НТЫ (от лат. «fermentum» — брожение, закваска), энзимы, специфические белки, увеличивающие скорость протекания химических реакций в клетках всех живых организмов. По химической природе — белки, обладающие оптимальной активностью при определенном рН, наличии необходимых коферментов и кофакторов и отсутствии ингибиторов. Ферменты называют также биокатализаторами по аналогии с катализаторами в химии. Каждый вид ферментов катализирует превращение определенных веществ (субстратов), иногда лишь единственного вещества в единственном направлении. Поэтому многочисленные биохимические реакции в клетках осуществляет огромное число различных ферментов. Подразделяются на 6 классов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразыи лигазы. Многие ферменты выделены из живых клеток и получены в кристаллическом виде (впервые в 1926).
Роль ферментов в организме. Ферменты участвуют в осуществлении всех процессов обмена веществ, в реализации генетической информации. Переваривание и усвоение пищевых веществ, синтез и распад белков, нуклеиновых кислот, жиров, углеводов и других соединений в клетках и тканях всех организмов — все эти процессы невозможны без участия ферментов. Любое проявление функций живого организма — дыхание, мышечное сокращение, нервно-психическая деятельность, размножение и др. — обеспечивается действием ферментов. Индивидуальные особенности клеток, выполняющих определенные функции, в значителной мере определяются уникальным набором ферментов, производство которых генетически запрограммировано. Отсутствие даже одного фермента или какой-нибудь его дефект могут привести к серьезным отрицательным последствиям для организма.
Использование ферментов человеком. Так как ферменты сохраняют свои свойства и вне организма, их успешно используют в различных отраслях промышленности. Например, протеолитический фермент папайи (из сока папайи) — в пивоварении, для мягчения мяса; пепсин — при производстве «готовых» каш и как лекарственный препарат; трипсин — при производстве продуктов для детского питания; реннин (сычужный фермент из желудка теленка) — в сыроварении. Каталаза широко применяется в пищевой и резиновой промышленности, а расщепляющие полисахариды целлюлазы и пектидазы — для осветления фруктовых соков. Ферменты необходимы при установлении структуры белков, нуклеиновых кислот и полисахаридов, в генетической инженерии и т. д. С помощью ферментов получают лекарственные препараты и сложные химические соединения.
ХИМИЧЕСКАЯ ПРИРОДА. В настоящее время получены неопровержимые экспериментальные доказательства белковой природы ферментов.
О белковой природе ферментов свидетельствует факт инактивирования (потеря активности) ферментов брожения при кипячении, установленный еще Л. Пастером. При кипячении наступает необратимая денатурация белка-фермента. Фермент при этом теряет присущее ему свойство катализировать химическую реакцию. Точно так же белки при кипячении денатурируются и теряют свои биологические свойства (антигенные, гормональные, каталитические). Под влиянием различных физических и химических факторов (воздействие УФ- и рентгеновского излучения, ультразвука, осаждение минеральными кислотами, щелочами, алкалоидными реактивами, солями тяжелых металлов и др.) происходит денатурация ферментов, так же как и белков. [5]
Ферменты при гидролизе, как и белки, распадаются на аминокислоты, что, бесспорно, служит веским доказательством белковой природы ферментов.
Вескими доказательствами белковой природы фермента являются его получение в чистом виде и выделение в форме кристаллов белка. К настоящему времени получено более 1000 кристаллических ферментов. Структура многих из них изучена детально при помощи современных методов химии белков и молекулярной физики (методами рентгеноструктурного анализа, ядерного магнитного резонанса (ЯМР), электронного парамагнитного резонанса (ЭПР) и др.).
Ферменты, как и все белки, обладают рядом свойств, характерных для высокомолекулярных соединений: амфотерностью (могут существовать в растворе в виде анионов, катионов и амфионов); электрофоретической подвижностью благодаря наличию в них положительных и отрицательных зарядов, а в изоэлектрической точке не обнаруживают подвижности в электрическом поле. Ферменты неспособны к диализу через полупроницаемые мембраны. При помощи диализа их растворы можно освободить от низкомолекулярных примесей. Как и белки, они легко осаждаются из водных растворов при низких температурах методами высаливания или осторожным добавлением ацетона, этанола и других веществ и при этом не теряют своих каталитических свойств.
Подобно белкам, ферменты имеют большую молекулярную массу – от десятков тысяч до нескольких миллионов (табл. 1).
Ферменты оказывают высоко специфическое действие, что также доказывает их белковую природу, поскольку белки в иммунологическом отношении отличаются крайне высокой специфичностью. Наконец, прямым доказательством белковой природы ферментов является лабораторный синтез первого фермента – рибонуклеазы, осуществленный в 1969 году в лаборатории Б. Меррифилда в Нью-Йорке.
17.
структурно-функциональная организация ферментов.
В составе ферментов выделяют области, выполняющие различную функцию:
Активный центр – комбинация аминокислотных остатков(обычно 12-16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ. Аминокислотные рдикалы в активном центре могут находиться в любом сочетании, при этом рядом располагаются аминокислоты, значительно удаленные друг от друга в линейной цепи.
У ферментов, имеющих в своем составе несколько мономеров, может быть несколько активных центров по числу субъедениц. Также 2 и более субъединицы могут формировать один активный центр.
У сложных ферментов в активном центре обязательно расположены функциональные группы кофактора.
В свою очередь в активном центре выделяют 2 участка: 1)якорный(контактный, связывающий) – отвечает за связывание и ориентацию субстрата в активном центре, 2)каталитический – непосредственно отвечает за осуществление реакции.
Аллостерический центр – центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы(называемой активатором или ингибитором.ю а также эффектором, модулятором.ю регулятором) вызывает изменение конфигурации белка-фермента и, как следствие, скорости ферментативной реакции. В качестве такого регулятора может выступать продукт данной или одной из последующих реакций, субстрат реакции или иное вещество.
Аллостерические ферменты являются полимерными белками, активный и регуляторный центры находятся в разных субъединицах.
В природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислоты. Такимиферментами (простые белки) являются гидролитические ферменты, в частности пепсин, трипсин, папаин, уреаза, лизоцим, рибонуклеаза,фосфатаза и др. Большинство природных ферментов относится к классу сложных белков, содержащих, помимо полипептидных цепей, какой-либо небелковый компонент (кофактор), присутствие которого является абсолютно необходимым для каталитической активности. Кофакторы могут иметь различную химическую природу и различаться по прочности связи с полипептидной цепью. Если константа диссоциации сложного ферментанастолько мала, что в растворе все полипептидные цепи оказываются связанными со своими кофакторами и не разделяются при выделении и очистке, то такой фермент получает название холофермента (холоэнзим), а кофактор – простетической группы, рассматривающейся как интегральная часть молекулы фермента. Полипептидную часть фермента принято называть апоферментом.
Активный центр ферментов
При изучении механизма химической реакции, катализируемой ферментами, исследователя всегда интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции, но и природа тех функциональных групп в молекуле фермента, которые обеспечивают специфичность действия фермента на данный субстрат (субстраты) и высокую каталитическую активность. Речь идет, следовательно, о точном знании геометрии и третичной структуры фермента, а также химической природы того участка (участков) молекулы фермента, который обеспечивает высокую скорость каталитической реакции. Участвующие в ферментативных реакциях молекулы субстратов часто имеют небольшие размеры по сравнению с молекулами ферментов, поэтому было высказано предположение, что при образовании фермент-субстратных комплексов в непосредственный контакт с молекулой субстрата, очевидно, вступает ограниченная часть аминокислот пептидной цепи. Отсюда возникло представление об активном центре фермента. Под активным центром подразумевают уникальную комбинацию аминокислотных остатков в молекуле фермента, обеспечивающую непосредственное связывание ее с молекулой субстрата и прямое участие в акте катализа (рис. 4.2). Установлено, что у сложных ферментов в состав активного центра входят также просте-тические группы.
В активном центре условно различают так называемый каталитический центр, непосредственно вступающий в химическое взаимодействие с субстратом, и связывающий центр, или контактную («якорную») площадку, которая обеспечивает специфическое сродство к субстрату и формирование его комплекса с ферментом. В свою очередь молекула субстрата также содержит функционально различные участки: например, субстраты эстераз или протеиназ – одну специфическую связь (или группу атомов), подвергающуюся атаке со стороны фермента, и один или несколько участков, избирательно связываемых ферментом.
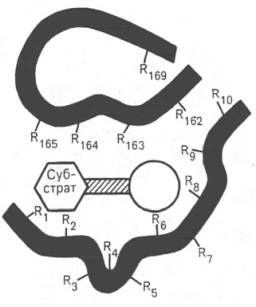
Рис. 4.2. Активный центр фермента (схема) (по Малеру и Кордесу).
Темные полосы - участки полипептидной цепи фермента; R - аминокислотные остатки и их порядковые номера (с N-конца).
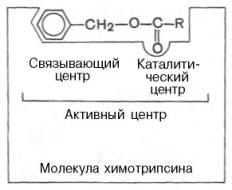
Получены экспериментальные доказательства наличия в активном центре химотрипсина двух остатков гистидина и остатка серина, схематически представленных в трехмерной структурной модели предшественника этого фермента (рис. 4.3). Выявление химической природы и вероятной топографии групп активного центра – проблема первостепенной важности. Она сводится к определению природы аминокислот, их последовательности и взаиморасположения в активном центре. Для идентификации так называемых существенных аминокислотных остатков используют специфические ингибиторы ферментов (часто это субстратподобные вещества или аналоги коферментов), методы «мягкого» (ограниченного) гидролиза в сочетании с химической модификацией, включающей избирательное окисление, связывание, замещение остатков аминокислот и др. При помощи методов ингибиторного анализа были предприняты попытки установить закономерности состава и структуры активных центров у ферментов, относящихся к разным группам. В частности, при использовании диизопропилфторфосфата (ДФФ), принадлежащего к так называемым нервным ядам, наблюдается полное выключение активного центра холинэстеразы – фермента, катализирующего гидролиз ацетилхолина на холин и уксусную кислоту. Оказалось, что этот ингибитор имеет близкое структурное сходство с ацетилхолином и подобно ему взаимодействует с ОН-группой остатка серина в активном центре. Вызывая фосфори-лирование серина в активном центре ряда других ферментов, ДФФ также инактивирует их действие:
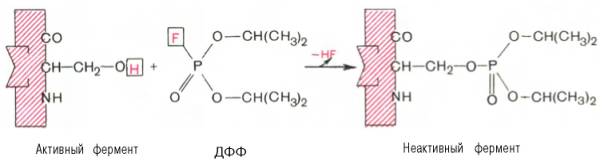
Показано, что ДФФ избирательно фосфорилирует в каждом чувствительном к нему ферменте только один остаток серина, наделенный функциональной активностью. Учитывая этот механизм действия ДФФ, сделаны попытки определения природы аминокислот в окружении «каталитического» остатка серина у ряда ферментов (табл. 4.2).
Из данных табл. 4.2 видно, что ферменты, сходные по типу действия, хотя и различаются специфичностью, могут иметь почти одинаковую последовательность аминокислотных остатков в тех участках, которые примыкают к остатку серина, несущему функционально активную гидро-ксильную группу. Существенное значение ОН-группы серина для акта катализа было доказано, кроме того, химическим ее блокированием или удалением, когда эстеразы полностью лишались ферментативной активности.
Предполагают, что формирование активного центра фермента начинается уже на ранних этапах синтеза белка-фермента (см. главу 14) на рибосоме, когда линейная одномерная структура пептидной цепи превращается в трехмерное тело строго определенной конфигурации. Образовавшийся белок приобретает информацию совершенно нового типа, а именно функциональную (в частности, каталитическую). Любые воздействия, приводящие к денатурации, т.е. нарушению третичной структуры, приводят к искажению или разрушению структуры активного центра и соответственно потере ферментом каталитических свойств. Если при подходящих внешних условиях удается восстановить нативную трехмерную структуру белка-фермента (ренатурировать его), то восстанавливается и его каталитическая активность. Это было показано впервые на примере рибо-нуклеазы поджелудочной железы
Помимо активного центра, в молекуле фермента может присутствовать также аллостерический центр (или центры) (от греч. allos – другой, иной и steros – пространственный, структурный), представляющий собой участок молекулы фермента, с которым связываются определенные, обычно низкомолекулярные, вещества (эффекторы, или модификаторы), молекулы которых отличаются по структуре от субстратов. Присоединение эффектора к аллостерическому центру изменяет третичную и часто также четвертичную структуру молекулы фермента и соответственно конфигурацию активного центра, вызывая снижение или повышение энзимати-ческой активности. Ферменты, активность каталитического центра которых подвергается изменению под влиянием аллостерических эффекторов, связывающихся с аллостерическим центром, получили название аллосте-рических ферментов.
Отличительной особенностью ряда аллостерических ферментов является наличие в молекуле олигомерного фермента нескольких активных центров и нескольких аллостерических регуляторных центров, пространственно удаленных друг от друга. В аллостерическом ферменте каждый из двух симметрично построенных протомеров содержит один активный центр, связывающий субстрат S, и один аллостерический центр, связывающий эффектор М2, т.е. 2 центра в одной молекуле фермента (рис. 4.4). Получены доказательства, что для субстрата аллостерические ферменты, помимо активного центра, содержат и так называемые эффекторные центры; при связывании с эффекторным центром субстрат не подвергается каталитическому превращению, однако он влияет на каталитическую эффективность активного центра. Подобные взаимодействия между центрами, связывающими лиганды одного типа, принято называть гомотропными взаимодействиями, а взаимодействия между центрами, связывающими лиганды разных типов, – гетеротропными взаимодействиями.
Таким образом, приведенные сведения о химической природе активного центра и аллостерических участках свидетельствуют о том, что в энзима-тическом катализе, как и в реакции связывания субстрата, участвует не ограниченная и небольшая часть фермента, как предполагалось ранее, а значительно большая часть молекулы белка-фермента. Этими обстоятельствами, вероятнее всего, можно объяснить большие размеры и объемность трехмерной структуры молекулы фермента; эти же обстоятельства следует учитывать в программах создания искусственных низкомолекулярных аналогов ферментов (синзимов), обладающих свойствами на-тивных ферментов (см. ранее).
18.
Механизм действия ферментов
Различают три стадии в механизме ферментативного катализа:
образование фермент-субстратного комплекса;
образование комплекса «фермент-продукт реакции»;
отщепление продуктов реакции от фермента.
Первая стадия фермент отличается от белка наличием АЦ — участка, с помощью которого фермент соединяется с субстратом и ускоряет реакцию. Долгое время считали, что между ферментом и субстратом имеется точное соответствие («ключ к замку»). Однако сейчас принято считать, что АЦ фермента приспосабливается к субстрату в ходе реакции (теория вынужденного соответствия). В АЦ имеются якорные участки, за счет которых субстрат закрепляется. Каталитический участок АЦ ответственен за тип ускоряемой реакции
Вторая стадия – функционально-активные группы АЦ фермента действуют на субстрат, дестабилизируя связи в нем, вызывая изменение конфигурации субстрата, поляризацию его молекулы, растяжение связей и т.д. Это приводит к химическому преобразованию субстрата (т.е. к протеканию реакции) и образованию продуктов реакции, которые некоторое время находятся в связи с ферментом
Третья стадия – от нее зависит скорость реакции. Происходит отделение фермента от продуктов реакции
лишь ограниченные фрагменты аминокислотной последовательности полипептидной цепи — «активный центр» — уникальная комбинация остатков аминокислот в молекуле фермента, обеспечивающая непосредственное взаимодействие с молекулой субстрата и прямое участие в акте катализ (+ про активный центр из 17 вопр)
Различают два главных вида специфичности ферментов: субстратную специфичность и специфичность действия.
Субстратная специфичность, это способность фермента катализировать превращения только одного определенного субстрата или же группы сходных по строению субстратов. Определяется структурой адсорбционного участка активного центра фермента.
Различают 3 типа субстратной специфичности:
абсолютная субстратная специфичность - это способность фермента катализировать превращение только одного, строго определенного субстрата;
относительная субстратная специфичность - способность фермента катализировать превращения нескольких, сходных по строению, субстратов;
стереоспецифичность - способность фермента катализировать превращения определенных стереоизомеров.
Например, фермент оксидаза L-аминокислот способен окислять все аминокислоты, но относящиеся только к L-ряду. Таким образом, этот фермент обладает относительной субстратной специфичностью и стереоспецифичностью одновременно.
Специфичность действия - это способность фермента катализировать только определенный тип химической реакции.
В соответствии со специфичностью действия все ферменты делятся на 6 классов. Классы ферментов обозначаются латинскими цифрами. Название каждого класса ферментов соответствует этой цифре.
19.
Номенклатура и классификация ферментов
Сначала ферментам давали произвольные названия – пепсин, трипсин и т.п. когда количество ферментов возросло возникла необходимость классифицировать эти вещества. В 1896 году Дюкло предложил называть ферменты по субстрату, на который они действуют с прибавлением окончания –аза., например, сахараза и т.п. в последующем было отмечено, что ферменты могут действовать на одно вещество, но ускорять разные реакции. Поэтому в 1961 году на Международном Биохимическом съезде была принята классификация ферментов, которая используется по настоящее время. Несмотря на многочисленность ферментов, все реакции, ускоряемые ими можно разделить на 6 типов. В связи с этим различают 6 классов ферментов:
Оксидоредуктазы – ускоряют ОВР;
Трансферазы – ускоряют перенос различных групп атомов с одного вещества на другое;
Гидролазы – ускоряют расщепление сложных веществ до простых с участием воды (т.е. путем гидролиза);
Лиазы – ускоряют реакции распада веществ без участия воды или способствуют присоединению групп атомов по месту разрыва двойных связей;
Изомеразы – ведут реакции изомеризации;
Лигазы, или синтетазы – ускоряют синтез веществ за счет соединения молекул между собой.
Номенклатура ферментов. Каждый класс делится на подкласс, подкласс делится на подподкласс, в каждом подподклассе обозначен порядковый номер представителя. Поэтому для каждого фермента существует шифр, состоящий из 4 цифр – первая показывает номер класса, вторая – номер подкласса, третья – номер подподкласса, четвертая – место фермента в подподклассе. Например, шифр для липазы поджелудочной железы – 3.1.1.3., это означает, что липаза п/ж относится к гидролазам, (третий класс, т.е. ускоряет гидролиз), к первому подклассу – эстеразам (т.е. ускоряет гидролиз сложно-эфирных связей), к первому подподклассу (т.е. ускоряет гидролиз сложно-эфирных связей, образованных карбоновыми кислотами), место в подподклассе – третье.
Основные классы ферментов:
I класс - оксидоредуктазы
К данному классу относятся ферменты, катализирующие окислительно-восстановительные реакции. При окислении может происходить либо отнятие водорода от окисляемого вещества, либо присоединение кислорода к окисляемому веществу. В зависимости от способа окисления различают следующие подклассы оксидоредуктаз:
дегидрогеназы. Катализируют реакции, при которых происходит отнятие водорода от окисляемого вещества;
оксигеназы. Ферменты этого подкласса катализируют включение кислорода в окисляемое вещество:
монооксигеназы - включают один атом кислорода в окисляемое вещество;
диоксигеназы - включают 2 атома кислорода в окисляемое вещество. Часто это сопровождается разрывом циклической структуры. По месту разрыва связи присоединяются атомы кислорода.
II класс - трансферазы
Катализируют реакции переноса химических групп с молекулы одного вещества на молекулу другого вещества.
III класс - гидролазы
Катализируют реакции разрушения химических связей с участием воды.
IV класс - лиазы
Катализируют реакции разрушения химических связей без участия воды.
V класс - изомеразы
Катализируют реакции изомерных превращений.
VI класс - лигазы (сингазы, синтетазы)
Катализируют реакции синтеза.
20.
1.Способность к регуляции делает ферменты важными участниками и своеобразными организаторами клеточных процессов в организме человека. Регуляция скорости ферментативных реакций в клетке — основной механизм не только контроля и координации метаболических путей, но и роста и развития клетки, а также ее ответа на изменение окружающей среды.
2. Существует два основных способа контроля скорости ферментативных реакций:
— Контроль количества фермента.
Количество фермента в клетке определяется соотношением скоростей его синтеза и распада. Этот способ регуляция скорости ферментативной реакции является более медленным процессом (проявляется спустя несколько часов), чем регуляция активности фермента (практически мгновенный ответ).
— Контроль активности фермента.
Активность фермента может регулироваться путем взаимодействия с определенными веществами, изменяющими конформацию активного центра.
3. Ферменты, регулирующие скорость метаболических путей:
— обычно действуют на ранних стадиях метаболических путей, в местах ключевых разветвлений метаболических путей;
— катализируют в условиях клетки практически необратимые реакции, протекающие наиболее медленно (ключевые).
Пример 1. Регуляция по принципу обратной связи: в многоступенчатых метаболических путях конечный продукт ингибирует регуляторный (ключевой) фермент процесса.
Первый фермент (Ej) последовательного пути превращения вещества А в вещество Z обычно ингибируется конечным продуктом этого метаболического пути.
Изменение активности ключевого фермента Е1 происходит в результате изменения конформа-ции после связывания вещества Z в аллостерическом центре — участке, удаленном от активного центра. Фермент Е1 аллостерический.
Регуляция по принципу обратной связи происходит относительно быстро, и часто это первый ответ клетки на изменение условий.
С другой стороны, фермент Ех будет активным при снижении концентрации вещества Z.
4. Основные виды регуляции каталитической активности ферментов в клетке и структурные изменения ферментов в ходе их активации представлены в табл. 2.3.
5. Нарушение синтеза фермента может привести к энзимопатиям, при которых недостаток одного фермента в метаболическом пути может вызвать нарушение образования конечного продукта. В силу взаимозависимости метаболических путей дефект одного фермента часто приводит к целому ряду нарушений в обмене веществ:
С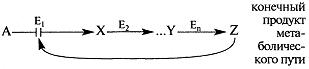 уществует
вероятность, что избыточно накопленный
субстрат может перейти на побочный путь
метаболизма с образованием необычного
и часто токсичного вещества Bj.
уществует
вероятность, что избыточно накопленный
субстрат может перейти на побочный путь
метаболизма с образованием необычного
и часто токсичного вещества Bj.
6. Отдельные примеры энзимопатий (дисахаридозы, гликогенозы, агликогенозы, фенилпирови-ноградная олигофрения) будут рассмотрены при изучении следующих разделов.
Влияние активаторов и ингибиторов на активность ферментов Активаторы разными путями могут повышать ферментативную активность: - формируют активный центр фермента; - облегчают образование фермент-субстратного комплекса; - стабилизируют нативную структуру фермента; - защищают функциональные группы активного центра. Классификация ингибиторов ферментов: 1. Неспецифические. 2. Специфические: а) необратимые б) обратимые: - конкурентные - неконкурентные. Неспецифические ингибиторы вызывают денатурацию молекулы фермента – это кислоты, щелочи, соли тяжелых металлов. Их действие не связано с механизмом ферментативного катализа.
Ингибиторы ферментов и их использование в качестве лечебных препаратов:
1. Действие ферментов можно полностью или частично подавить (ингибировать) определенными химическими веществами (ингибиторами).
2. По характеру своего действия ингибиторы подразделяются на обратимые инеобратимые. В основе такого деления лежит прочность соединения ингибитора с ферментом.
Обратимые ингибиторы — это соединения, которые нековалентно взаимодействуют с ферментом и могут диссоциировать от фермента.
Необратимые ингибиторы — это соединения, которые могут специфически связывать определенные функционально важные группы активного центра, образуя ковалентные, прочные связи с ферментом.
3. Обратимое ингибирование может быть конкурентным.
Конкурентный ингибитор конкурирует с субстратом за связывание в субстратсвязывающем участке активного центра и связывается с ферментом похожим способом, как и субстрат.
Отличительная особенность конкурентного ингибирования состоит в том, что его можно ослабить или полностью устранить,повысив концентрацию субстрата. Конкурентный ингибитор увеличивает Км, но не изменяет VMaKC.
Пример 1. Конкурентные ингибиторы похожи по структуре на субстраты, но не изменяются в активном центре ферментов.
Сукцинатдегидрогеназа (СДГ) — фермент цит-ратного цикла, дегидрирует сукцинат, превращая его в фумарат:
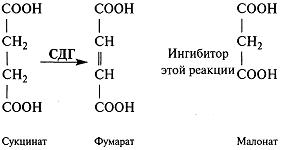
Малонат, который структурно похож на сукцинат (аналог сукцината), связывается в активном центре СДГ, но не может дегидрироваться. Малонат — конкурентный ингибитор СДГ.
Сукцинат + СДГ<-->СДГ • сукцинат —>СДГ + фумарат
Малонат + СДГ<-->±СДГ • малонат
Ингибирование СДГ малонатом можно устранить, повысив концентрацию сукцината.
4. Обратимое ингибирование может быть неконкурентным в отношении субстрата; в этом случае ингибитор не конкурирует с субстратом за одно и то же место в ферменте.
Неконкурентный ингибитор может связаться с ферментом и в присутствии, и в отсутствие субстрата, увеличение концентрации субстрата не препятствует связыванию ингибитора.
Неконкурентный ингибитор в действительности уменьшает количество активного фермента, уменьшая VMaKC и Км.
5. Многие лекарства являются конкурентными ингибиторами ферментов. В основе действия некоторых токсичных веществ лежит ингибирование активности ферментов.
Пример 2. Органические фторфосфаты типа ди-изопропилфторфосфата (ДФФ) являются ядами, потому что ковалентно связываются с остатком се-рина в активном центре некоторых ферментов.
Диизопропилфторфосфат и подобные соединения связываются в активном центре ферментов, которые используют остаток серина для гидролитического расщепления.
Симптомы отравления органическими фтор-фосфатами связаны в основном с необратимым ингибированием фермента — ацетилхолинэсте-разы (АХЭ).
Ацетилхолинэстераза ускоряет гидролиз ацетил-холина, функционирующего в качестве нейроме-диатора. Продукты распада ацетилхолина — ацетат и холин — не способны действовать как нейромедиаторы. Гидролиз ацетилхолина — важный этап в проведении нервного импульса.
Увеличение количества ацетилхолина в синапти-ческой щели при ингибировании АХЭ приводит к стойкой деполяризации постсинаптической мембраны и может вызвать паралич.
ДФФ и подобные фторфосфаты образуют кова-лентную связь с остатком серина в активном центре АХЭ. Ингибирование является необратимым, и активность АХЭ восстанавливается только после синтеза новых молекул фермента.
Пример 3. Лечение подагры аллопуринолом основано на ингибировании ксантиноксидазы.
Наиболее характерный клинический признак подагры — повторяющиеся приступы острого воспаления суставов, что связано с отложением в них кристаллов урата натрия (солей мочевой кислоты). Мочевая кислота — конечный продукт распада пуринов у человека.
На рис. 2.20, а показано, что ксантиноксидаза ускоряет окисление гипоксантина в ксантин и ксан-тина в мочевую кислоту.
Донором электронов и кислорода в реакции является вода. Окисление происходит при непосредственном участии молибден-оксо-сульфидного комплекса в активном центре ксантиноксидазы
Аллопуринол — структурный аналог гипоксантина, превращается на первой стадии окисления в аллоксантин, который связывается с молибденовым комплексом в активном центре ксантиноксидазы, вызывая ингибирование фермента
25.
