
- •Лабораторная работа 1
- •Ход работы
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 2
- •Теоретическое обоснование
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 3
- •Теоретическое обоснование работы
- •Ход работы
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 4
- •Теоретическое обоснование работы
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 5
- •Теоретическое обоснование работы
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 6
- •Теоретическое обоснование
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 7
- •Теоретическое обоснование
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 8
- •Теоретическое обоснование
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 9
- •Теоретическое обоснование
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 10
- •Теоретическое обоснование работы
- •Ход работы
- •Взаимная коагуляция
- •Расчёта порога коагуляции
- •Контрольные вопросы
Ход работы
Приготовить исходный 0,2 н. раствор СНзСООН и оттитровать его 0,1 н. NaOH с фенолфталеином. Приготовить разбавлением исходного раствора по 100 мл растворов следующих концентраций (г-экв/л): 0,1; 0,05; 0,025 и 0,0125. Точное содержание уксусной кислоты в полученных растворах определяют титрованием 0,1 н. раствором NaOH (индикатор —фенолфталеин). Из первых двух растворов с большей концентрацией взять для титрования по 10 мл кислоты, а из последних трех — по 20 мл.
В пять сухих пронумерованных колб с пробками отвесить по 1,5 г активированного угля на технических весах. В каждую колбу влить по 50 мл приготовленных растворов кислоты. Интенсивно взболтать и оставить стоять на 20—30 мин, чтобы установилось равновесие. Взбалтывать растворы каждые 3—5 мин.
Приготовить пять мерных стаканов с воронками, в которые поместить сухие складчатые фильтры. Растворы отфильтровать, отбрасывая первые порции фильтрата (3—5 мл), и фильтрат оттитровать, взяв для титрования из первых двух растворов по 10 мл кислоты, а из последних трех — по 20 мл.
Результаты измерений и расчетов занести в таблицу:
-
№
колбы
До адсорбции
После адсорбции
Адсорбция, А
lgA
Lg C
Объем кислоты, мл
Объем щелочи, мл
Концентрация кислоты
с1, моль/л
Объем кислоты, мл
Объем щелочи, мл
Концентрация кислоты
с2, моль/л
Массу адсорбированной кислоты рассчитать по формуле:
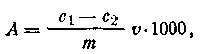
где с1— исходная концентрация кислоты, моль/л; с2 — равновесная концентрация кислоты, моль/л;v — объем раствора, взятый для адсорбции, л; т — масса адсорбента, г.
Вычертить по полученным данным график изотермы адсорбции. Вычислить IgA и Igc и построить график, откладывая IgA на оси ординат, a Igc — на оси абсцисс.
Измерить величину тангенса угла наклона прямой к оси абсцисс, что дает величину п; расстояние точки пересечения прямой с осью ординат от начала координат соответствует значению величины lg k.. Рассчитать и записать значения k и п .
Устно ответить на контрольные вопросы:
Контрольные вопросы
Какие явления называются сорбцией?
Какая разница между адсорбцией и абсорбцией?
Что называют адсорбентом? Адсорбтивом?
От каких факторов зависит адсорбция?
Что характеризует изотерма адсорбции?
В каких условиях применимо уравнение адсорбции Фрейндлиха?
В каких условиях применимо уравнение адсорбции Ленгмюра?
Где находит практическое применение адсорбция?
