
- •11 Типы химических реакций.
- •Органическая химия.
- •Реакции замещения.
- •Неорганическая химия.
- •Органическая химия.
- •Реакции обмена.
- •Неорганическая химия
- •Природа переносимых частиц.
- •Окислительно-восстановительные реакции.
- •Лиганднообменные реакции.
- •Возможность протекания реакции в прямом и обратном направлении. Необратимые реакции.
- •Обратимые реакции.
- •13 Агрегатное состояние вещества
- •15 Молекулярно-кинетическая теория
- •16 Стехиометрия
- •18 Объединенный газовый закон
- •Классификация
- •Классификация По заряду комплекса
- •По числу мест, занимаемых лигандами в координационной сфере
- •По природе лиганда
- •27. Квантово-механическая модель атома
- •28. Уравнение Шрёдингера
- •Энергетические уровни и подуровни
- •48) Гесса закон
- •Второй закон
- •Третий закон
- •50) Гиббса энергия
- •62. Свойства коллоидных растворов
- •1. Молекулярно-кинетические свойства.
- •II. Оптические свойства
- •III. Электрические свойства коллоидных растворов
- •65. Явление адсорбции. Типы адсорбции.
- •66. Основные теории и закономерности адсорбционных процессов
- •69.Растворы
- •Истинные и коллоидные растворы [править]
- •Растворение [править]
- •Растворы электролитов и неэлектролитов [править]
- •Растворы полимеров [править]
- •Концентрация растворов
- •70. Теории образования растворов: физическая, химическая и современная
- •71. Способы выражения содержания растворенного вещества (концентрации раствора). Понятия
- •Пересчет концентраций растворов из одних единиц в другие
- •Первый закон Рауля [править]
- •Отклонения от закона Рауля [править]
- •Второй закон Рауля [править]
- •Понижение температуры кристаллизации растворов [править]
- •Повышение температуры кипения растворов [править]
- •Криоскопическая и эбулиоскопическая константы [править]
- •Растворы электролитов [править]
- •Значение осмоса [править]
- •Вода как основа жизни на Земле, ее физические и химические свойства с точки зрения
- •Физические и химические свойства воды
- •76. Понятие жесткости воды и виды её. Способы определения и устранения жесткости воды
- •Итак, как уменьшить жесткость воды кипячением?
- •Реагентные способы устранения жесткости воды
- •Безреагентные способы устранения жесткости воды
- •Не органич: Очистка воды от ионов металлов
- •Очистка воды от органических веществ и растворов солей
- •Очистка от радиоактивных отходов
- •Химическое равновесие в воде: диссоциация (автопротолиз) и ионное произведение воды
- •Известные способы диссоциации воды:
- •Современные теории кислот и оснований.
- •Растворы электролитов. Теория электролитической диссоциации. Константа и степень
- •93. Электрохимическая система
28. Уравнение Шрёдингера
Волновое
уравнение было предложено в 1926 г. немецким
физиком Э. Шрёдингером (1887-1961)
для описания состояния электрона в
атоме водорода. Он объединил математические
выражения для колебательных процессов
и уравнение де Бройля и получил следующее
линейное дифференциальное однородное
уравнение: 
где ψ - волновая функция (аналог амплитуды для волнового движения в классической механике), которая характеризует движение электрона в пространстве как волнообразное возмущение; x, y, z - координаты, m - масса покоя электрона, h - постоянная Планка, E - полная энергия электрона, Ep - потенциальная энергия электрона.
Решениями уравнения Шрёдингера являются волновые функции. Для одноэлектронной системы (атома водорода) выражение для потенциальной энергии электрона имеет простой вид:
Ep = −e2 / r,
где e - заряд электрона, r - расстояние от электрона до ядра. В этом случае уравнение Шрёдингера имеет точное решение.
Квантовые числа, возникающие при решении волнового уравнения, служат для описания состояний квантово-химической системы. Каждая атомная орбиталь характеризуется набором из трех квантовых чисел: главного n, орбитального l и магнитного ml.
Главное квантовое число n характеризует энергию атомной орбитали. Оно может принимать любые положительные целочисленные значения. Чем больше значение n, тем выше энергия и больше размер орбитали. Решение уравнения Шрёдингера для атома водорода дает следующее выражение для энергии электрона:
E = −2π2me4 / n2h2 = −1312,1 / n2 (кДж/моль)
Таким образом, каждому значению главного квантового числа отвечает определенное значение энергии электрона. Уровни энергии с определенными значениями n иногда обозначают буквами K, L, M, N... (для n = 1, 2, 3, 4...).
Орбитальное квантовое число l характеризует энергетический подуровень. Атомные орбитали с разными орбитальными квантовыми числами различаются энергией и формой. Для каждого n разрешены целочисленные значения l от 0 до (n−1). Значения l = 0, 1, 2, 3... соответствуют энергетическим подуровням s,p, d, f.
Энергетические уровни и подуровни
Совокупность состояний электрона в атоме с одним и тем же значением n называют энергетическим уровнем. Число уровней, на которых находятся электроны в основном состоянии атома, совпадает с номером периода, в котором располагается элемент. Номера этих уровней обозначают цифрами: 1, 2, 3,... (реже - буквами K, L, M, ...).
Энергетический подуровень - совокупность энергетических состояний электрона в атоме, характеризующихся одними и теми же значениями квантовых чисел n и l. Подуровни обозначают буквами: s, p, d, f... Первый энергетический уровень имеет один подуровень, второй - два подуровня, третий - три подуровня и так далее.
Если на схеме орбитали обозначить в виде ячеек (квадратных рамок), а электроны - в виде стрелок (↑ или ↓), то можно увидеть, что главное квантовые число характеризуют энергетический уровень (ЭУ), совокупность главного и орбитального квантовых чисел - энергетический подуровень (ЭПУ), совокупность главного, орбитального и магнитного квантовых чисел - атомную орбиталь, а все четыре квантовые числа - электрон.
Каждой орбитали отвечает определенная энергия. Обозначение орбитали включает номер энергетического уровня и букву, отвечающую соответствующему подуровню: 1s, 3p, 4d и т.п. Для каждого энергетического уровня, начиная со второго, возможно существование трех равных по энергии p-орбиталей, расположенных в трех взаимно перпендикулярных направлениях. На каждом энергетическом уровне, начиная с третьего, имеется пять d-орбиталей, имеющих более сложную четырехлепестковую форму. Начиная с четвертого энергетического уровня, появляются еще более сложные по форме f-орбитали; на каждом уровне их семь. Атомную орбиталь с распределенным по ней зарядом электрона нередко называют электронным облаком.
29. Изотопы - химические элементы с одинаковыми зарядами ядер, но различными массовыми числами за счет разного числа нейтронов в ядре.
Массовое число Заряд ядра |
A Z |
Э |
63 29 |
Cu и |
65 29 |
Cu; |
35 17 |
Cl и |
37 17 |
Cl |
Изобары (в химии) Изобары, атомы различных химических элементов с одинаковым массовым числом А. Ядра изобаров содержат равное число нуклонов, но различные числа протоновZ и нейтронов N. Например, атомы 104Be, 105B, 106C представляют собой три изобара с A = 10. Массы изобаров с одним и тем же A несколько отличаются друг от друга, что связано с различием в энергиях связи их ядер. Изобары с наименьшими массами устойчивы относительно бета-распада, более тяжёлые — неустойчивы. Тяжёлый изобар с избытком протонов испытывает позитронный -распад или К-захват, а с избытком нейтронов — электронный -распад. Частный случай изобаров — зеркальные ядра (встречающиеся среди лёгких ядер), которые получаются заменой протонов на нейтроны и нейтронов на протоны, например 106С4 и 104Be6 или 73Li4 и74Ве3 |
30. Периодический закон был сформулирован Д. И. Менделеевым в следующем виде (1871): «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов».
В настоящее время периодическая система охватывает 117 элементов. Из них все трансурановые элементы (Z' = 93 — 117), а также элементы с Z = 43 (технеций), 61 (прометий), 85 (астат), 87 (франций) получены искусственно. За всю историю существования периодической системы было предложено большое количество (> 500) вариантов ее графического изображения, преимущественно в виде таблиц, а также в виде различных геометрических фигур (пространственных и плоскостных), аналитических кривых (спиралей и пр.) и т.д. Наибольшее распространение получили короткая, длинная и лестничная формы таблиц Менделеева.
В настоящее время предпочтение отдается короткой.
Фундаментальным принципом построения периодической системы является ее подразделение на группы и периоды. Менделеевское понятие рядов элементов ныне не употребляется, поскольку лишено физического смысла. Группы, в свою очередь, подразделяются на главную (а) и побочную (b) подгруппы. В каждой подгруппе содержатся элементы — химические аналоги. Элементы а- и b-подгрупп в большинстве групп также обнаруживают между собой определенное сходство, главным образом в высших степенях окисления, которые, как правило, равны номеру группы.
Периодом называется совокупность элементов, которая начинается щелочным металлом и заканчивается инертным газом (особый случай — первый период). Каждый период содержит строго определенное количество элементов. Периодическая система состоит из восьми групп и семи периодов, причем седьмой пока не завершен.
Структура периодической системы химических элементов тесно связана со строением атомов химических элементов. По мере роста Z периодически повторяются сходные типы конфигурации внешних электронных оболочек. А именно они определяют основные особенности химического поведения элементов. Эти особенности по-разному проявляются для элементов A-подгрупп (s- и р-элементы), для элементов b-подгрупп (переходные d-элементы) и элементов f-семейств — лантаноидов и актиноидов. Особый случай представляют элементы первого периода — водород и гелий. Для водорода характерна высокая химическая активность, потому что его единственный b-электрон легко отщепляется. В то же время конфигурация гелия (1st) весьма устойчива, что обусловливает его полную химическую бездеятельность.
41) Супрамолекулярная химия – одна из самых молодых и в то же время бурно развивающихся областей химии. За 25 – 30 лет своего существования она уже успела пройти ряд важных этапов, но в то же время основные идеи и понятия этой дисциплины еще не являются общеизвестными и общепринятыми. В предлагаемом обзоре мы стремились проследить развитие области науки, называемой супрамолекулярной химией, выявить наиболее удачные определения ее основных задач и важнейших понятий, а также обрисовать современное состояние и перспективы. Термин «супрамолекулярная химия» и основные понятия этой дисциплины были введены французским ученым Ж.-М. Леном в 1978 г. [1, 2] в рамках развития и обобщения более ранних работ [3] (в частности, в 1973 г. в его трудах появился термин «супермолекула»). Супрамолекулярная химия определялась словами: «Подобно тому как существует область молекулярной химии, основанной на ковалентных связях, существует и область супрамолекулярной химии, химии молекулярных ансамблей и межмолекулярных связей». Впоследствии это первое определение много раз переформулировалось. Пример другого определения, данного Леном: «супрамолекулярная химия – это «химия за пределами молекулы», изучающая структуру и функции ассоциаций двух или более химических частиц, удерживаемых вместе межмолекулярнымисилами»
Комплементарность в химии, молекулярной биологии и генетике — взаимное соответствие молекул биополимеров или их фрагментов, обеспечивающее образование связей между пространственно взаимодополняющими (комплементарными) фрагментами молекул или их структурных фрагментов вследствие супрамолекулярных взаимодействий.
42) Химическая термодинамика– основной раздел физической химии– науки, объясняющей химические явления и процессы и устанавливающей их общие закономерности на основе принципов физики.
Прирешенииосновныхзадачфизическаяхимияпользуетсясле-дующимитеоретическимиметодамифизики:
1. Термодинамическийметод – применяется для исследования направленности процессов, законов химических и фазовых равновесий.
Метод позволяет количественно связывать различные свойства и рассчитывать одни из этих свойств на основании опытных величин других
свойств.
2. Методстатистической физики – дает возможность рассчитать свойства макроскопических тел, исходя из свойств частиц, образующих этитела.
3. Квантово-механический метод – устанавливает способ описания и законы движения микрочастиц, а так же связь величин, характеризующих частицы и системы, с физическими величинами, непосредственно измеряемыми на опыте
Химическая термодинамика – раздел физической химии, изучающий макроскопические химические системы и процессы на основе общих законов взаимопревращения теплоты, различных видов работы и энергии. Содержание настоящего курса заключается в исследовании закономерностей теплового движения в равновесных системах и при переходе систем в равновесное состояние.
^ Внутренняя энергия – энергия физической системы, зависящая от её внутреннего состояния. Внутренняя энергия включает энергию хаотического (теплового) движения всех микрочастиц системы (молекул, атомов, ионов и т.д.) и энергию взаимодействия этих частиц. Кинетическая энергия движения системы как целого и её потенциальная энергия во внешних силовых полях во внутреннюю энергию не входит. В термодинамике и её приложениях представляет интерес не само значение внутренней энергии, а её изменение при изменении состояния системы. Внутренняя энергия – функция состояния системы.
^ Работа термодинамической
системы над внешними телами заключается в
изменении состояния этих тел и
определяется количеством энергии,
передаваемой системой внешним телам
при изменении объема. Работа в термодинамике
не является полным дифференциалом (не
является функцией состояния, а зависит
от пути) и обозначается ![]() .
Для
того чтобы изменить объём, занимаемый
газом, надо совершить работу. Представим
себе газ, заключённый в цилиндрический
объём с поршнем, движением которого
изменяется объём газа
.
Для
того чтобы изменить объём, занимаемый
газом, надо совершить работу. Представим
себе газ, заключённый в цилиндрический
объём с поршнем, движением которого
изменяется объём газа
Сила,
создаваемая давлением газа ![]() на
поршень площади
на
поршень площади ![]() равна
равна ![]() .
Работа, совершаемая при перемещении
поршня
.
Работа, совершаемая при перемещении
поршня ![]() ,
равна
,
равна ![]() ,
где
,
где ![]() изменение
объёма газа (рис. 14.1), то есть
изменение
объёма газа (рис. 14.1), то есть
^ Теплота (количество
теплоты) – количество
энергии, получаемой или отдаваемой
системой при теплообмене.
Элементарное количество теплоты ![]() не
является в общем случае дифференциалом какой-либо
функции параметров состояния. Передаваемое
системе количество теплоты, как и работа,
зависит от того, каким
способом система переходит из
начального состояния в конечное. (В
отличие от внутренней энергии, для
которой
не
является в общем случае дифференциалом какой-либо
функции параметров состояния. Передаваемое
системе количество теплоты, как и работа,
зависит от того, каким
способом система переходит из
начального состояния в конечное. (В
отличие от внутренней энергии, для
которой 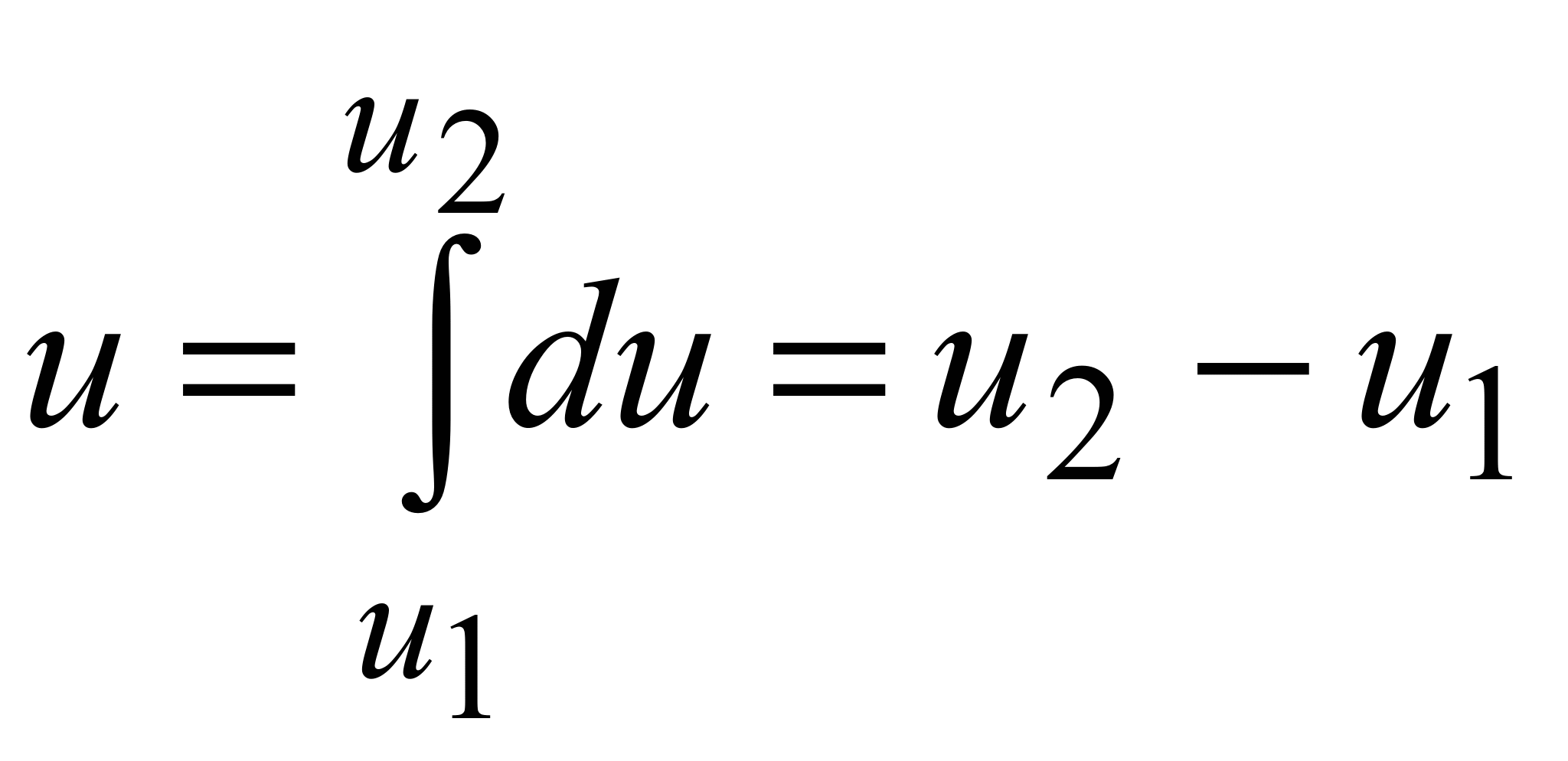 ,
но
,
но  ,
нельзя сказать, сколько работы содержит
тело, “это функция” процесса –
динамическая характеристика).
1-ый
закон (начало) термодинамики: количество
теплоты, сообщённое системе, идёт на
приращение внутренней энергии системы
и на совершение системой работы над
внешними телами.
,
нельзя сказать, сколько работы содержит
тело, “это функция” процесса –
динамическая характеристика).
1-ый
закон (начало) термодинамики: количество
теплоты, сообщённое системе, идёт на
приращение внутренней энергии системы
и на совершение системой работы над
внешними телами.
где ![]() количество
сообщённой телу теплоты;
количество
сообщённой телу теплоты;
![]() и
и ![]() начальное
и конечное значения внутренней
энергии;
начальное
и конечное значения внутренней
энергии;
![]() работа,
совершённая системой над внешними
телами.
работа,
совершённая системой над внешними
телами.
43) Простейшими частями химической системы, вообще говоря, являются атомы, молекулы или ионы. Однако конкретная система образуется не из абстрактных атомов, а из вполне конкретных веществ, которые могут реагировать друг с другом, вступая в химические реакции. Очень важно не только то, из каких веществ состоит система, но и то, при каких условиях она находится. Невозможно рассматривать химическую систему в отрыве от условий, в которых она существует.
Химическая система характеризуется семейством понятий, определений, формулировок как содержательных - что есть что, так и формальных – каковы связи, соотношения между частями, элементами системы. Лишь в рамках такого семейства определений можно выразить основные принципы построения и связей внутри каждой конкретной системы.
Химической системой называется ограниченная часть пространства, включающая какие – либо вещества. Все то, что не входит в систему, называется внешней средой.
Химическая система – сочетание веществ, взаимодействующих друг с другом. Система отделяется от окружения мысленно или фактически. Химические системы делятся на следующие виды:
а) гомогенные
б) гетерогенные
в) дисперсионные
г) нонвариантные
д) моновариантные
е) бивариантные
ж) поливариантные.
Типы химических реакций: Разложения – реакции при которых из одного вещества происходит образование нескольких веществ (пример: 2HgO=2Hg+O2).
1)Cоединения – оброазование из нескольких веществ одного (пример: H2+I2=2HI).
2)Обмена – реагирующие вещества обмениваются составными частями (пример: CaO+2HCl=CaCl2+H2O). Частным случаем является реакции нейтрализации – взамодействие кислот с основаниями.
3)Замещения – простое вещество вытесняет из простое из сложного (пример: Fe+2HCl=FeCl2+H2).
4)К особому типу относятся окислительно-восстановительные реакции, сочетающие в себе все или отдельные вышеперечисленные типы реакций.
Химическая система – совокупность микро и макро количеств веществ, способных воздействием внешних факторов (условий) к превращениям с образованием новых химических соединений. Вещество - вид материи, обладающее массой покоя и состоящий главным образом из элементарных частиц (электронов, протонов, нейтронов). Любое вещество состоит из структурных единиц – атомов, молекул, ионов. Атом – наименьшая частица химического элемента, носитель его свойств. Является самой простой электро енйтральной химической микросистемой, подчиняющейся законам квантовой механики. ^ Химический элемент – совокупность атомов с одинаковым зарядом ядра (пример: 63Сu и 65Сu – изотопы). Молекула – наименьшая частица химического вещества, способная к самостоятельному существованию как единая динамическая система, состоящая из положительно заряженных ядер и отрицательно заряженных электронов (пример: 2Cl—2e->Cl2). Ионы – частицы реального вещества (одно или много атомные), несущие на себе электрический заряд (пример: простые – H+, Na+, Сu2+; сложные – NH4+, SO42-). ^ Простые вещества – молекулы состоят из атомов одного и того же элемента (пример: металлы и неметаллы атомного строения – Cu, Ag, C, Si; неметаллы молекулярного строения – J2, Br2, O2). ^ Сложные вещества – молекулы состоят из атомов разных химических элементов (примеры: LiH, NaF). Химические превращения – такие превращения, при которых происходят изменения только во внешних электронных слоях атомов, не затрагивая внутренние слои и ядра. Основные признаки химических привращений: Выделение газа. Образование осадка
Выделение или поглащение теплоты Q. Изменение цвета как результат изменения электронного стороения или степени окисления элементов в молекулах.
44) Равновесные это такие процессы, при которых система переходит последовательно из одного состояния равновесия в другое. Под системой равновесия термодинамической системы понимается такое состояние, к которому она стремится, принимая при этом минимальные значения общей энергии. В состоянии равновесия параметры системы при отсутствии внешнего воздействия остаются постоянными.
45) При протекании химических реакций изменяется энергетическое состояние системы, в которой идет эта реакция. Состояние системы характеризуется термодинамическими параметрами (р, Т, с и др.). При изменении параметров меняется и состояние системы. В термодинамике свойства системы рассматриваются при ее равновесном состоянии. Термодинамическое состояние системы называют равновесным в том случае, когда его термодинамические параметры одинаковы во всех точках системы и не изменяются самопроизвольно (без затраты работы) во времени. Термодинамика изучает переходы системы из одного состояния в другое. Но переходы должны осуществляться при термодинамическом равновесии с окружающей средой, т.е. очень медленно, а в идеале — бесконечно медленно. При этом могут изменяться все параметры состояния системы, либо некоторые параметры остаются без изменения. Если процессы перехода системы происходят при постоянстве каких-то параметров системы, то они называются: а) изобарическими (р = const); б) изохорическими (Т= const); в) изотермическими (Т = const); г) изобарно-изотермическими (р,T - const) и т.д. Термодинамика изучает возможность или невозможность самопроизвольного перехода системы из одного состояния в другое и энергетические эффекты этих переходов. Скорость и механизм процессов перехода — это области химической кинетики.
Термодинамические процессы. С течением времени в результате определенных воздействий параметры состояния термодинамической системы могут изменяться. Совокупность непрерывно изменяющихся состояний термодинамической системы называют термодинамическим процессом. Равновесным называется такой процесс, при котором в любой момент времени все параметры состояния системы в любой точке ее объема одинаковы. Так, в любой момент времени удельный объем, давление и температура в различных частях объема системы соответственно одинаковы.
С
течением времени в результате определенных
воздействий параметры состояния
термодинамической системы могут
изменяться. Совокупность непрерывно
изменяющихся состояний термодинамической
системы называют термодинамическим
процессом.
Равновесным называется
такой процесс, при котором в любой момент
времени все параметры состояния системы
в любой точке ее объема одинаковы. Так,
в любой момент времени удельный объем,
давление и температура в различных
частях объема системы соответственно
одинаковы.
Неравновесным называют
процесс, при котором в данный момент
времени параметры состояния системы в
разных точках ее объема различны. Такое
наблюдается в случаях, когда скорость
движения отдельных частей объема
термодинамической системы соизмерима
со скоростью звука. Процессы, рассматриваемые
в большинстве технических задач с
достаточной точностью можно считать
равновесными. Это позволяет изображать
термодинамические процессы в диаграммах
состояния - диаграммах,
в которых по осям откладываются параметры
состояния. В качестве примера на рис.
1.1 дано изображение некоторого процесса
1-2 в p-v диаграмме,
то есть диаграмме,![]() в
которой по оси абсцисс откладывается
удельный объем, а по оси ординат абсолютное
давление.
Промежуточным
состояниям, через которые проходит
система в процессе перехода, соответствуют
точки на кривой A.
Если
система переходит из состояния 1 в
состояние 2 так, что возможно вернуть
её в исходное состояние таким образом,
чтобы в окружающей среде в итоге не
произошло никаких изменений, то такой
процесс называется обратимым.
Если это сделать невозможно, то процесс
называется необратимым.
в
которой по оси абсцисс откладывается
удельный объем, а по оси ординат абсолютное
давление.
Промежуточным
состояниям, через которые проходит
система в процессе перехода, соответствуют
точки на кривой A.
Если
система переходит из состояния 1 в
состояние 2 так, что возможно вернуть
её в исходное состояние таким образом,
чтобы в окружающей среде в итоге не
произошло никаких изменений, то такой
процесс называется обратимым.
Если это сделать невозможно, то процесс
называется необратимым.
46) Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы и не зависит от способа, которым осуществляется этот переход. Это определение особенно важно для химической термодинамики[2] (ввиду сложности рассматриваемых процессов). Иными словами, внутренняя энергия является функцией состояния. В циклическом процессе внутренняя энергия не изменяется.
![]()
Изменение
полной энергии системы в квазистатическом
процессе равно
количеству теплоты ![]() ,
сообщённому системе, в сумме с изменением
энергии, связанной с количеством
вещества
,
сообщённому системе, в сумме с изменением
энергии, связанной с количеством
вещества ![]() при химическом
потенциале
при химическом
потенциале ![]() ,
и работы
,
и работы ![]() [3],
совершённой над системой внешними
силами и полями,
за вычетом работы
[3],
совершённой над системой внешними
силами и полями,
за вычетом работы ![]() ,
совершённой самой системой против
внешних сил
,
совершённой самой системой против
внешних сил
![]() .
.
Для
элементарного количества теплоты ![]() ,
элементарной работы
,
элементарной работы ![]() и
малого приращения
и
малого приращения ![]() внутренней
энергии первый закон термодинамики
имеет вид:
внутренней
энергии первый закон термодинамики
имеет вид:
![]() .
.
Разделение работы на две части, одна из которых описывает работу, совершённую над системой, а вторая — работу, совершённую самой системой, подчёркивает, что эти работы могут быть совершены силами разной природы вследствие разных источников сил.
Важно
заметить, что
и ![]() являются полными
дифференциалами,
а
и
—
нет.
являются полными
дифференциалами,
а
и
—
нет.
Первое начало термодинамики:
при изобарном процессе
![]()
при изохорном процессе (
 )
)
![]()
при изотермическом процессе

![]()
Здесь ![]() — масса газа,
— масса газа, ![]() — молярная
масса газа,
— молярная
масса газа, ![]() — молярная
теплоёмкость при
постоянном объёме,
— молярная
теплоёмкость при
постоянном объёме, ![]() — давление, объём и температура газа
соответственно, причём последнее
равенство верно только для идеального
газа.
— давление, объём и температура газа
соответственно, причём последнее
равенство верно только для идеального
газа.
Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Проще говоря, энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенном постоянном давлении.
Если термомеханическую систему рассматривать как состоящую из макротела (газа) и поршня площадью S с грузом весом Р = pS, уравновешивающего давление газа р внутри сосуда, то такая система называется расширенной.
Энтальпия или энергия расширенной системы Е равна сумме внутренней энергии газа U и потенциальной энергии поршня с грузом Eпот = pSx = pV
![]()
Таким образом, энтальпия в данном состоянии представляет собой сумму внутренней энергии тела и работы, которую необходимо затратить, чтобы тело объёмом V ввести в окружающую среду, имеющую давление р и находящуюся с телом в равновесном состоянии. Энтальпия системы H — аналогично внутренней энергии и другим термодинамическим потенциалам — имеет вполне определенное значение для каждого состояния, т. е. является функцией состояния. Следовательно, в процессе изменения состояния
![]()
Изменение
энтальпии (или Тепловой
эффект химической реакции)
не зависит от пути процесса, определяясь
только начальным и конечным состоянием
системы. Если система каким-либо путём
возвращается в исходное состояние
(круговой процесс), то изменение любого
её параметра, являющегося функцией
состояния, равно нулю, отсюда ![]() ,
или же
,
или же
![]()
Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания химической реакции — отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов.
Чтобы тепловой эффект являлся величиной, зависящей только от характера протекающей химической реакции, необходимо соблюдение следующих условий:
Реакция должна протекать либо при постоянном объёме Qv(изохорный процесс), либо при постоянном давлении Qp(изобарный процесс).
В системе не совершается никакой работы, кроме возможной при P = const работы расширения.
Если
реакцию проводят при стандартных
условиях при Т = 298,15 К = 25 ˚С и Р = 1 атм =
101325 Па, тепловой эффект называют
стандартным тепловым эффектом реакции
или стандартной энтальпией реакции
ΔHrO.
В термохимии стандартный тепловой
эффект реакции рассчитывают с помощью
стандартных энтальпий образования.
Экзотермическая реакция
Экзотермическая реакция
химическая реакция, сопровождающаяся выделением теплоты. Э. р. являются, например, Горение, Нейтрализация, большинство реакций образования химических соединений из простых веществ Количество выделяющейся при Э. р. теплоты зависит от массы реагентов и их природы, агрегатного состояния исходных веществ и продуктов взаимодействия, типа реакции и условий её осуществления (температуры, давления и др.). По тепловому эффекту Э. р. противоположны эндотермическим реакциям.
Эндотерми́ческие
реа́кции (от др.-греч. ἔνδον —
внутри и θέρμη —
тепло) — химические реакции,
сопровождающиеся поглощением теплоты.
Для эндотермических реакций
изменение энтальпии и внутренней
энергии имеют
положительные значения (![]() ,
, ![]() ),
таким образом, продукты реакции содержат
больше энергии, чем исходные компоненты.
),
таким образом, продукты реакции содержат
больше энергии, чем исходные компоненты.
К эндотермическим реакциям относятся:
реакции восстановления металлов из оксидов,
электролиза (поглощается электрическая энергия),
электролитической диссоциации (например, растворение солей в воде),
ионизации,
фотосинтеза.
Эндотермические реакции противоположны экзотермическим реакциям.
Любая химическая реакция сопровождается выделением или поглощением энергии. Особенность термохимических уравнений заключается в том, что при работе с ними можно переносить формулы веществ и величины тепловых эффектов из одной части уравнения в другую. С обычными уравнениями химических реакций так поступать, как правило, нельзя.
47) Станда́ртные состоя́ния — в химической термодинамике условно принятые состояния индивидуальных веществ и компонентов растворов при оценке термодинамических величин.
Необходимость введения «стандартных состояний» связана с тем, что термодинамические закономерности не описывают достаточно точно поведение реальных веществ, когда количественной характеристикой служит давление или концентрация. Стандартные состояния выбирают из соображений удобства расчётов, и они могут меняться при переходе от одной задачи к другой.
В стандартных состояниях значения термодинамических величин называют «стандартными» и обозначают нулем в верхнем индексе[1], например: G0, H0, m0 — это соответственно стандартные энергия Гиббса, энтальпия, химический потенциал вещества. Вместо давления в термодинамических уравнениях для идеальных газов и растворов используютфугитивность (летучесть), а вместо концентрации — активность.
Стандартная энтальпия химической связи — это изменение энтальпии в реакции образования одного моля двухатомных молекул (или других двухатомных частиц) из атомов веществ, находящихся в газообразном состоянии: H(г) + Cl(г) = HCl(г) С(г) + H(г) = CH(г)
Энтальпия (теплота) образования - это тепловой эффект реакции образования 1 моль сложного вещества из простых веществ: DfH [Дж/моль; кДж/моль]. Обычно в расчетах используют стандартные энтальпии образования .СТАНДАРТНАЯ ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ DfH°(298 K) это тепловой эффект образования 1 моль сложного вещества из простых веществ при стандартных условиях (T = 298,15 K и p = 101,3 кПа). Стандартные энтальпии образования простых веществ, устойчивых в стандартных условиях (газообразный O2, кристаллический I2 и т.д.) принимают равными нулю. Например, окисление водорода можно представить тремя уравнениями: (6) 2H2(г) + O2(г) = 2H2O(ж) ; DH°(298K)6 = -571,6 кДж (7) H2(г) + 1/2O2(г) = H2O(ж) ; DH°(298K)7 = -285,8 кДж (8) H2(г) + 1/2O2(г) = H2O(г) ; DH°(298K)8= -241,8 кДж Каждому уравнению соответствует определенное значение теплового эффекта. И только тепловой эффект реакции, описываемой уравнением (7), будет равен стандартной теплоте образования воды DH°(298 K)7 = DfH°(298 K, H2O(ж)). Согласно этому уравнению в реакции образуется 1 моль воды, стандартным состоянием которой при 298 K является жидкое. Для многих веществ стандартные теплоты образования известны и сведены в справочные таблицы.
Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяющая отношение бесконечно малого количества теплоты δQ, полученного телом, к соответствующему приращению его температуры δT:
![]()
Единица измерения теплоёмкости в системе СИ — Дж/К.
Удельной теплоёмкостью называется теплоёмкость, отнесённая к единичному количеству вещества. Количество вещества может быть измерено в килограммах, кубических метрах и молях. В зависимости от того, к какой количественной единице относится теплоёмкость, различают массовую, объёмную и молярную теплоёмкость.
Массовая теплоёмкость (С) — это количество теплоты, которое необходимо подвести к единице массы вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на килограмм на кельвин (Дж·кг−1·К−1).
Объёмная теплоёмкость (С′) — это количество теплоты, которое необходимо подвести к единице объёма вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на кубический метр на кельвин (Дж·м−3·К−1).
Молярная теплоёмкость (Сμ) — это количество теплоты, которое необходимо подвести к 1 молю вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на моль на кельвин (Дж/(моль·К)).
