
- •11 Типы химических реакций.
- •Органическая химия.
- •Реакции замещения.
- •Неорганическая химия.
- •Органическая химия.
- •Реакции обмена.
- •Неорганическая химия
- •Природа переносимых частиц.
- •Окислительно-восстановительные реакции.
- •Лиганднообменные реакции.
- •Возможность протекания реакции в прямом и обратном направлении. Необратимые реакции.
- •Обратимые реакции.
- •13 Агрегатное состояние вещества
- •15 Молекулярно-кинетическая теория
- •16 Стехиометрия
- •18 Объединенный газовый закон
- •Классификация
- •Классификация По заряду комплекса
- •По числу мест, занимаемых лигандами в координационной сфере
- •По природе лиганда
- •27. Квантово-механическая модель атома
- •28. Уравнение Шрёдингера
- •Энергетические уровни и подуровни
- •48) Гесса закон
- •Второй закон
- •Третий закон
- •50) Гиббса энергия
- •62. Свойства коллоидных растворов
- •1. Молекулярно-кинетические свойства.
- •II. Оптические свойства
- •III. Электрические свойства коллоидных растворов
- •65. Явление адсорбции. Типы адсорбции.
- •66. Основные теории и закономерности адсорбционных процессов
- •69.Растворы
- •Истинные и коллоидные растворы [править]
- •Растворение [править]
- •Растворы электролитов и неэлектролитов [править]
- •Растворы полимеров [править]
- •Концентрация растворов
- •70. Теории образования растворов: физическая, химическая и современная
- •71. Способы выражения содержания растворенного вещества (концентрации раствора). Понятия
- •Пересчет концентраций растворов из одних единиц в другие
- •Первый закон Рауля [править]
- •Отклонения от закона Рауля [править]
- •Второй закон Рауля [править]
- •Понижение температуры кристаллизации растворов [править]
- •Повышение температуры кипения растворов [править]
- •Криоскопическая и эбулиоскопическая константы [править]
- •Растворы электролитов [править]
- •Значение осмоса [править]
- •Вода как основа жизни на Земле, ее физические и химические свойства с точки зрения
- •Физические и химические свойства воды
- •76. Понятие жесткости воды и виды её. Способы определения и устранения жесткости воды
- •Итак, как уменьшить жесткость воды кипячением?
- •Реагентные способы устранения жесткости воды
- •Безреагентные способы устранения жесткости воды
- •Не органич: Очистка воды от ионов металлов
- •Очистка воды от органических веществ и растворов солей
- •Очистка от радиоактивных отходов
- •Химическое равновесие в воде: диссоциация (автопротолиз) и ионное произведение воды
- •Известные способы диссоциации воды:
- •Современные теории кислот и оснований.
- •Растворы электролитов. Теория электролитической диссоциации. Константа и степень
- •93. Электрохимическая система
15 Молекулярно-кинетическая теория
(сокращённо МКТ) — теория, возникшая в XIX веке и рассматривающая строение вещества, в основном газов, с точки зрения трёх основных приближенно верных положений:
все тела состоят из частиц: атомов, молекул и ионов;
частицы находятся в непрерывном хаотическом движении (тепловом);
частицы взаимодействуют друг с другом путём абсолютно упругих столкновений.
МКТ стала одной из самых успешных физических теорий и была подтверждена целым рядом опытных фактов. Основными доказательствами положений МКТ стали:
Диффузия
Броуновское движение
Изменение агрегатных состояний вещества
На основе МКТ развит целый ряд разделов современной физики, в частности, физическая кинетика и статистическая механика. В этих разделах физики изучаются не только молекулярные (атомные или ионные) системы, находящиеся не только в «тепловом» движении, и взаимодействующие не только через абсолютно упругие столкновения. Термин же молекулярно-кинетическая теория в современной теоретической физике уже практически не используется, хотя он встречается в учебниках по курсу общей физики.
Началом становления МКТ послужила теория М. В. Ломоносова[1][2]. Ломоносов опытным путём опроверг теории о теплороде и флогистоне, подготовив тем самым, молекулярно-кинетическую теорию XIX века Рудольфа Клаузиуса, Людвига Больцмана иДжеймса Максвелла.
Основное уравнение МКТ
P= 1/3*m0*n*v^2,
где k является постоянной
Больцмана (отношение универсальной
газовой постоянной R к числу
Авогадро NA),i —
число степеней свободы молекул (![]() в
большинстве задач про идеальные газы,
где молекулы предполагаются сферами
малого радиуса, физическим аналогом
которых могут служить инертные газы),
а T -
абсолютная температура.
в
большинстве задач про идеальные газы,
где молекулы предполагаются сферами
малого радиуса, физическим аналогом
которых могут служить инертные газы),
а T -
абсолютная температура.
Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) газовой системы с микроскопическими (масса молекул, средняя скорость их движения).
16 Стехиометрия
(от др.-греч. «элемент» + «измерять») — раздел химии о соотношениях реагентов вхимических реакциях.Позволяет теоретически вычислять необходимые массы и объёмы реагентов.В основе стехиометрии лежат законы сохранения массы, эквивалентов, Авогадро, Гей-Люссака, постоянства состава, кратных отношений. Все законы стехиометрии обусловлены атомно-молекулярным строением вещества.
Термин "стехиометрия" ввёл И. Рихтер в 1793 году.Отношения количеств реагентов, равные отношениям коэффициентов в стехиометрическом уравнении реакции, называютсястехиометрическими. Если вещества реагируют в соотношении 1:1, то их соответственные количества называютэквимолярными.
Вещества, для которых наблюдаются отклонения от законов стехиометрии, наз. нестехиометрическими. Отклонения от законов стехиометрии наблюдаются для конденсированных фаз и связаны с образованием твердых растворов (для кристаллических веществ), с растворением в жидкости избытка компонента реакции или термической диссоциацией образующегося соединения (в жидкой фазе, в расплаве). Законы стехиометрии используют в расчетах, связанных с формулами веществ и нахождением теоретически возможного выхода продуктов реакции.
Изопроцессы идеального газа – процессы, при которых один из параметров остаётся неизменным.
1. Изохорический процесс. Закон Шарля. V = const.
Изохорическим процессом называется процесс, протекающий при постоянном объёме V. Поведение газа при этом изохорическом процессе подчиняется закону Шарля:
При постоянном объёме и неизменных значениях массы газа и его молярной массы, отношение давления газа к его абсолютной температуре остаётся постоянным: P/Т = const.
График изохорического процесса на РV-диаграмме называется изохорой. Полезно знать график изохорического процесса на РТ- и VT-диаграммах (рис. 1.6). Уравнение изохоры:
|
|
|
(1.4.1) |
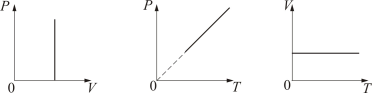 Рис.
1.6
Рис.
1.6
Если температура газа выражена в градусах Цельсия, то уравнение изохорического процесса записывается в виде
|
|
|
(1.4.2) |
где Р0 – давление при 0 °С, α - температурный коэффициент давления газа равный 1/273 град-1. График такой зависимости на Рt-диаграмме имеет вид, показанный на рисунке 1.7.
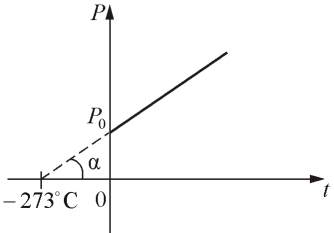 Рис.
1.7
Рис.
1.7
2. Изобарический процесс. Закон Гей-Люссака. Р = const.
Изобарическим процессом называется процесс, протекающий при постоянном давлении Р. Поведение газа при изобарическом процессе подчиняется закону Гей-Люссака:
При постоянном давлении и неизменных значениях массы и газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const.
График изобарического процесса на VT-диаграмме называется изобарой. Полезно знать графики изобарического процесса на РV- и РT-диаграммах (рис. 1.8).
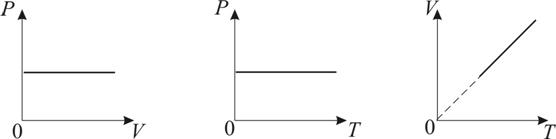 Рис.
1.8
Рис.
1.8
Уравнение изобары:
|
|
|
(1.4.3) |
Если температура газа выражена в градусах Цельсия, то уравнение изобарического процесса записывается в виде
|
|
|
(1.4.4) |
где α =1/273 град -1- температурный коэффициент объёмного расширения. График такой зависимости на Vt диаграмме имеет вид, показанный на рисунке 1.9.
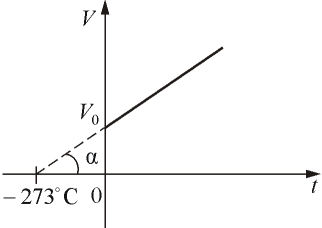 Рис.
1.9
Рис.
1.9
3. Изотермический процесс. Закон Бойля – Мариотта. T = const.
Изотермическим процессом называется процесс, протекающий при постоянной температуре Т.
Поведение идеального газа при изотермическом процессе подчиняется закону Бойля – Мариотта:
При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.
График изотермического процесса на РV-диаграмме называется изотермой. Полезно знать графики изотермического процесса на VT- и РT-диаграммах (рис. 1.10).
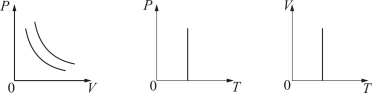 Рис.
1.10
Рис.
1.10
Уравнение изотермы:
|
|
|
(1.4.5) |
4. Адиабатический процесс (изоэнтропийный):
Адиабатический процесс – термодинамический процесс, происходящий без теплообмена с окружающей средой.
5. Политропический процесс. Процесс, при котором теплоёмкость газа остаётся постоянной. Политропический процесс – общий случай всех перечисленных выше процессов.
6. Закон Авогадро. При одинаковых давлениях и одинаковых температурах, в равных объёмах различных идеальных газов содержится одинаковое число молекул. В одном моле различных веществ содержится NA=6,02·1023молекул (число Авогадро).
7. Закон Дальтона. Давление смеси идеальных газов равно сумме парциальных давлений Р, входящих в неё газов:
|
|
|
(1.4.6) |
Парциальное давление Pn – давление, которое оказывал бы данный газ, если бы он один занимал весь объем.
При ![]() ,
давление смеси газов:
,
давление смеси газов:
|
|
|
(1.4.7) |
8. Объединённый газовый закон (Закон Клапейрона).
В соответствии с законами Бойля – Мариотта (1.4.5) и Гей-Люссака (1.4.3) можно сделать заключение, что для данной массы газа
|
|
17 Закон Авогадро (А. Авогадро, 1811)
В равных объемах газов (V) при одинаковых условиях (температуре Т и давлении Р) содержится одинаковое число молекул.
Следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объем.
В частности, при нормальных условиях, т.е. при 0° С (273 К) и 101,3 кПа, объем 1 моля газа, равен 22,4 л. Этот объем называют молярным объемом газа Vm. Таким образом, при нормальных условиях (н.у.) молярный объем любого газа
Vm = 22,4 л/моль.
Закон Авогадро используется в расчетах для газообразных веществ. При пересчете объема газа от нормальных условий к любым иным применяют объединенный газовый закон Бойля-Мариотта и Гей-Люссака:
![]()
где Рo, Vo, Тo – давление, объем газа и температура при нормальных условиях (Рo = 101,3 кПа, Тo = 273К).
Если известна масса (m) или количество (ν) газа и требуется вычислить его объем, или наоборот, используют уравнение Менделеева-Клапейрона:
PV = ν RT,
где ν = m/M – отношение массы вещества к его молярной массе, R – универсальная газовая постоянная, равная 8,31 Дж/(моль•К).
Из закона Авогадро вытекает еще одно важное следствие: отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов. Эта постоянная величина называется относительной плотностью газа и обозначается D. Так как молярные объемы всех газов одинаковы (1-е следствие закона Авогадро), то отношение молярных масс любой пары газов также равна этой постоянной:
![]()
где М1 и М2 – молярные массы двух газообразных веществ.
Величина D определяется экспериментально как отношение масс одинаковых объемов исследуемого газа (М1) и эталонного газа с известной молекулярной массой (М2). По величинам D и М2 можно найти молярную массу исследуемого газа:
M1 = D • M2.

