
- •2. Единицы физических величин.
- •3. Механика. Система отсчета, путь и перемещение.
- •5. Вращательное движение. Угловая скорость и угловое ускорение.
- •6. Взаимосвязи законов поступательного и вращательного движения.
- •8. Второй закон Ньютона.
- •10. Импульс и закон сохранения импульса. Центр масс.
- •11. Работа, энергия и мощность.
- •12. Кинетическая и потенциальная энергия.
- •14. Удар (упругий и неупругий).
- •1 6. Кинетическая энергия вращения.
- •17. Момент силы и основное уравнение динамики вращательного движения твердого тела.
- •20. Деформации твердого тела. Закон Гука.
- •21. Законы Кеплера и закон всемирного тяготения.
- •22. Сила тяжести и вес. Невесомость.
- •24. Космические скорости.
- •25. Неинерциальные системы отсчета. Силы инерции при ускоренном поступательном движении. & 26. Силы инерции во вращающейся системе отсчета.
- •27. Столкновения. Упругий и неупругий удар.
- •28. Давление в жидкости и газе. Законы Паскаля и Архимеда.
- •29. Уравнение непрерывности и уравнение Бернулли.
- •3 1. Физический и математический маятники.
- •33. Преобразования Галилея. Механический принцип относительности.
- •34. Постулаты спец теории относительности
- •3 5. Преобразования Лоренца
- •36. Следствие преобразований Лоренца - неодновременность событий в разных системах отсчета
- •37. Длительность событий в разных системах отсчета.
- •38. Длина тел в разных системах отсчета.
- •39. Релятивистский закон сложения скоростей.
- •40. Интервал между событиями
- •41. Основной закон релятивистской динамики материальной точки
- •43. Статистический и термодинамический методы.
- •44. Параметры состояния термодинамической системы
- •45. Модель идеального газа
- •46. Законы Бойля—Мариотта, Гей-Люссака и Шарля
- •47. Закон Авогадро, Закон Дальтона
- •48. Уравнение Клапейрона — Менделеева
- •49.Основное уравнение молекулярно-кинетической теории идеал. Газов
- •50. Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы молекул
- •51. Распределение максвелла по скоростям и энергиям молекул
- •52. Барометрическая формула. Распределение Больцмана
- •53. Опытное обоснование молекулярно-кинетической теории
- •54. Первое начало термодинамики
- •56. Теплоемкость. Уравнением Майера
- •57. Применение первого начала термодинамики к изопроцессам
- •58. Адиабатический процесс. Политропный процесс
- •59. Круговой процесс (цикл). Обратимые и необратимые процессы &
- •6 0. Кпд кругового процесса
- •61. Цикл Карно и его к. П. Д. Для идеального газа
- •62. Энтропия и ее свойства & 64. Статистический смысл энтропии
- •63. Второе начало термодинамики
- •65. Третье начало термодинамики
- •66. Свойства реальных газов. Уравнение Ван-дер-Ваальса
- •67. Эффект Джоуля — Томсона
- •68. Уравнение Бернулли и следствия из него
65. Третье начало термодинамики
Третье начало термодинамики (теорема Нернста) — физический принцип, определяющий поведение энтропии при приближении температуры к абсолютному нулю. Является одним из постулатов термодинамики, принимаемым на основе обобщения значительного количества экспериментальных данных.
Формулировка Третье начало термодинамики может быть сформулировано так:
«Приращение энтропии при абсолютном нуле температуры стремится к конечному пределу, не зависящему от того, в каком равновесном состоянии находится система».
![]() или
или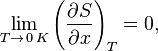
где ![]() —
любой термодинамический параметр.
—
любой термодинамический параметр.
Третье начало термодинамики относится только к равновесным состояниям.
Поскольку
на основе второго начала термодинамики
энтропию можно определить только с
точностью до произвольной аддитивной
постоянной (то есть, определяется не
сама энтропия, а только её изменение):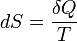 ,
,
третье начало термодинамики может быть использовано для точного определения энтропии. При этом энтропию равновесной системы при абсолютном нуле температуры считают равной нулю.
Третье
начало термодинамики позволяет находить
абсолютное значение энтропии, что нельзя
сделать в рамках классической термодинамики
(на основе первого и второго начал
термодинамики). В классической
термодинамике энтропия может быть
определена лишь с точностью до произвольной
аддитивной постоянной ![]() ,
что не мешает термодинамическим
исследованиям, так как реально измеряется
разность энтропий
,
что не мешает термодинамическим
исследованиям, так как реально измеряется
разность энтропий ![]() в
различных состояниях. Согласно третьему
началу термодинамики, при
в
различных состояниях. Согласно третьему
началу термодинамики, при ![]() значение
значение ![]() .
.
В 1911
году Макс
Планк сформулировал
третье начало термодинамики как условие
обращения в нуль энтропии всех тел при
стремлении температуры к абсолютному
нулю: ![]() .
Отсюда
.
Отсюда ![]() ,
что даёт возможность определять
абсолютное значения энтропии и
других термодинамических
потенциалов.
Формулировка Планка соответствует
определению энтропии в статистической
физике через термодинамическую
вероятность
,
что даёт возможность определять
абсолютное значения энтропии и
других термодинамических
потенциалов.
Формулировка Планка соответствует
определению энтропии в статистической
физике через термодинамическую
вероятность ![]() состояния
системы
состояния
системы ![]() .
При абсолютном нуле температуры система
находится в основном квантово-механическом
состоянии. Если оно невырожденно,
то
.
При абсолютном нуле температуры система
находится в основном квантово-механическом
состоянии. Если оно невырожденно,
то ![]() (состояние
реализуется единственным микрораспределением)
и энтропия
при
равна
нулю. В действительности при всех
измерениях стремление энтропии к нулю
начинает проявляться значительно
раньше, чем могут стать существенными
дискретность квантовых уровней
макроскопической системы и влияние
квантового вырождения.
(состояние
реализуется единственным микрораспределением)
и энтропия
при
равна
нулю. В действительности при всех
измерениях стремление энтропии к нулю
начинает проявляться значительно
раньше, чем могут стать существенными
дискретность квантовых уровней
макроскопической системы и влияние
квантового вырождения.
Следствия. Недостижимость абсолютного нуля температур Из третьего начала термодинамики следует, что абсолютного нуля температуры нельзя достичь ни в каком конечном процессе, связанном с изменением энтропии, к нему можно лишь асимптотически приближаться, поэтому третье начало термодинамики иногда формулируют как принцип недостижимости абсолютного нуля температуры.
Поведение термодинамических коэффициентов
Из
третьего начала термодинамики вытекает
ряд термодинамических следствий:
при
должны
стремиться к нулю теплоёмкости при
постоянном давлении и при постоянном
объёме, коэффициенты теплового расширения
и некоторые аналогичные величины.
Справедливость третьего начала
термодинамики одно время подвергалась
сомнению, но позже было выяснено, что
все кажущиеся противоречия (ненулевое
значение энтропии у ряда веществ при ![]() )
связаны с метастабильными
состояниями вещества,
которые нельзя считать термодинамически
равновесными.
)
связаны с метастабильными
состояниями вещества,
которые нельзя считать термодинамически
равновесными.
Нарушения третьего начала термодинамики в моделях
Третье начало термодинамики часто нарушается в модельных системах. Так, при энтропия классического идеального газа стремится к минус бесконечности. Это говорит о том, что при низких температурах уравнение Менделеева — Клапейрона неадекватно описывает поведение реальных газов.
Таким образом, третье начало термодинамики указывает на недостаточность классической механики и статистики и является макроскопическим проявлением квантовых свойств реальных систем.
