
- •2. Единицы физических величин.
- •3. Механика. Система отсчета, путь и перемещение.
- •5. Вращательное движение. Угловая скорость и угловое ускорение.
- •6. Взаимосвязи законов поступательного и вращательного движения.
- •8. Второй закон Ньютона.
- •10. Импульс и закон сохранения импульса. Центр масс.
- •11. Работа, энергия и мощность.
- •12. Кинетическая и потенциальная энергия.
- •14. Удар (упругий и неупругий).
- •1 6. Кинетическая энергия вращения.
- •17. Момент силы и основное уравнение динамики вращательного движения твердого тела.
- •20. Деформации твердого тела. Закон Гука.
- •21. Законы Кеплера и закон всемирного тяготения.
- •22. Сила тяжести и вес. Невесомость.
- •24. Космические скорости.
- •25. Неинерциальные системы отсчета. Силы инерции при ускоренном поступательном движении. & 26. Силы инерции во вращающейся системе отсчета.
- •27. Столкновения. Упругий и неупругий удар.
- •28. Давление в жидкости и газе. Законы Паскаля и Архимеда.
- •29. Уравнение непрерывности и уравнение Бернулли.
- •3 1. Физический и математический маятники.
- •33. Преобразования Галилея. Механический принцип относительности.
- •34. Постулаты спец теории относительности
- •3 5. Преобразования Лоренца
- •36. Следствие преобразований Лоренца - неодновременность событий в разных системах отсчета
- •37. Длительность событий в разных системах отсчета.
- •38. Длина тел в разных системах отсчета.
- •39. Релятивистский закон сложения скоростей.
- •40. Интервал между событиями
- •41. Основной закон релятивистской динамики материальной точки
- •43. Статистический и термодинамический методы.
- •44. Параметры состояния термодинамической системы
- •45. Модель идеального газа
- •46. Законы Бойля—Мариотта, Гей-Люссака и Шарля
- •47. Закон Авогадро, Закон Дальтона
- •48. Уравнение Клапейрона — Менделеева
- •49.Основное уравнение молекулярно-кинетической теории идеал. Газов
- •50. Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы молекул
- •51. Распределение максвелла по скоростям и энергиям молекул
- •52. Барометрическая формула. Распределение Больцмана
- •53. Опытное обоснование молекулярно-кинетической теории
- •54. Первое начало термодинамики
- •56. Теплоемкость. Уравнением Майера
- •57. Применение первого начала термодинамики к изопроцессам
- •58. Адиабатический процесс. Политропный процесс
- •59. Круговой процесс (цикл). Обратимые и необратимые процессы &
- •6 0. Кпд кругового процесса
- •61. Цикл Карно и его к. П. Д. Для идеального газа
- •62. Энтропия и ее свойства & 64. Статистический смысл энтропии
- •63. Второе начало термодинамики
- •65. Третье начало термодинамики
- •66. Свойства реальных газов. Уравнение Ван-дер-Ваальса
- •67. Эффект Джоуля — Томсона
- •68. Уравнение Бернулли и следствия из него
56. Теплоемкость. Уравнением Майера
Удельная
теплоемкость вещества — величина,
равная количеству теплоты, необходимому
для нагревания 1 кг вещества на 1 К: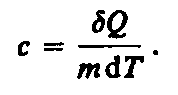
Единила удельной теплоемкости — джоуль на килограмм-кельвин (Дж/(кг К)).
Молярная
теплоемкость—величина, равная
количеству теплоты, необходимому для
нагревания 1 моль вещества на 1 К:
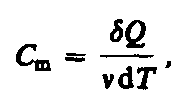 (53.1) где =m/М—количество
вещества.
(53.1) где =m/М—количество
вещества.
Единица молярной теплоемкости — джоуль на моль-кельвин (Дж/(моль К)).
Удельная
теплоемкость с связана с молярной
Сm,
соотношением![]() (53.2)где
М — мол m.
(53.2)где
М — мол m.
Различают теплоемкости при постоянном объеме и постоянном давлении, если в процессе нагревания вещества его объем или давление поддерживается постоянным.
Запишем
выражение первого начала термодинамики
(51.2) для 1 моль газа с учетом формул (52.1)
и (53.1):![]() (53.3)
(53.3)
Если
газ нагревается при постоянном объеме,
то работа внешних сил равна нулю (см.
(52.1)) и сообщаемая газу извне теплота
вдет только на увеличение его внутренней
энергии: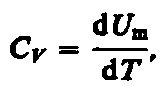 (53.4)
(53.4)
т.
е. молярная теплоемкость газа при
постоянном объеме СV
равна изменению внутренней энергии
1 моль газа при повышении его температуры
на 1 К. Согласно формуле (50.1),
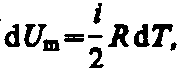 тогда
тогда![]() (53.5)
(53.5)
Если газ нагревается при постоянном давлении, то выражение (53.3) можно записать в виде
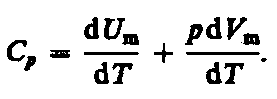
Учитывая,
что
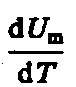 не зависит от вида процесса (внутренняя
энергия идеального газа не зависит ни
от p, ни от V, а
определяется лишь температурой Т)
и всегда равна СV
(см. (53.4)), и дифференцируя уравнение
Клапейрона — Менделеева pVm=RT
(42.4) по T (p=const),
получаем
не зависит от вида процесса (внутренняя
энергия идеального газа не зависит ни
от p, ни от V, а
определяется лишь температурой Т)
и всегда равна СV
(см. (53.4)), и дифференцируя уравнение
Клапейрона — Менделеева pVm=RT
(42.4) по T (p=const),
получаем![]() (53.6)
(53.6)
Выражение
(53.6) называется уравнением Майера;
оно показывает, что Ср
всегда больше СV
на величину молярной газовой постоянной.
Это объясняется тем, что при нагревании
газа при постоянном давлении
требуется еще дополнительное количество
теплоты на совершение работы расширения
газа, так как постоянство давления
обеспечивается увеличением объема
газа. Использовав (53.5), выражение (53.6)
можно записать в виде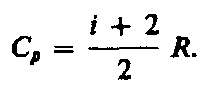 (53.7)
(53.7)
При
рассмотрении термодинамических процессов
важно знать характерное для каждого
газа отношение Сp
к СV :
![]() (53.8)
(53.8)
Из формул (53.5) и (53.7) следует, что молярные теплоемкости определяются лишь числом степеней свободы и не зависят от температуры. Это утверждение молекулярно-кинетической теории справедливо в довольно широком интервале температур лишь для одноатомных газов. Уже у двухатомных газов число степеней свободы, проявляющееся в теплоемкости, зависит от температуры. Молекула двухатомного газа обладает тремя поступательными, двумя вращательными и одной колебательной степенями свободы.
По закону равномерного распределения энергии по степеням свободы (см. § 50), для комнатных температур СV = 7/2 R. Из качественной экспериментальной зависимости молярной теплоемкости СV водорода (рис. 80) следует, что СV зависит от температуры: при низкой температуре (50 К) СV =3/2 R, при комнатной — CV = 5/2R (вместо расчетных 7/2R) и при очень высокой — Сv=7/2 R. Это можно объяснить, предположив, что при низких температурах наблюдается только поступательное движение молекул, при комнатных — добавляется их вращение, а при высоких — к этим двум видам движения добавляются еще колебания молекул.
Расхождение теории и эксперимента нетрудно объяснить. Дело в том, что при вычислении теплоемкости надо учитывать квантование энергии вращения и колебаний молекул (возможны не любые вращательные и колебательные энергии, а лишь определенный дискретный ряд значений энергий). Если энергия теплового движения недостаточна, например, для возбуждения колебаний, то эти колебания не вносят своего вклада в теплоемкость (соответствующая степень свободы «замораживается» — к ней неприменим закон равнораспределения энергии). Этим объясняется, что теплоемкость моля двухатомного газа — водорода — при комнатной температуре равна 5/2 R вместо 7/2R. Аналогично можно объяснить уменьшение теплоемкости при низкой температуре («замораживаются» вращательные степени свободы) и увеличение при высокой («возбуждаются» колебательные степени свободы).
