
- •2. Единицы физических величин.
- •3. Механика. Система отсчета, путь и перемещение.
- •5. Вращательное движение. Угловая скорость и угловое ускорение.
- •6. Взаимосвязи законов поступательного и вращательного движения.
- •8. Второй закон Ньютона.
- •10. Импульс и закон сохранения импульса. Центр масс.
- •11. Работа, энергия и мощность.
- •12. Кинетическая и потенциальная энергия.
- •14. Удар (упругий и неупругий).
- •1 6. Кинетическая энергия вращения.
- •17. Момент силы и основное уравнение динамики вращательного движения твердого тела.
- •20. Деформации твердого тела. Закон Гука.
- •21. Законы Кеплера и закон всемирного тяготения.
- •22. Сила тяжести и вес. Невесомость.
- •24. Космические скорости.
- •25. Неинерциальные системы отсчета. Силы инерции при ускоренном поступательном движении. & 26. Силы инерции во вращающейся системе отсчета.
- •27. Столкновения. Упругий и неупругий удар.
- •28. Давление в жидкости и газе. Законы Паскаля и Архимеда.
- •29. Уравнение непрерывности и уравнение Бернулли.
- •3 1. Физический и математический маятники.
- •33. Преобразования Галилея. Механический принцип относительности.
- •34. Постулаты спец теории относительности
- •3 5. Преобразования Лоренца
- •36. Следствие преобразований Лоренца - неодновременность событий в разных системах отсчета
- •37. Длительность событий в разных системах отсчета.
- •38. Длина тел в разных системах отсчета.
- •39. Релятивистский закон сложения скоростей.
- •40. Интервал между событиями
- •41. Основной закон релятивистской динамики материальной точки
- •43. Статистический и термодинамический методы.
- •44. Параметры состояния термодинамической системы
- •45. Модель идеального газа
- •46. Законы Бойля—Мариотта, Гей-Люссака и Шарля
- •47. Закон Авогадро, Закон Дальтона
- •48. Уравнение Клапейрона — Менделеева
- •49.Основное уравнение молекулярно-кинетической теории идеал. Газов
- •50. Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы молекул
- •51. Распределение максвелла по скоростям и энергиям молекул
- •52. Барометрическая формула. Распределение Больцмана
- •53. Опытное обоснование молекулярно-кинетической теории
- •54. Первое начало термодинамики
- •56. Теплоемкость. Уравнением Майера
- •57. Применение первого начала термодинамики к изопроцессам
- •58. Адиабатический процесс. Политропный процесс
- •59. Круговой процесс (цикл). Обратимые и необратимые процессы &
- •6 0. Кпд кругового процесса
- •61. Цикл Карно и его к. П. Д. Для идеального газа
- •62. Энтропия и ее свойства & 64. Статистический смысл энтропии
- •63. Второе начало термодинамики
- •65. Третье начало термодинамики
- •66. Свойства реальных газов. Уравнение Ван-дер-Ваальса
- •67. Эффект Джоуля — Томсона
- •68. Уравнение Бернулли и следствия из него
49.Основное уравнение молекулярно-кинетической теории идеал. Газов
Д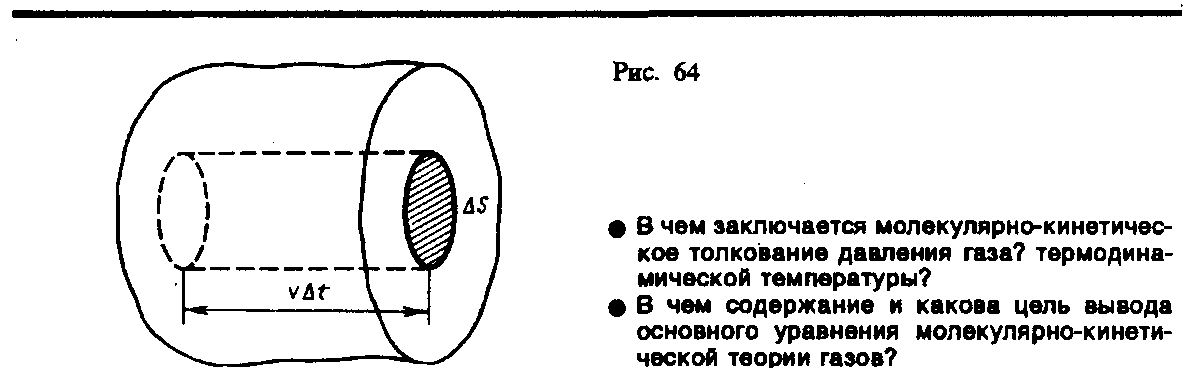 ля
вывода основного уравнения МКТ рассмотрим
одноатомный идеальный газ. Предположим,
что молекулы газа движутся хаотически,
число взаимных столкновений между
молекулами газа пренебрежимо мало по
сравнению с числом ударов о стенки
сосуда, а соударения молекул со стенками
сосуда абсолютно упругие. Выделим на
стенке сосуда некоторую элементарную
площадку S
(рис. 64) и вычислим давление, оказываемое
на эту площадку. При каждом соударении
молекула, движущаяся перпендикулярно
площадке, передает ей импульс m0v
– (– m0v)
= 2m0v,
где m0 - масса
молекулы, v - ее
скорость. За время t
площадки S
достигнут только те молекулы, которые
заключены в объеме цилиндра с основанием
S
и высотой vt
(рис. 64). Число этих молекул равно
nSvt
(n - концентрация
молекул). Необходимо, однако, учитывать,
что реально молекулы движутся к площадке
S
под разными углами и имеют различные
скорости, причем скорость молекул при
каждом соударении меняется. Для упрощения
расчетов хаотическое движение молекул
заменяют движением вдоль трех взаимно
перпендикулярных направлений, так что
в любой момент времени вдоль каждого
из них движется 1/3 молекул,
причем половина молекул 1/6
движется вдоль данного направления в
одну сторону, половина — в противоположную.
Тогда число ударов молекул, движущихся
в заданном направлении, о площадку S
будет 1/6nSvt.
При столкновении с площадкой эти молекулы
передадут ей импульс
ля
вывода основного уравнения МКТ рассмотрим
одноатомный идеальный газ. Предположим,
что молекулы газа движутся хаотически,
число взаимных столкновений между
молекулами газа пренебрежимо мало по
сравнению с числом ударов о стенки
сосуда, а соударения молекул со стенками
сосуда абсолютно упругие. Выделим на
стенке сосуда некоторую элементарную
площадку S
(рис. 64) и вычислим давление, оказываемое
на эту площадку. При каждом соударении
молекула, движущаяся перпендикулярно
площадке, передает ей импульс m0v
– (– m0v)
= 2m0v,
где m0 - масса
молекулы, v - ее
скорость. За время t
площадки S
достигнут только те молекулы, которые
заключены в объеме цилиндра с основанием
S
и высотой vt
(рис. 64). Число этих молекул равно
nSvt
(n - концентрация
молекул). Необходимо, однако, учитывать,
что реально молекулы движутся к площадке
S
под разными углами и имеют различные
скорости, причем скорость молекул при
каждом соударении меняется. Для упрощения
расчетов хаотическое движение молекул
заменяют движением вдоль трех взаимно
перпендикулярных направлений, так что
в любой момент времени вдоль каждого
из них движется 1/3 молекул,
причем половина молекул 1/6
движется вдоль данного направления в
одну сторону, половина — в противоположную.
Тогда число ударов молекул, движущихся
в заданном направлении, о площадку S
будет 1/6nSvt.
При столкновении с площадкой эти молекулы
передадут ей импульс
![]()
Тогда
давление газа, оказываемое им на стенку
сосуда,![]() (43.1)
(43.1)
Если
газ в объеме V содержит N молекул,
движущихся со скоростями v1,
v2, ..., vN,
то целесообразно рассматривать среднюю
квадратную скорость
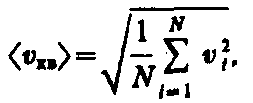 (43.2)
характеризующую всю совокупность
молекул газа. Уравнение (43.1) с учетом
(43.2) примет вид
(43.2)
характеризующую всю совокупность
молекул газа. Уравнение (43.1) с учетом
(43.2) примет вид
![]() (43.3)
(43.3)
Выражение
(43.3) называется основным уравнением
молекулярно-кинетической теории
идеальных газов. Точный расчет с
учетом движения молекул по всевозможным
направлениям дает ту же формулу.
Учитывая, что n =N
/ V,
получим ![]() (43.4)или
(43.4)или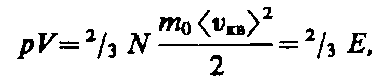 (43.5)
где Е — суммарная кинетическая
энергия поступательного движения всех
молекул газа. Так как масса газа m=Nm0,
то уравнение (43.4) можно переписать в
виде
(43.5)
где Е — суммарная кинетическая
энергия поступательного движения всех
молекул газа. Так как масса газа m=Nm0,
то уравнение (43.4) можно переписать в
виде
![]() Для одного моля газа т=М (М —
молярная масса), поэтому
Для одного моля газа т=М (М —
молярная масса), поэтому
![]() где Vm
— молярный объем. С другой стороны,
по уравнению Клапейрона — Менделеева,
pVm=RT.
Таким образом,
где Vm
— молярный объем. С другой стороны,
по уравнению Клапейрона — Менделеева,
pVm=RT.
Таким образом,![]() откуда
откуда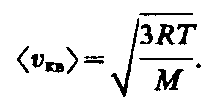 (43.6)
Так как M=m0NА,
где т0 — масса одной
молекулы, a NА
— постоянная Авогадро, то из уравнения
(43.6) следует, что
(43.6)
Так как M=m0NА,
где т0 — масса одной
молекулы, a NА
— постоянная Авогадро, то из уравнения
(43.6) следует, что (43.7) где k=R/NА
— постоянная Больцмана. Отсюда найдем,
что при комнатной температуре молекулы
кислорода имеют среднюю квадратичную
скорость 480 м/с, водорода — 1900 м/с. При
температуре жидк гелия скорости будут
соответственно 40 и 160 м/с.
(43.7) где k=R/NА
— постоянная Больцмана. Отсюда найдем,
что при комнатной температуре молекулы
кислорода имеют среднюю квадратичную
скорость 480 м/с, водорода — 1900 м/с. При
температуре жидк гелия скорости будут
соответственно 40 и 160 м/с.
Средняя кинетическая энергия поступательного движения одной молекулы идеального газа
![]() (43.8)
(43.8)
(использовали формулы (43.5) и (43.7)) пропорциональна термодинамической температуре и зависит только от нее. Из этого уравнения следует, что при Т=0 <0>=0, т. е. при 0К прекращается поступательное движение молекул газа => его давление равно нулю. Итак, термодинамическая температура является мерой средней кинетической энергии поступательного движения молекул идеального газа, и формула (43.8) раскрывает молекулярно-кинетическое толкование температуры.
