
- •2. Единицы физических величин.
- •3. Механика. Система отсчета, путь и перемещение.
- •5. Вращательное движение. Угловая скорость и угловое ускорение.
- •6. Взаимосвязи законов поступательного и вращательного движения.
- •8. Второй закон Ньютона.
- •10. Импульс и закон сохранения импульса. Центр масс.
- •11. Работа, энергия и мощность.
- •12. Кинетическая и потенциальная энергия.
- •14. Удар (упругий и неупругий).
- •1 6. Кинетическая энергия вращения.
- •17. Момент силы и основное уравнение динамики вращательного движения твердого тела.
- •20. Деформации твердого тела. Закон Гука.
- •21. Законы Кеплера и закон всемирного тяготения.
- •22. Сила тяжести и вес. Невесомость.
- •24. Космические скорости.
- •25. Неинерциальные системы отсчета. Силы инерции при ускоренном поступательном движении. & 26. Силы инерции во вращающейся системе отсчета.
- •27. Столкновения. Упругий и неупругий удар.
- •28. Давление в жидкости и газе. Законы Паскаля и Архимеда.
- •29. Уравнение непрерывности и уравнение Бернулли.
- •3 1. Физический и математический маятники.
- •33. Преобразования Галилея. Механический принцип относительности.
- •34. Постулаты спец теории относительности
- •3 5. Преобразования Лоренца
- •36. Следствие преобразований Лоренца - неодновременность событий в разных системах отсчета
- •37. Длительность событий в разных системах отсчета.
- •38. Длина тел в разных системах отсчета.
- •39. Релятивистский закон сложения скоростей.
- •40. Интервал между событиями
- •41. Основной закон релятивистской динамики материальной точки
- •43. Статистический и термодинамический методы.
- •44. Параметры состояния термодинамической системы
- •45. Модель идеального газа
- •46. Законы Бойля—Мариотта, Гей-Люссака и Шарля
- •47. Закон Авогадро, Закон Дальтона
- •48. Уравнение Клапейрона — Менделеева
- •49.Основное уравнение молекулярно-кинетической теории идеал. Газов
- •50. Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы молекул
- •51. Распределение максвелла по скоростям и энергиям молекул
- •52. Барометрическая формула. Распределение Больцмана
- •53. Опытное обоснование молекулярно-кинетической теории
- •54. Первое начало термодинамики
- •56. Теплоемкость. Уравнением Майера
- •57. Применение первого начала термодинамики к изопроцессам
- •58. Адиабатический процесс. Политропный процесс
- •59. Круговой процесс (цикл). Обратимые и необратимые процессы &
- •6 0. Кпд кругового процесса
- •61. Цикл Карно и его к. П. Д. Для идеального газа
- •62. Энтропия и ее свойства & 64. Статистический смысл энтропии
- •63. Второе начало термодинамики
- •65. Третье начало термодинамики
- •66. Свойства реальных газов. Уравнение Ван-дер-Ваальса
- •67. Эффект Джоуля — Томсона
- •68. Уравнение Бернулли и следствия из него
46. Законы Бойля—Мариотта, Гей-Люссака и Шарля
М одель
идеального газа можно использовать при
изучении реальных газов, так как они в
условиях, близких к нормальным (например,
кислород и гелий), а также при низких
давления» и высоких температурах близки
по своим свойствам к идеальному газу.
Кроме того, внеся поправки, учитывающие
собственный объем молекул газа и
действующие молекулярные силы, можно
перейти к теории реальных газов.
одель
идеального газа можно использовать при
изучении реальных газов, так как они в
условиях, близких к нормальным (например,
кислород и гелий), а также при низких
давления» и высоких температурах близки
по своим свойствам к идеальному газу.
Кроме того, внеся поправки, учитывающие
собственный объем молекул газа и
действующие молекулярные силы, можно
перейти к теории реальных газов.
Рис. 2.1 |
Закон
Бойля—Мариотта*: для данной массы
газа при постоянной температуре
произведение давления газа на его объем
есть величина постоянная:
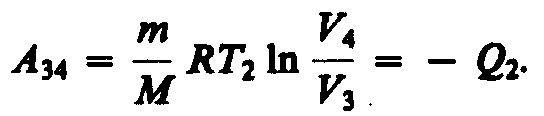
Хорошо известный закон Бойля-Мариотта был установлен английским физиком Бойлем в 1662 г. и независимо от него французским ученым Мариоттом в 1679 г.
Для
данной массы газа m при неизменной
температуре Т произведение давления
на объем есть величина постоянная:
![]()
Процесс, происходящий при постоянной температуре, называется изотермическим. График этого процесса в координатах p – V представлен на рис. 2.1.
З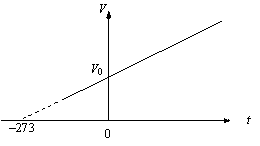 акон,
связывающий объем газа V и
его температуру t,
измеренную в градусах Цельсия, был
установлен французским ученым Гей-Люссаком в
1802 г.
акон,
связывающий объем газа V и
его температуру t,
измеренную в градусах Цельсия, был
установлен французским ученым Гей-Люссаком в
1802 г.
Для
данной массы m при постоянном давлении
р объем газа линейно зависит от
температуры:
![]()
г![]() де V0 –
объем газа при нуле градусов Цельсия,
α – коэффициент объемного расширения, t –
температура по шкале Цельсия.
де V0 –
объем газа при нуле градусов Цельсия,
α – коэффициент объемного расширения, t –
температура по шкале Цельсия.
График этого процесса, называемого изобарическим, представлен на рис. 2.2. Коэффициент α для всех газов равен
Закон, связывающий давление газа р и его температуру t, установлен Шарлем.
|
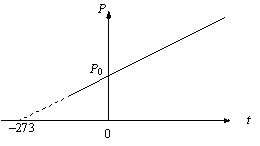 ля
данной массы m при постоянном объеме V
давление газа линейно зависит от
температуры:
ля
данной массы m при постоянном объеме V
давление газа линейно зависит от
температуры:
|
|
где p0 – давление газа при нуле градусов Цельсия, β – коэффициент объемного расширения, t – температура по шкале Цельсия.
График этого процесса, называемого изохорическим представлен на рис. 2.3. Коэффициент β длявсех газов равен
![]()
В координатах Р–V изобарический и изохорический процессы представлены на рис. 2.4.
|
Если бы существовал газ, для которого не было бы отклонений от этих законов, то такой газ был бы идеальным газом.
47. Закон Авогадро, Закон Дальтона
Закон Авогадро*: моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы. При нормальных условиях этот объем равен 22,4110–3 м3/моль.
Согласно
закону Авогадро различные
газы, взятые в количестве 1 моль, имеют
одинаковые объемы при одинаковых
давлениях р и
температурах t, так
как число молекул в них одно и то же. При
нормальных условиях, т. е. при температуре
О °С и атмосферном давлении 101 325 Па, этот
объем, как показывают измерения,
равен
![]() (3.8.1)
Объем VM0 называют
молярным.
(3.8.1)
Объем VM0 называют
молярным.
По
определению, в одном моле различных
веществ содержится одно и то же число
молекул, называемое постоянной
Авогадро:
Закон
Дальтона*: давление смеси идеальных
газов равно сумме парциальных давлений
p1, p2
,..., рn
входящих в нее газов:
![]()
Парциальное давление — давление, которое производил бы газ, входящий в состав газовой смеси, если бы он один занимал объем, равный объему смеси при той же температуре.
Английский химик Д. Дальтон установил, что для достаточно разреженных газов именно так и есть в действительности. Соотношение (3.8.2) называют законом Дальтона.
С точки зрения молекулярно-кинетической теории закон Дальтона выполняется потому, что взаимодействие между молекулами идеального газа пренебрежимо мало. Поэтому каждый газ оказывает на стенку сосуда такое давление, как если бы остальных газов не было.
Моль любого газа при нормальных условиях занимает объем 22,4 л. Это значение объема установлено экспериментально. В смеси газов каждый из них оказывает давление на стенки сосуда независимо от присутствия других газов.

 Рис.
2.4
Рис.
2.4