
- •Глава 6 кислородсодержащие органические соединения
- •6.1. Спирты: определение, изомерия, номенклатура
- •6.1.1. Способы получения
- •6.1.2 Физические свойства спиртов
- •6.1.3. Химические свойства
- •6.1.4 Понятие о непредельных и многоатомных спиртах
- •6.2. Фенолы: определение, изомерия, номенклатура
- •16.2.1. Способы получения
- •6.2.2. Химические свойства
- •6.3. Простые эфиры: определение, изомерия, номенклатура
- •6.3.1. Способы получения
- •6.3.2. Химические свойства
- •6.3.3. Окись этилена (эпоксисоединения)
- •6.4. Оксосоединения (альдегиды и кетоны)
- •6.4.1. Определение, изомерия и номенклатура оксосоединений
- •6.4.2. Способы получения
- •6.4.3. Химические свойства
- •6.4.4. Понятие о непредельных альдегидах и кетонах
- •6.4.5. Особенности получения и химические свойства хинонов
- •Задачи для самопроверки
- •6.5. Одно и многоосновные карбоновые кислоты и их производные: определение, изомерия, номенклатура
- •6.5.1. Способы получения
- •6.5.2. Химические свойства
- •6.5.3. Особенности предельных и непредельных кислот
- •Задачи для самопроверки
Глава 6 кислородсодержащие органические соединения
6.1. Спирты: определение, изомерия, номенклатура
Спиртами называют производные углеводородов, содержащие группу –ОН, называемую гидроксильной группой или гидроксилом.
По числу гидроксильных групп, содержащихся в молекуле, спирты делятся на одноатомные, двухатомные, трехатомные и т.д.
Предельные одноатомные спирты
Предельные одноатомные спирты имеют общую формулу R–OH. В зависимости от того, при каком углеводородном атоме находится гидроксил, различают первичные, вторичные и третичные спирты:
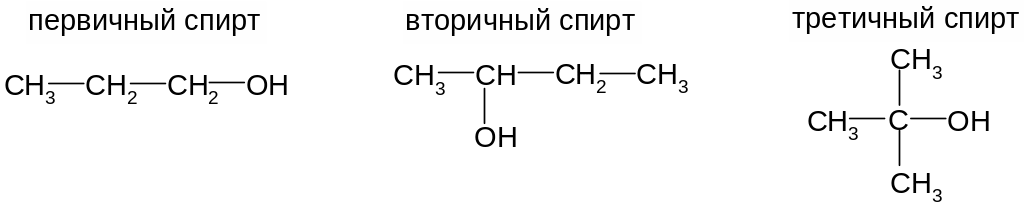
1-пропанол 2-бутанол 2-метил-2-пропанол
Изомерия одноатомных предельных спиртов определяется строением углеродного скелета и положением гидроксильной группы в цепи.
В номенклатуре ИЮПАК наличие гидроксильной группы обозначается суффиксом «ол» с указанием ее положения в цепи цифрой. При нумерации цепи гидроксил имеет предпочтение перед радикалом, кратной и тройной связью, галогеном.
Простейшие спирты называют по наименованию радикалов, с которым соединена гидроксильная группа:

изопропиловый спирт трет-бутиловый спирт изоамиловый спирт
В рациональной номенклатуре спирты называют, как производные простейшего спирта CH3─OH – карбинола

1-пропанол (этилкарбинол) 2-бутанол ( метилэтилкарбинол)
6.1.1. Способы получения
Существует много способов получения спиртов. Здесь приведены простейшие из них.
1) Гидролиз галогеналкилов при нагревании с водой или водным раствором щелочи позволяет получить спирты различного строения. Легче всего гидролизуются йодпроизводные, труднее всего – фторпроизводные. Атомы галогена, связанные с третичным углеродом, гидролизуются значительно легче, чем при вторичном и первичном атоме углерода:

2) Гидратация алкенов (высокое давление и температура, катализатор) позволяет получать помимо этанола вторичные и третичные спирты:
![]()
этилен этиловый спирт
3) Восстановление альдегидов и сложных эфиров в присутствии катализаторов приводит к образованию первичных спиртов, а кетонов – вторичных спиртов (катализатор никель):

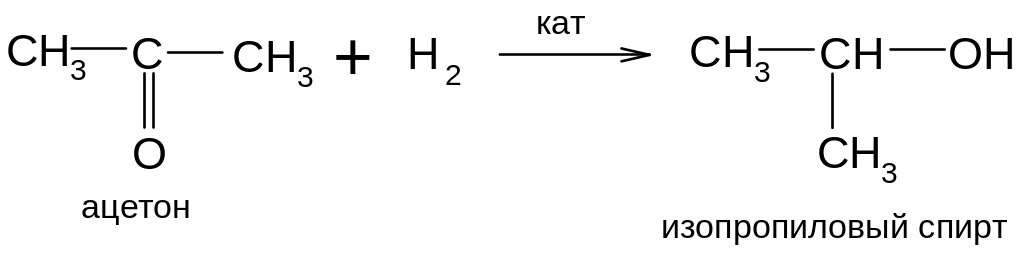
4) Действие металлорганических соединений на альдегиды и кетоны используется для получения спиртов в лабораторной практике:

5) Ферментативное сбраживание углеводов
Глюкозосодержащий раствор под влиянием ферментов дрожжей превращается в бражку, содержащую до 10% этанола, который отгоняют и очищают. Попутно с этанолом образуются первичные амиловый, бутиловый и пропиловый спирты. Смесь этих спиртов называется сивушным маслом.
C6H12O6
![]() 2C2H5OH
+ 2CO2
2C2H5OH
+ 2CO2
6.1.2 Физические свойства спиртов
Спирты по некоторым физическим свойствам резко отличаются от соответствующих им углеводородов. Спирты менее летучи, имеют более высокие температуры плавления и кипения, лучше растворяются в воде, чем соответствующие углеводороды. Разница в свойствах уменьшается с увеличением молярной массы. Разница в физических свойствах связана с высокой полярностью ОН- группы, которая приводит к ассоциации молекул спирта за счет возникновения водородной связи:
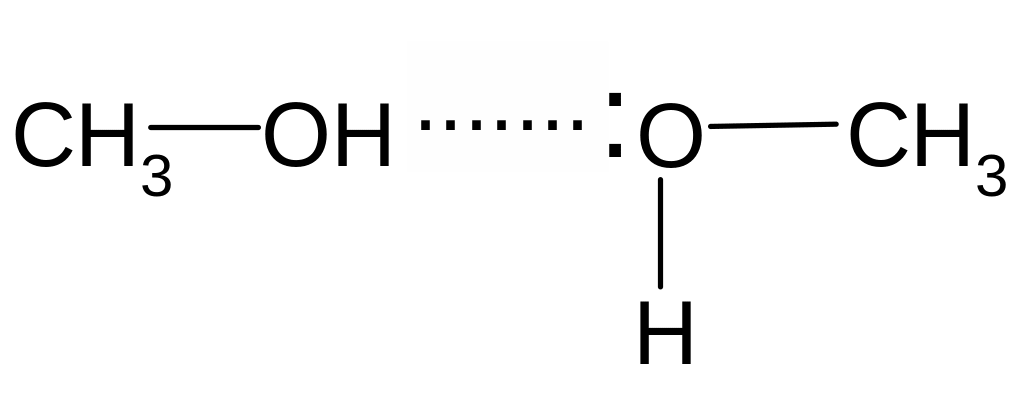
Энергия водородной связи 4-33 кДж/моль
Для спиртов характерно поглощение в инфракрасной области около 2,8 мкм (3600см-1) – валентные колебания неассоциированного гидроксила и около 3,1 мкм (3200 см-1) – аналогичные колебания ассоциированного гидроксила.
