
- •1/Регрессивная гипотеза
- •2/Гипотеза клеточного происхождения
- •3/Гипотеза коэволюции
- •1. Кольцевая двухцепочечная днк длиной около 5 тпн.
- •2. Кольцевая одноцепочечная днк длиной около 5 тн; может быть как кодирующей, так и антикодирующей.
- •3. Линейная двухцепочечная днк длиной 30-150 тпн.
- •4. Линейная одноцепочечная днк длиной около 5 тн; днк может быть как кодирующей, так и антикодирующей.
- •5. Двухцепочечная днк, замкнутая в кольцо из перекрывающихся сегментов. Длина днк – 3-8 тн.
- •7.Класс VII: вирусы, содержащие двуцепочечную днк, реплицирующиеся через стадию одноцепочечной рнк
- •17. Вирусы играют важную роль в жизни человека, так как могут вызывать заболевания различной степени тяжести.
- •1. Присоединение к клеточной мембране
- •2. Проникновение в клетку.
1. Присоединение к клеточной мембране
2. Проникновение в клетку.
3. Перепрограммирование клетки. При заражении вирусом в клетке активируются специальные механизмы противовирусной защиты. Заражённые клетки начинают синтезировать сигнальные молекулы — интерфероны, переводящие окружающие здоровые клетки в противовирусное состояние и активирующие системы иммунитета. Повреждения, вызываемые размножением вируса в клетке, могут быть обнаружены системами внутреннего клеточного контроля, и такая клетка должна будет «покончить жизнь самоубийством» в ходе процесса, называемого апоптозом или программируемой клеточной смерти. От способности вируса преодолевать системы противовирусной защиты напрямую зависит его выживание. Неудивительно, что многие вирусы (например, пикорнавирусы, флавивирусы) в ходе эволюции приобрели способность подавлять синтез интерферонов, апоптозную программу и так далее. Кроме подавления противовирусной защиты, вирусы стремятся создать в клетке максимально благоприятные условия для развития своего потомства. Хрестоматийным примером перепрограммирования систем клетки-хозяина является трансляция РНК энтеровирусов (семейство пикорнавирусы). Вирусная протеаза расщепляет клеточный белок eIF4G, необходимый для инициации трансляции подавляющего большинства клеточных мРНК (транслирующихся по так называемому кэп-зависимому механизму). При этом инициация трансляции РНК самого вируса происходит другим способом (IRES-зависимый механизм), для которого вполне достаточно отрезанного фрагмента eIF4G. Таким образом, вирусные РНК приобретают эксклюзивные «права» и не конкурируют за рибосомы с клеточными.
4. Персистенция 5. Создание новых вирусных компонентов.6. Созревание вирионов и выход из клетки25. В общем виде зрелая вирусная частица (вирион) состоит из нуклеиновой кислоты, белков и липидов – сложные вирусы (одетые), либо в его состав входят только нуклеиновые кислоты и белки - простые вирусы (голые). Вирусы содержат только один вид нуклеиновой кислоты — либо ДНК, либо РНК. Вирусные нуклеиновые кислоты бывают одно- и двухцепочечными, а вирусный геном может состоять из одной или нескольких молекул нуклеиновой кислоты, и если он состоит из одной молекулы, она может быть линейной или кольцевой. Белок, основная роль которого состоит в формировании защитного чехла для нуклеиновой кислоты. Исходя из того что количество генетической информации у вирусов ограничено, Крик и Уотсон (1956) предположили, что белковые чехлы простых вирусов состоят из повторяющихся субъединиц. Иногда вирусный белок представлен полипептидом одного типа, но чаще их два или три. Белки на поверхности вириона имеют особое сродство к комплементарным рецепторам на поверхности чувствительных клеток.Липиды обнаружены у сложно организованных вирусов и в основном находятся в составе липопротеиднои оболочки (суперкапсида), формируя ее липидной бислой, в который вставлены суперкапсидные белки.
Все сложно организованные РНК-содержащие вирусы имеют в своем составе значительное количество липидов (от 15 до 35% от сухого веса). Из ДНК-содержащих вирусов липиды содержат вирусы оспы, герпеса и гепатита В. Примерно 50—60% липидов в составе вирусов представлено фосфолипидами, 20—30% составляет холестерин.Липидный компонент стабилизирует структуру вирусной частицы.Углеводный компонент вирусов находится в составе гликопротеидов. Количество Сахаров в составе гликопротеидов может быть достаточно большим, достигая 10—13% от массы вириона. Химическая специфичность их полностью определяется клеточными ферментами, обеспечивающими перенос и присоединение соответствующих сахарных остатков. Обычными сахарными остатками, обнаруживаемыми в вирусных белках, являются фруктоза, сахароза, манноза, галактоза, нейраминовая кислота, глюкозамин. Таким образом, подобно липидам, углеводный компонент определяется клеткой-хозяином, благодаря чему один и тот же вирус, возращенный в клетках разных видов, может значительно различаться по составу сахаров
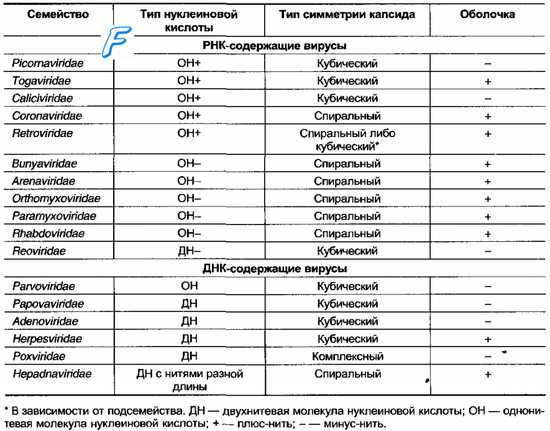
21. ТОГАВИРУСЫ (Togaviridae: от лат. toga — плащ) - семейство РНК-содержащих сферических вирусов из группы арбовирусов.
Особенности семейства тогавирусов
Вирусы содержат однонитчатую РНК линейной формы, которая является инфекционной. Вирионы диаметром 50—70 нм (альфавирусы), 40—50 нм (флавивирусы), 70 нм (рубивирусы), 40 нм (пестивирусы). Для капсида альфавирусов свойствен икосаэдральный тип симметрии.
Сборка вирионов происходит в цитоплазме клеток на мембранных структурах. У флавивирусов в составе вириона имеются 3 структурных белка, у альфавирусов 2—3. При репликации в клетках вирусы обоих родов индуцируют образование РНК-зависимой РНК-полимеразы. Вирусы чувствительны к действию жирорастворителей. Альфа- и флавивирусы способны к репликации как в клетках позвоночных животных, так и членистоногих. Переносчики (комары, москиты, мокрецы, клещи) осуществляют не только биологическую трансмиссию этих вирусов, но могут быть и их резервуаром в природных очагах. Для рубивирусов и пестивирусов беспозвоночные не являются хозяевами.
Классификация
Семейство тогавирусов (Togaviridae) представляет группу оболочечных вирусов с позитивно-полярным геномом и подразделяется на три рода: Alphavirus (возбудители лихорадок с трансмиссивным путем передачи и энцефалитов), Rubivirus (вирус краснухи) и Pestivirus (возбудители заболеваний слизистых оболочек животных).
Альфавирусы
Род альфавирусов (арбовирусы группы А) включает 21 антигенно обособленный вирус, среди которых есть патогенные для человека виды.
Патогенез заболеваний человека. После укуса кровососущего насекомого вирус попадает в кровяное русло. Первичная репродукция возбудителя происходит вне нервной ткани, например в эндотелиальных клетках кровеносных сосудов, лимфатических узлах. Далее вирусы вновь поступают в кровь, вызывая вирусемию. Во второй фазе патогенеза они заносятся в различные участки ЦНС, печень, селезенку, почки. Разрушение нервных клеток приводит к тяжелым формам энцефалитов. Альфавирусы могут вызывать также различные заболевания, сопровождающиеся лихорадкой, высыпаниями на кожных покровах, иногда с развитием артритов, кровотечений.
Рубивирусы (Rubivirus) — род РНК-содержащих вирусов семейства тогавирусов, к которому относится патогенный для человека вирус краснухи.
Краснуха — острое инфекционное вирусное заболевание, характеризующееся умеренной интоксикацией и лихорадкой, мелкопятнистой экзантемой и генерализованной лимфоаденопатией.
Патогенез заболеваний человека. После заражения вирус попадает в лимфатические клетки шейных, затылочных и заушных желез, в которых начинается его первичная репродукция. Железы увеличиваются в размерах и становятся болезненными при пальпации. Затем вирус проникает в лимфу и кровь, где он обнаруживается за 3—4 дня до появления клинических симптомов заболевания. Вирусемия быстро прекращается после появления сыпи.
Заболевание протекает с лихорадкой; сыпью, поражением верхних дыхательных путей, болями в суставах, мышцах.
Пестивирусы (pestivirus; лат. pestis зараза, повальная болезнь + вирусы) – род вирусов сем. тогавирусов; патогенность для человека не установлена. Род пестивирусы включает 4 вируса. Кроме вируса классической чумы свиней (КЧС), в него входят еще три вируса, представляющих 6 антигенных групп: 2 вируса диареи КРС (BVDV-1 и BVDV-2), 3 вируса пограничной болезни овец (BDV-1, BDV-2, BDV-3), и одну антигенную группу представляет штамм H138, выделенный от жирафа в Кении. Прототипным вирусом рода является вирус диареи КРС 1 (штамм Орегон C24V).
22. Белковые компоненты вирусов
Сложные белки представлены гликопротеинами (обозначают как gp) и липопротеинами. Наличие гликопротеина определяет присутствие в вирионе углеводного компонента, который может быть представлен олигосахаридами маннозного типа, галактозой, N-ацетилглюкозамином или нейраминовой кислотой. Вирусные гликопротеины, как правило, экспонированы на наружной поверхности ВЧ и выполняют три основные функции: обеспечивают связывание вириона с клеточным рецептором (функция прикрепительного белка), обладают фузионной активностью (обеспечивают слияние мембран) и определяют антигенные свойства вирусов. В то же время, вирусные гликопротеины могут быть и неструктурными белками и, оставаясь в интегральной форме в мембране шероховатого эндоплазматического ретикулюма (ШЭР), выполнять функции транслоказ, обеспечивая транспорт вирусных компонентов в его просвет.
Вирусные липопротеины представлены белками, ацилированными, как правило, миристиновой (C ) кислотой. Остатки жирных кислот, соединенные с молекулой белка, выполняют функцию липофильного якоря.
Вирусные белки-ферменты могут входить в состав вирусной частицы или являться неструктурными белками и появляться в клетке после экспрессии вирусного генома. Функционально активные белки вирусов представлены, в первую очередь, ферментами нуклеинового обмена, обеспечивающими сложные механизмы репликации/транскрипции вирусного генома; ферментами, осуществляющими посттрансляционный процессинг и модификацию белков, и ферментами, участвующими в проникновении вирионов в клетку хозяина.
ДНК-зависимая ДНК-полимераза — осуществляет синтез ДНК на матрице ДНК (вирус оспы).
ДНК-зависимая РНК-полимераза — осуществляет синтез мРНК на матрице ДНК (вирус оспы).
РНК-зависимая РНК-полимераза — осуществляет синтез РНК на матрице РНК. Выполняет функции транскриптазы и репликазы. Впервые обнаружена в 1970 г. Балтимором у вируса везикулярного стоматита. Входит в состав вирионов или является NS-белком РНК-содержащих вирусов.
Обратная транскриптаза или ревертаза или РНК-зависимая ДНК-полимераза осуществляет синтез ДНК на матрице РНК. Впервые открыта в 1970 г. у ретровирусов Темином и Мизутани.
Хеликаза — осуществляет расплетете двухнитевой структуры ДНК. Кроме этого хеликазы обладают нуклеотидтрифосфат-зависимой РНК-хеликазной активностью, которая включает три процесса: связывание дезоксинуклеотидтрифосфата, его гидролиз и за счет этой энергии расплетение двухнитевой РНК.
мРНК-модифицирующие ферменты: поли-А-полимераза — аденилирует 3'-конец РНК за счет энергии АТФ; Кэп-энзим и метилтрансферазный комплекс — катализирует образование на 5'-конце кэп-структуры.
АТФ-аза, ГТФ-аза — осуществляют гидролиз соответствующих энергетических субстратов.
Рибонуклеаза Н — разрушает РНК, находящуюся в дуплексе с ДНК. Вторая группа вирусных ферментов — ферменты белкового обмена.
Здесь мы приведем лишь некоторые из них:
Протеиназы — ферменты, участвующие в посттрансляционном процессинге полипротеинов. Являются NS-белками РНК-содержащих вирусов; Протеинкиназы — ферменты, фосфорилирующие структурные белки вирионов. Обнаружены в составе вируса везикулярного стоматита, вируса бешенства, альфавирусов и ретровирусов. Примерами ферментов, участвующих в проникновении вирусов в клетку, являются лизоцим бактериофагов и нейраминидаза вируса гриппа.
23. Бактериофаги – (от бактерии и греч. fagos – пожиратель; синоним: фаг, бактериальный вирус)- вирус, поражающий бактерии.
Фаговая (лизогенная) конверсия - изменение свойств бактериальной клетки вследствие заражения её умеренным бактериофагом. Фаговая конверсия связана с добавлением к бактериальному геному новой генетической информации, которая вносится в клетку бактерии геномом фага. В отличие от трансдукции, при фаговой конверсии изменение свойств бактерии сохраняется только до тех пор, пока в клетке присутствует фаг или профаг. Фаговая конверсия может быть причиной подавления или усиления ферментативной активности, изменения патогенных свойств, морфологии колоний, устойчивости к антибиотикам и др.
Фаговая трансдукция
При изучении бактериофагов было открыто явление, получившее название трансдукция.
Трансдукция (от лат. transductio — перемещение) — процесс переноса бактериальной ДНК из одной клетки в другую бактериофагом.
Различают два типа трансдукции:
1. специфическая
2. неспецифическая (общая).
Неспецифическая (общая) трансдукция:
Осуществляется фагом P1, существующим в бактериальной клетке в виде плазмиды, фагами P22 и Mu, встраивающимися в любой участок бактериальной хромосомы. После индуцирования профага с вероятностью в 10−5 на одну клетку возможна ошибочная упаковка фрагмента ДНК бактерии в капсид фага, ДНК самого фага в нём в этом случае нет. Длина этого фрагмента равна длине нормальной фаговой ДНК, его происхождение может быть любым: случайный участок хромосомы, плазмида, другие умеренные фаги.
Попадая в другую бактериальную клетку, фрагмент ДНК может включаться в её геном, обычно путём гомологичной рекомбинации.
Перенесённые фагом плазмиды способны замыкаться в кольцо и реплицироваться уже в новой клетке. В ряде случае фрагмент ДНК не встраивается в хромосому реципиента, не реплицируется, но сохраняется в клетке и транскрибируется. Это явление носит название абортивной трансдукции.
Специфическая трансдукция:
--Наиболее хорошо изучена специфическая трансдукция на примере фага λ. Этот фаг встраивается только в один участок (att-сайт) хромосомы E. coli с определённой последовательностью нуклеотидов (гомологичной att-участку в ДНК фага). Во время индукции его исключение может пройти с ошибкой (вероятность 10−3—10−5 на клетку): вырезается фрагмент тех же размеров что и ДНК фага, но с началом не в том месте. При этом часть генов фага теряется, а часть генов E. coli захватывается им.
--Для каждого специфически встраивающегося в хромосому умеренного фага характерен свой att-сайт и, соответственно, расположенные рядом с ним гены, которые он способен передавать. Ряд фагов может встраиваться в любое место на хромосоме и переносить любые гены по механизму специфической трансдукции.
--Когда умеренный фаг, несущий бактериальные гены, встраивается в хромосому новой бактерии-хозяина, она содержит уже два одинаковых гена — собственный и принесённый извне. Поскольку фаг лишён части собственных генов, часто он не может индуцироваться и размножиться. Однако при заражении этой же клетки «вспомогательным» фагом того же вида, индуцирование дефектного фага становится возможным. Из хромосомы выходят и реплицируются как ДНК нормального «вспомогательного» фага, так и ДНК дефектного, вместе с переносимыми им бактериальными генами.
24. Классификация вирусов
Установлено, что все изученные организмы поражаются вирусами. Множество различных вирусов вызывают заболевания или латентно инфицируют позвоночных и беспозвоночных животных, а также простейших, растения, грибы и бактерии. Известно более 4000 разных вирусов, из которых несколько сотен инфицируют людей и животных.
Классификация ICTV:Международным Комитетом по Таксономии Вирусов в 1966 году была принята система классификации вирусов основанная на различии типа (РНК и ДНК), количества молекул нуклеотических кислот (одно- и двух-цепочечные) и на наличии или отсутствии оболочки ядра. Система классификации представляет собой серию иерархичных таксонов:Отряд (-virales) Семейство (-viridae) Подсемейство (-virinae) Род (-virus) Вид (-virus)
Классификация вирусов по Балтимору:
Нобелевский лауреат, биолог Дэвид Балтимор, предложил свою схему классификации вирусов, основываясь на различиях в механизме продукции мРНК. Эта система включает в себя семь основных групп:
--(I) Вирусы, содержащие двуцепочечную ДНК и не имеющие РНК-стадии (например, герпесвирусы, поксвирусы, паповавирусы, мимивирус).
--(II) Вирусы, содержащие двуцепочечную РНК (например, ротавирусы).
--(III) Вирусы, содержащие одноцепочечную молекулу ДНК (например, парвовирусы).
--(IV) Вирусы, содержащие одноцепочечную молекулу РНК положительной полярности (например, пикорнавирусы, флавивирусы).
--(V) Вирусы, содержащие одноцепочечную молекулу РНК негативной или двойной полярности (например, ортомиксовирусы, филовирусы).
--(VI) Вирусы, содержащие одноцепочечную молекулу РНК и имеющие в своем жизненном цикле стадию синтеза ДНК на матрице РНК, ретровирусы (например, ВИЧ).
--(VII) Вирусы, содержащие двуцепочечную ДНК и имеющие в своём жизненном цикле стадию синтеза ДНК на матрице РНК, ретроидные вирусы (например, вирус гепатита B).
--В настоящее время, для классификации вирусов используются обе системы одновременно, как дополняющие друг друга.
Современная классификация:
Современная классификация вирусов является универсальной для вирусов позвоночных, беспозвоночных, растений и простейших. Она основана на фундаментальных свойствах вирионов, из которых ведущими являются признаки, характеризующие нуклеиновую кислоту, морфологию, стратегию генома и антигенные свойства. Фундаментальные свойства поставлены на первое место, поскольку вирусы со сходными антигенными свойствами обладают и сходным типом нуклеиновой кислоты, сходными морфологическими и биофизическими свойствами.
Важным признаком для классификации, который учитывается наряду со структурными признаками, является стратегия вирусного генома, под которой понимают используемый вирусом способ репродукции, обусловленный особенностями его генетического материала.
В основу современной классификации положены следующие основные критерии:
--Тип нуклеиновой кислоты (РНК или ДНК), ее структура (количество нитей).
--Наличие липопротеидной оболочки.
--Стратегия вирусного генома.
--Размер и морфология вириона, тип симметрии, число капсомеров.
--Феномены генетических, взаимодействий.
--Круг восприимчивых хозяев.
--Патогенность, в том числе патологические изменения в клетках и образование внутриклеточных включений.
--Географическое распространение.
--Способ передачи.
--Антигенные свойства.
Вирусы человека и животных:
Современная классификация вирусов человека и позвоночных животных охватывает более 4/5 известных вирусов, которые распределены на 17 семейств; из них 6 - ДНК-геномные вирусы и 11 - РНК-геномные вирусы.
25. В общем виде зрелая вирусная частица (вирион) состоит из нуклеиновой кислоты, белков и липидов – сложные вирусы (одетые), либо в его состав входят только нуклеиновые кислоты и белки - простые вирусы (голые).
Вирусы содержат только один вид нуклеиновой кислоты — либо ДНК, либо РНК. Вирусные нуклеиновые кислоты бывают одно- и двухцепочечными, а вирусный геном может состоять из одной или нескольких молекул нуклеиновой кислоты, и если он состоит из одной молекулы, она может быть линейной или кольцевой.
Белок, основная роль которого состоит в формировании защитного чехла для нуклеиновой кислоты. Исходя из того что количество генетической информации у вирусов ограничено, Крик и Уотсон (1956) предположили, что белковые чехлы простых вирусов состоят из повторяющихся субъединиц. Иногда вирусный белок представлен полипептидом одного типа, но чаще их два или три. Белки на поверхности вириона имеют особое сродство к комплементарным рецепторам на поверхности чувствительных клеток.
Липиды обнаружены у сложно организованных вирусов и в основном находятся в составе липопротеиднои оболочки (суперкапсида), формируя ее липидной бислой, в который вставлены суперкапсидные белки.
Все сложно организованные РНК-содержащие вирусы имеют в своем составе значительное количество липидов (от 15 до 35% от сухого веса). Из ДНК-содержащих вирусов липиды содержат вирусы оспы, герпеса и гепатита В. Примерно 50—60% липидов в составе вирусов представлено фосфолипидами, 20—30% составляет холестерин.
Липидный компонент стабилизирует структуру вирусной частицы.
Углеводный компонент вирусов находится в составе гликопротеидов. Количество Сахаров в составе гликопротеидов может быть достаточно большим, достигая 10—13% от массы вириона. Химическая специфичность их полностью определяется клеточными ферментами, обеспечивающими перенос и присоединение соответствующих сахарных остатков. Обычными сахарными остатками, обнаруживаемыми в вирусных белках, являются фруктоза, сахароза, манноза, галактоза, нейраминовая кислота, глюкозамин. Таким образом, подобно липидам, углеводный компонент определяется клеткой-хозяином, благодаря чему один и тот же вирус, возращенный в клетках разных видов, может значительно различаться по составу сахаров.
26. Генетическую информацию, закодированную в отдельном гене, можно рассматривать как инструкцию по производству определенного белка в клетке. Такая инструкция воспринимается клеткой если она послана в виде мРНК. клетки, у которых генетический материал представлен ДНК, должны «переписать» эту информацию в комплементарную копию мРНК . Первый этап репликации вирусов связан с проникновением вирусной нуклеиновой кислоты в клетку организма-хозяина. Этому процессу способствовать специальные ферменты, входящие в состав капсида или внешней оболочки вириона, причем оболочка остается снаружи клетки или вирион теряет ее сразу после проникновения внутрь клетки. Вирус находит подходящую для его размножения клетку, контактируя отдельными участками своего капсида со специфическими рецепторами на поверхности клетки по типу «ключ – замок». Если специфические («узнающие») рецепторы на поверхности клетки отсутствуют, то клетка не чувствительна к вирусной инфекции: вирус в нее не проникает. Для того чтобы реализовать свою генетическую информацию, проникшая в клетку вирусная ДНК транскрибируется специальными ферментами в мРНК. Образовавшаяся мРНК перемещается к клеточным «фабрикам» синтеза белка – рибосомам, где она заменяет клеточные «послания» собственными «инструкциями» и транслируется (прочитывается), в результате чего синтезируются вирусные белки. Сама же вирусная ДНК многократно удваивается (дуплицируется) при участии другого набора ферментов, как вирусных, так и принадлежащих клетке.
Синтезированный белок, который используется для строительства капсида, и размноженная во многих копиях вирусная ДНК объединяются и формируют новые, «дочерние» вирионы. Сформированное вирусное потомство покидает использованную клетку и заражает новые: цикл репродукции вируса повторяется.
Стадии репликации вирусов:
1. Присоединение к клеточной мембране —адсорбция. для того, чтобы вирион адсорбировался на поверхности клетки, она должна иметь в составе своей плазматической мембраны белок (часто гликопротеин) — рецептор, специфичный для данного вируса. Наличие рецептора нередко определяет круг хозяев.
2. Проникновение в клетку. На следующем этапе вирусу необходимо доставить внутрь клетки свою генетическую информацию.
3. Перепрограммирование клетки. При заражении вирусом в клетке активируются специальные механизмы противовирусной защиты. Заражённые клетки начинают синтезировать сигнальные молекулы — интерфероны, переводящие окружающие здоровые клетки в противовирусное состояние и активирующие системы иммунитета. Повреждения, вызываемые размножением вируса в клетке, могут быть обнаружены системами внутреннего клеточного контроля, и такая клетка должна будет «покончить жизнь самоубийством» в ходе процесса, называемого апоптозом. От способности вируса преодолевать системы противовирусной защиты напрямую зависит его выживание.
4. Персистенция. Некоторые вирусы могут переходить в латентное состояние, слабо вмешиваясь в процессы, происходящие в клетке, и активироваться лишь при определённых условиях.
5. Создание новых вирусных компонентов. Размножение вирусов в самом общем случае предусматривает три процесса — 1) транскрипция вирусного генома — то есть синтез вирусной мРНК, 2) её трансляция, то есть синтез вирусных белков и 3) репликация вирусного генома. У многих вирусов существуют системы контроля, обеспечивающие оптимальное расходование биоматериалов клетки-хозяина.
6. Созревание вирионов и выход из клетки., новосинтезированные геномные РНК или ДНК одеваются соответствующими белками и выходят из клетки.
27. Рабдовирусы – семейство вирусов, содержащих несегментированную одноцепочечную молекулу РНК линейной формы. Вызывают инфекционные заболевания у позвоночных, беспозвоночных и растений.Вирусы, поражающие животных, пулевидны, а растения - бациловидны. Нуклеокапсид двухнитевой, спиральный, в липопротеидной оболочке.Вирус чувствителен к действию жирорастворителей, кислот, тепла. Рабдовирусы включают 2 рода - везикуловирусы и лиссавирусы. К первым относятся вирусы группы везикулярного стоматита , ко вторым - вирусы группы бешенства . В семейство рабдовирусов также входят вирусы эфемерной лихорадки.Везикулярный стоматит представляет собой вирусную болезнь животных , иногда поражающую и человека и проявляющуюся как острая самокупирующаяся гриппоподобная инфекция. Вирионы имеют пулевидную форму. Внешняя оболочка образована липидным бислоем.Вирус везикулярного стоматита передается комарами. Вирус размножается в организме насекомых.Род Lyssavirus включает вирус бешенства и бешенствоподобные вирусы (Мокола, Дувенхаге — патогенны для человека и животных;). Бешенство- инфекционная болезнь вирусной этиологии. Характеризуется поражением центральной нервной системы, приводит к смертельному исходу. Люди заражаются при укусе, ослюнении, царапинах. Инкубационный период составляет от 10 дней до 3—4 (но чаще 1—3) месяцевВыделяют 3 периода заболевания: 1. период предвестников Длится 1—3 дня. Сопровождается повышением температуры до 37,2—37,3 °C, угнетённым состоянием, плохим сном, болью на месте укуса.2. Стадия разгара (гидрофобия) Длится 1—4 дня. Выражается в резко повышенной чувствительности к малейшим раздражениям органов чувств, шум вызывают судороги мышц конечностей, Больные становятся агрессивными.3. Период параличей (стадия «зловещего успокоения»)Наступает паралич глазных мышц, нижних конечностей продолжительность 5-8 дней.Репликация рабдовирусов происходит в цитоплазме зараженных клеток и может осуществляться даже в клетках, лишенных ядра.Репликация РНК обеспечивается ферментативной активностью L + NS-белков и протекает с образованием плюс-нити и репликативного предшественника. Существуют механизмы регуляции синтеза, в результате которых минус-нити РНК образуются во много раз чаще, нежели плюс-нити, а разные белки синтезируются в различных количествах. В ходе синтеза РНК образуются разные классы DI-частиц. Сборка нуклеокапсидов происходит в цитоплазме, а вирионы формируются на клеточных мембранах, выходя из клетки посредством почкования.
28. В нуклеокапсиде взаимодействие нуклеиновой кислоты и белка осуществляется по одной оси вращения. Каждый вирус со спиральной симметрией обладает характерной длиной, шириной и периодичностью нуклеокапсида. Нуклеокапсиды большинства патогенных для человека вирусов имеют спиральную симметрию (например, коронавирусы, рабдовирусы, пара- и ортомиксовирусы, буньявирусы и ареновирусы). К этой группе относят и вирус табачной мозаики. Организация по принципу спиральной симметрии придаёт вирусам палочковидную форму. При спиральной симметрии белковый чехол лучше защищает наследственную информацию, но требует большого количества белка, так как покрытие состоит из сравнительно крупных блоков.
вирус табачной мозаики был первым вирусом, выделенным в чистом виде. При заражении этим вирусом на листьях больного растения появляются желтые крапинки — так называемая мозаика листьев. Вирусы распространяются очень быстро либо механически, когда больные растения или его части приходят в соприкосновение со здоровыми растениям, либо воздушным путем с дымом от сигарет, для изготовления которых были использованы зараженные листья.
29. Синдром приобретённого иммунного дефицита (СПИД) — состояние, развивающееся на фоне ВИЧ-инфекции и характеризующееся падением числа лимфоцитов, множественными оппортунистическими инфекциями, неинфекционными и опухолевыми заболеваниями. СПИД является терминальной стадией ВИЧ-инфекции.До настоящего времени не создано вакцины против ВИЧ, лечение ВИЧ-инфекции значительно замедляет течение болезни, однако известен только единичный случай полного излечения болезни в результате пересадки модифицированных стволовых клеток. Пути передачи ВИЧ-инфекции:1. Половой 2. Инъекционный и инструментальный — при использовании загрязнённых вирусом шприцев, игл, катетеров3. Гемотрансфузионный (после переливания инфицированной крови или её компонентов — плазмы, тромбоцитарной, лейкоцитарной ); 4. Перинатальный (антенатальный, трансплацентарный — от инфицированной матери); 5. Трансплантационный (пересадка инфицированных органов, костного мозга, искусственная инсеминация инфицированной спермой); 6. Молочный (заражение ребёнка инфицированным молоком матери); 7. Профессиональный и бытовой — заражение через повреждённые кожные покровы и слизистые оболочки людей, контактирующих с кровью. ВИЧ не передается при бытовых контактах.Стадии развития ВИЧ: 1Стадия инкубации протекает от момента заражения до появления реакции организма в виде проявлений острой инфекции или выработки антител (от 3 недель до 3 месяцев, но в некотрых случаях затягиваться и до года). 2стадия первичных проявлений имеет дополнительный набор характеристик: острая инфекция ,бессимптомная инфекция ,персистирующая генерализованная лимфаденопатия (увеличение не менее двух лимфоузлов в двух разных группах, исключая паховые лимфоузлы, В стадии острой инфекции часто отмечается транзиторное снижение Т-лимфоцитов, которое иногда сопровождается развитием проявлений вторичных заболеваний (кандидозы, герпетическая инфекция). Эти проявления, слабо выражены, кратковременны и хорошо поддаются терапии (лечению). Обычно продолжительность стадии острой инфекции составляет 2-3 недели, после чего заболевание переходит - бессимптомную инфекцию. 3). Стадия обычно начинает развиваться через 3-5 лет от момента заражения. Для нее характерны бактериальные, грибковые и вирусные поражения слизистых и кожных покровов, воспалительные заболевания верхних дыхательных путей. На стадии (через 5-7 лет от момента заражения) кожные поражения носят более глубокий характер и склонны к затяжному течению. Стадия (через 7--10 лет) характеризуется развитием тяжелых, вторичных заболеваний, их генерализованным (общим) характером, поражением центральной нервной системы.
30. Парамиксовирусы (Paramyxoviridae) — семейство вирусов, вызывающих корь, эпидемический паротит (свинку), парагрипп, болезнь Ньюкасла, чумку у собак. Возможно, вызывают атипичную пневмонию. Вирионы имеют сферическую форму. Геном представлен однонитевой нефрагментированной РНК, ограничивает сопротивляемость к мутации. Жизненный цикл вирусов парагриппа проходит в цитоплазме клетки, парамиксовирусы не нуждаются в затравочной мРНК для своей транскрипции. Классификация : Семейство включает следующие таксоны: подсемейство Paramyxovirinae :род Avulavirus - вирус болезни Ньюкасла ,род Henipavirus ,род Morbillivirus - вирус кори, вирус чумки собак, род Respirovirus -вирус парагриппа человека, серотипов 1 и 3,род Rubulavirus вирус парагриппа человека серотипов 2 и 4, паротита,род TPMV-like viruses; подсемейство Pneumovirinae :род Pneumovirus — респираторный синцитиальный вирус,род Metapneumovirus. Особенности репликации: Геном представлен одной линейной молекулой негативной полярности одноцепочной. Имеется 6 генов, разделенных консервативными некодирующими участками, которые являются сигналами начала и окончания полиаденилирования. В составе парамиксовирусов обнаружено семь белков: NP (или N), P, M, F, L и HN (или Н или G). Они являются общими для всех родов. HN-белок обеспечивает прикрепление вирионов к клеткам и вызывает образование ВНА, препятствующих адсорбции вируса на клеточных рецепторах. F-белок участвует в проникновении вируса в клетку. Размножение парамиксовирусов происходит в цитоплазме, Вирионы с помощью HN-белка прикрепляются к гликолипидным рецепторам клетки. Затем F-белок осуществляет сплавление вирусной оболочки с плазматической мембраной клетки. В результате нуклеокапсид оказывается в клетке с тремя связанными с ним белками (N, Р и L), после чего начинается процесс транскрипции, осуществляемый вирионой РНК-зависимой РНК полимеразой. Геном транскрибируется с образованием 6—10 дискретных непроцессированных мРНК в результате последовательного прерывистого синтеза от одного промотора. Полноразмерная копия геномной РНК (+РНК) также синтезируется и служит матрицей для синтеза геномной РНК (-РНК). синтезированные геномные РНК, связанные с N-белком и транскриптазой, формируют нуклеокапсиды. Созревание вирионов включает: 1) внедрение вирусных гликопротеинов в измененные участки клеточной плазматической мембраны; 2) связывание матричного белка (М) и других негликозилированных белков с измененной мембраной клетки; 3) размещение нуклеокапсидных субъединиц под М-белком; 4) формирование и освобождение зрелых вирионов путем почкования.
Важнейшие представители: Вирусы парагриппа очень распространенные возбудители ОРЗ. вирус парагриппа человека чаще поражает клетки гортани, поэтому заболевание протекает с явлениями ларингита (сухой болезненный «лающий кашель», охрипший голос). У детей заболевания, вызываемые ВПГЧ, протекают более тяжело, у них чаще развивается интоксикация. Респираторно - синцитиальный вирусВозбудитель относится к роду Pneumovirus семейства парамиксовирусов, является одним из наиболее частых возбудителей острых респираторных заболеваний у детей первых лет жизни.Вирус кори — представитель рода Morbillivirus семейства парамиксовирусов. По морфологии почти не отличается от других представителей семейства. У него отсутствует нейраминидаза. Обладает гемагглютинирующей, гемолитической и симпластической активностью. Вирус имеет гемагглютинин, гемолизин (F), нуклеопротеид (NP) и матричный белок, отличающиеся антигенной специфичностью и иммуногенностью. Вирус кори имеет сероварианты, имеет общие антигенные детерминанты с другими морбилливирусами (вирусом чумы собак и вирусом чумы крупного рогатого скота).
31 В изометрических структурах упаковка нуклеиновой кислоты вирусного генома сложная: белки оболочки нуклеокапсида относительно слабо связаны с нуклеиновой кислотой или нуклеопротеидами, что налагает минимум ограничений на способ упаковки нуклеиновой кислоты. Нуклеопротеиды «сердцевины» при этом могут быть весьма сложно организованы: так, в паповавирусах двухцепочечная кольцевая ДНК, связываясь с гистонами, образует структуры, очень похожие на нуклеосомы.
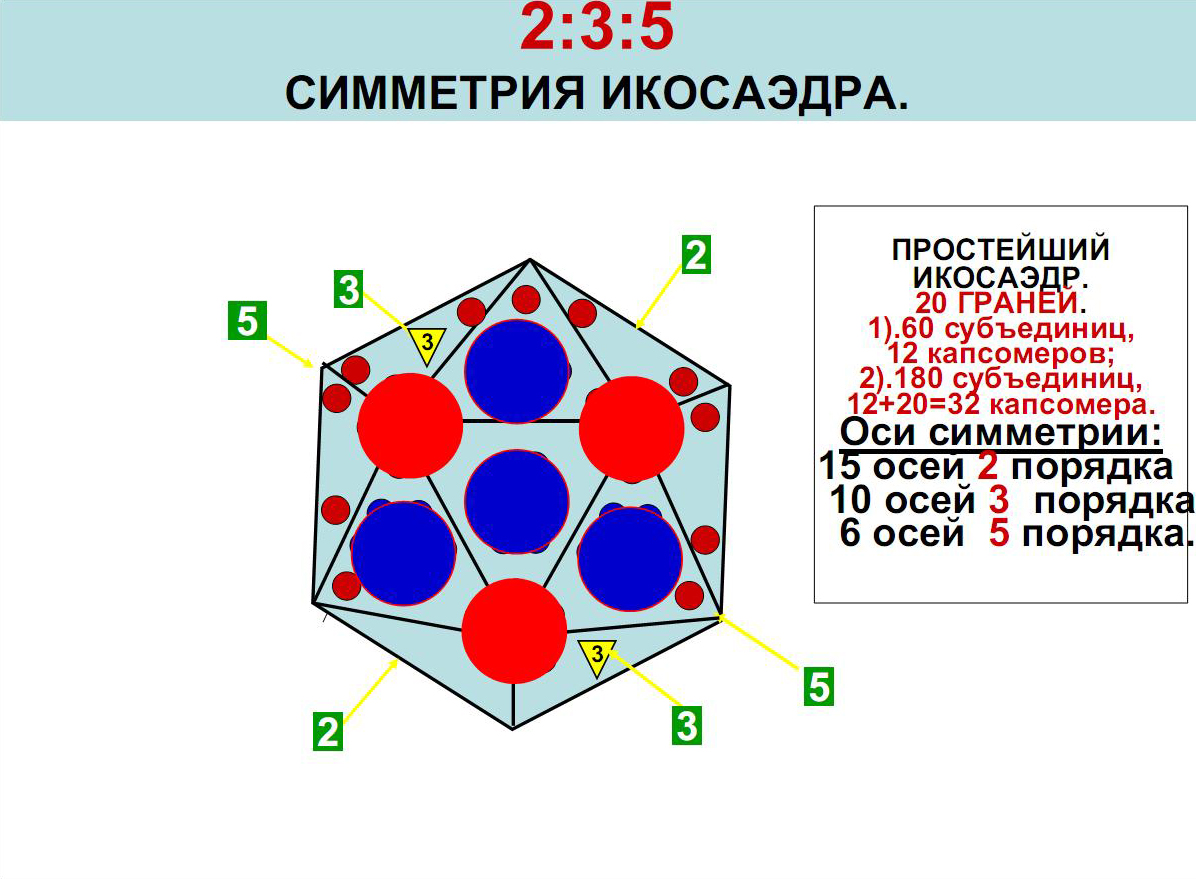
У подобных вирусов нуклеиновая кислота окружена капсомерами, образующими фигуру икосаэдра— многогранника с 12 вершинами, 20 треугольными гранями и 30 углами. К вирусам с подобной структурой относят аденовирусы, реовирусы, иридовирусы, герпесвирусы и пикорнавирусы. Организация по принципу кубической симметрии придаёт вирусам сферическую форму. Принцип кубической симметрии — самый экономичный для формирования замкнутого капсида, так как для его организации используются сравнительно небольшие белковые блоки, образующие большое внутреннее пространство, в которое свободно укладывается нуклеиновая кислота.
32. Жизненные циклы большинства вирусов, вероятно, схожи. А вот в клетку они, по-видимому, проникают по-разному, поскольку в отличие от вирусов животных бактериальным и растительным вирусам приходится проникать еще и через клеточную стенку. Проникновение в клетку не всегда происходит путем инъекции, и не всегда белковая оболочка вируса остается на внешней поверхности клетки. Попав внутрь клетки-хозяина, некоторые фаги не реплицируются. Вместо этого их нуклеиновая кислота включается в ДНК хозяина. Здесь эта нуклеиновая кислота может оставаться в течение нескольких поколений, реплицируясь вместе с собственной ДНК хозяина. Такие фаги известны под названием умеренных фагов, а бактерии, в которых они затаились, называются лизогенными. Это означает, что бактерия потенциально может лизироваться, но лизиса клеток не наблюдается до
тех пор, пока фаг не возобновит свою деятельность. Такой неактивный фаг
называется профагом или провирусом.
33. Структура и химический состав. Вирионы сферической формы. В центре – нуклеокапсид со спиральным типом симметрии, окружен внешней оболочкой с шиловидными отростками. Односпиральная «–» РНК. В составе нуклеокапсида есть несколько вирусспецифических ферментов, в том числе РНК-полимераза. Имеет суперкапсид и 3 вирусспецифических белка: 2 – гликопротеины NH (обладают гемагглютинирующей и нейраминидазной активностью), 3 – белок F (участвует в слиянии клеточных мембран с вирусной оболочкой).
КЛАССИФИКАЦИЯ ВИРУСОВ ГРИППА Все представители семейства ортомиксовирусов являются вирусами гриппа. Они классифицируются на вирусы гриппа типов А, В и С по антигену РНП, который не дает перекрестных межтиповых серологических реакций'. Характерной особенностью вирусов гриппа типа А является изменение антигенных свойств обоих поверхностных белков (гликопротеидов) гемагглютинина и нейраминидазы. Многочисленные антигенные варианты вирусов гриппа' с различными типами гемагглютинина и нейраминидазы выделяют от домашних и диких животных. Наличие различных антигенных вариантов потребовало унифицированной классификации вирусов на основе антигенных свойств гемагглютинина и нейраминидазы. Поскольку вирус гриппа типа С отличается от вирусов гриппа типов А и В по ряду фундаментальных свойств, он выделен в отдельный род. У вируса гриппа типа В, хотя и существуют антигенные варианты, однако их не так много и. они не нуждаются и классификации. В отличие от вирусов типа А, циркулирующих как у людей, так и у животных, вирусы гриппа типа В выделены только от человека.
34. Основной особенностью вирусного генома является то, что наследственная информация у вирусов может быть записана как на ДНК, так и на РНК. Геном ДНК-содержащих вирусов двухнитевой (исключение составляют парвовирусы, имеющие однонитевую ДНК), несегментированный и проявляет инфекционные свойства. Геном большинства РНК-содержащих вирусов однонитевой (исключение составляют реовирусы и ретровирусы, обладающие двунитевыми геномами) и может быть сегментированным или несегментированным. Вирусные РНК в зависимости от выполняемых функций подразделяются на две группы. К первой группе относятся РНК, способные непосредственно транслировать генетическую информацию на рибосомы чувствительной клетки, т.е выполнять функции иРНК и мРНК. Их называют плюс-нити РНК. Они имеют характерные окончания (`шапочки') для специфического распознавания рибосом. У другой группы вирусов РНК не способна транслировать генетическую информацию непосредственно на рибосомы и функционировать как иРНК. Такие РНК служат матрицей для образования иРНК, т.е. при репликации первоначально синтезируется матрица (+РНК) для синтеза -РНК. У вирусов этой группы репликация РНК отличается от транскрипции по длине образующихся молекул: при репликации длина РНК соответствует материнской нити, а при транскрипции образуются укороченные молекулы иРНК. Исключение составляют ретровирусы, которые содержат однонитевую +РНК, служащую матрицей для вирусной РНК-зависимой ДНК-полимеразы (обратной транскриптазы). При помощи этого фермента информация переписывается с РНК на ДНК, в результате чего образуется ДНК-провирус, интегрирующийся в клеточный геном.
35. ДНК-содержащие вирусы по способу репликации отличаются от РНК-содержащих вирусов. ДНК обычно существует в виде двухцепочечных структур: две полинуклеотидные цепочки соединены водородными связями и закручены таким образом, что образуется двойная спираль. РНК, напротив, обычно существует в виде одноцепочечных структур. Однако геном отдельных вирусов представляет собой одноцепочечную ДНК или двухцепочечную РНК. Первый этап репликации вирусов связан с проникновением вирусной нуклеиновой кислоты в клетку организма-хозяина. Этому процессу могут способствовать специальные ферменты, входящие в состав капсида или внешней оболочки вириона, причем оболочка остается снаружи клетки или вирион теряет ее сразу после проникновения внутрь клетки. Вирус находит подходящую для его размножения клетку, контактируя отдельными участками своего капсида (или внешней оболочки) со специфическими рецепторами на поверхности клетки по типу «ключ – замок». Если специфические («узнающие») рецепторы на поверхности клетки отсутствуют, то клетка не чувствительна к вирусной инфекции: вирус в нее не проникает. Для того чтобы реализовать свою генетическую информацию, проникшая в клетку вирусная ДНК транскрибируется специальными ферментами в мРНК. Образовавшаяся мРНК перемещается к рибосомам, в результате чего синтезируются вирусные белки. Сама же вирусная ДНК многократно удваивается при участии другого набора ферментов, как вирусных, так и принадлежащих клетке. Синтезированный белок, который используется для строительства капсида, и размноженная во многих копиях вирусная ДНК объединяются и формируют новые, «дочерние» вирионы. Сформированное вирусное потомство покидает использованную клетку и заражает новые: цикл репродукции вируса повторяется. Некоторые вирусы во время отпочковывания от поверхности клетки захватывают часть клеточной мембраны, в которую «заблаговременно» встроились вирусные белки, и таким образом приобретают оболочку. У некоторых РНК-содержащих вирусов геном (РНК) может непосредственно выполнять роль мРНК. Однако эта особенность характерна только для вирусов с «+» нитью РНК (т.е. с РНК, имеющей положительную полярность). У вирусов с «-» нитью РНК последняя должна сначала «переписаться» в «+» нить; только после этого начинается синтез вирусных белков и происходит репликация вируса. Так называемые ретровирусы содержат в качестве генома РНК и имеют необычный способ транскрипции генетического материала: вместо транскрипции ДНК в РНК, как это происходит в клетке и характерно для ДНК-содержащих вирусов, их РНК транскрибируется в ДНК. Двухцепочечная ДНК вируса затем встраивается в хромосомную ДНК клетки. На матрице такой вирусной ДНК синтезируется новая вирусная РНК, которая, как и другие, определяет синтез вирусных белков.
37. У вирусов животных известно огромное число мутантных форм. Существуют, в частности, мутанты, различающиеся по морфологии бляшек и оспин; мутанты, зависимые от хозяина или от температуры; мутанты, неспособные индуцировать синтез тимидинкиназы; резистентные к некоторым химическим веществам или зависимые от них; различающиеся по термочувствительности их инфекционных свойств или ферментативной активности, по антигенным свойствам белков оболочки, по способности к образованию бляшек в присутствии различных ингибиторов, а также многие другие. Для генетических исследований нужны мутанты с четко выраженным, достаточно стабильным фенотипическим признаком, который легко учитывать; этот признак должен быть обусловлен единичным мутантным геном с полной пенетрантностью.
36. Семейство Bunyaviridae считается крупнейшим по количеству входящих в него вирусов (около 250). Передаются контактным, воздушно-пылевым и алиментарным путями. Вирионы буньявирусов имеют сферическую форму и диаметр 90-100 нм. Геном образован молекулой -РНК, состоящей из трёх (L, М и S) сегментов. Нуклеокапсид буньявирусов организован по типу спиральной симметрии. Снаружи нуклеокапсид покрыт двухслойным липидным суперкапсидом, на котором располагаются белковые структуры с гемагглютинирующей активностью, объединённые в форме поверхностной решётки. У различных буньявирусов состав белков вариабелен, но все содержат поверхностные гликопротеины G1 и G2 и внутренний гликопротеин, ассоциированный с РНК N-белок. Большинство вирусов содержит РНК-зависимую РНК-полимеразу. Репликативный цикл буньявирусов осуществляется в цитоплазме. Возбудители арбовирусных инфекций: Вирусы рода Phlebovirus вызывают различные москитные лихорадки (например, лихорадку паппатачи, неаполитанскую и сицилийскую лихорадки, лихорадки долины Рифт, Пунта Торо и др.). Род Nairovirus включает вирус конго-крымской геморрагической лихорадки, вызывающий заболевания в России, Молдавии, Украине, на Балканах и в Африке. Круг природных хозяев буньявирусов широк: природным резервуаром более половины видов являются грызуны, 1/4 птицы и 1/4 различные парнокопытные животные. Переносчики большинства буньявирусов — комары семейства Culicinae; свыше 20 видов вирусов передают клещи семейств Ixodidae и Argasidae; несколько вирусов переносят мокрецы и москиты. Род Calicivirus семейства Caliciviridae объединяет вирусы с «голым» кубическим капсидом диаметром 37-40 нм. Геном калицивирусов образован молекулой +РНК. При негативно-контрастной микроскопии на поверхности вирионов обнаруживают 32 чашевидных вдавления, в связи с чем вирусы и получили своё название [от греч. kalyx, чаша]. Калицивирусы не размножаются в известных клеточных культурах, для их диагностики обычно используют метод иммунной электронной микроскопии. Патогенные для человека виды калицивирусов вызывают гастроэнтериты и гепатиты. Помимо истинных калицивирусов в род включены вирус Норволк и возбудитель гепатита Е. Возбудители гастроэнтеритов Патогенез заболеваний обусловлен некротическими поражениями эпителия слизистой оболочки тонкой кишки калицивирусами, сопровождающимися развитием диарейного синдрома. Инкубационный период калицивирусных гастроэнтеритов не превышает 1-2 сут; большинство авторов выделяют три основных типа поражений: заболевания с выраженной рвотой (обычно наблюдают в зимние месяцы, чаще у детей); эпидемические диареи (у подростков и взрослых) и гастроэнтериты (чаще у детей). Калицивирусные гастроэнтериты сопровождают миалгия, головная боль; у 50% пациентов отмечают умеренную лихорадку. Диарейный синдром при калицивирусном гастроэнтерите протекает мягко — стул водянистый, без примеси крови. Через 7-10 сут наступает спонтанное выздоровление. Лечение калицивирусных гастроэнтеритов симптоматическое; средства этиотропной терапии и специфической профилактики отсутствуют. Род коронавирусы включает многие важные патогенные вирусы млекопитающих и птиц, вызывающие респираторные болезни, энтериты, полисерозиты, миокардиты, гепатиты, нефриты и иммунопатологию. У человека коронавирусы вместе с другими вирусами вызывают синдром обычной простуды (common cold). Большинство коронавирусов обладают выраженным тропизмом к клеткам эпителия дыхательных путей и кишечного тракта. Некоторые коронавирусы выделяются с трудом и лишь с применением органных культур. редставители рода коронавирусы имеют вирионы округлой формы диаметром 80—220 нм. Вирионы коронавирусов состоят из нуклеокапсида спиральной симметрии и гликопротеиновой оболочки, на поверхности которой имеются характерные далеко отстоящие друг от друга булавовидные выступы длиной 20 нм, образующие подобие солнечной короны. Некоторые коронавирусы, кроме того, имеют укороченные пепломеры длиной 5 нм. Коронавирусы содержат три или четыре основных структурных белка: нуклеокапсидный белок N; главный пепломерный гликопротеин S; трансмембранные гликопротеины М и Е. Некоторые вирусы, кроме того, содержат НЕ-белок. Торовирусы содержат те же белки, что и коронавирусы, но не содержат Е белок. Торовирус КРС содержит белок НЕ (М, 65000). Среди представителей рода коронавирусы различают три антигенные группы. У представителей рода коронавирусов обнаружены следующие структурные белки. Гликопротеин S (150—180 кД) образует большие выступы на поверхности вирионов. Гликопротеин S может быть разделен на 3 структурных сегмента. Большой наружный трансмембранный и цитоплазматический сегменты. Большой наружный сегмент, в свою очередь, состоит из двух субдоменов S1 и S2. Мутации в S1 сегменте связаны с изменением антигенности и вирулентности вируса. S2 сегмент является более консервативным. S белок коронавируса КРС (180 кД) в течение или после созревания вирионов расщепляется клеточными протеазами на S1 и S2, оставаясь нековалентно связанным в вирионных пепломерах. Расщепление S белка у разных коронавирусов зависит от клеточной системы. S белок вызывает образование ВНА и ответственен за слияние вирусной оболочки с мембраной клетки. S белок является многофункциональным.
38. Умеренные фаги лизируют не все клетки в популяции, с частью из них они вступают в симбиоз, в результате чего ДНК фага встраивается в хромосому бактерии. В таком случае геномом фага называют профаг. Профаг, ставший частью хромосомы клетки, при ее размножении реплицируется синхронно с геном бактерии, не вызывая ее лизиса, и передается по наследству от клетки к клетке неограниченному числу потомков. Биологическое явление симбиоза микробной клетки с умеренным фагом (профагом) называется лизогенией, а культура бактерий, содержащая профаг, получила название лизогенной. Это название (от греч. lysis — разложение, genea — происхождение) отражает способность профага самопроизвольно или под действием ряда физических и химических факторов исключаться из хромосомы клетки и переходить в цитоплазму, т.е. вести себя как вирулентный фаг, лизирующий бактерии. Лизогенные культуры по своим основным свойствам не отличаются от исходных, но они невосприимчивы к повторному заражению гомологичным или близкородственным фагом и, кроме того, приобретают дополнительные свойства, которые находятся под контролем генов профага. Изменение свойств микроорганизмов под влиянием профага получило название фаговой конверсии. Последняя имеет место у многих видов микроорганизмов и касается различных их свойств: культуральных, биохимических, токсигенных, антигенных, чувствительности к антибиотикам и др. Кроме того, переходя из интегрированного состояния в вирулентную форму, умеренный фаг может захватить часть хромосомы клетки и при лизисе последней переносит эту часть хромосомы в другую клетку. Если микробная клетка станет лизогенной, она приобретает новые свойства. Таким образом, умеренные фаги являются мощным фактором изменчивости микроорганизмов. Умеренные фаги могут нанести вред микробиологическому производству. Так, если микроорганизмы, используемые в качестве продуцентов вакцин, антибиотиков и других биологических веществ, оказываются лизогенными, существует опасность перехода умеренного фага в вирулентную форму, что неминуемо приведет к лизису производственного штамма.
39. Ретрови́русы (лат. Retroviridae) — семейство РНК-содержащих вирусов, заражающих преимущественно позвоночных. Наиболее известный и активно изучаемый представитель — вирус иммунодефицита человека. Ретровирусы содержат в своем составе уникальный фермент – обратную транскриптазу, с помощью которой синтезируется ДНК на матрице вирионной РНК.После инфицирования клетки ретровирусом в цитоплазме начинается синтез вирусного ДНК-генома с использованием вирионной РНК в качестве матрицы. Все ретровирусы используют для репликации своего генома механизм обратной транскрипции: вирусный фермент обратная транскриптаза (или ревертаза) синтезирует одну нить ДНК на матрице вирусной РНК, а затем уже на матрице синтезированной нити ДНК достраивает вторую, комплементарную ей нить. Образуется двунитевая молекула ДНК, которая, проникнув через ядерную оболочку, интегрируется в хромосомную ДНК клетки и далее служит матрице для синтеза молекул вирусных РНК. Эти РНК выходят из клеточного ядра и в цитоплазме клетки упаковываются в вирусные частицы, способные инфицировать новые клетки.По одной из гипотез, ретровирусы могли произойти от ретротранспозонов— подвижных участков генома эукариот.Классификация ретровирусов
Семейство Retroviridae включает три подсемейства:--Oncovirinae (онковирусы), важнейший представитель которого — T-лимфотропный вирус человека типа 1 ; --Lentivirinae (лентивирусы), к которому относится ВИЧ ; и --pumavirinae (спумавирусы, или пенящие вирусы).Особенности репликацииОсобенности трансляции РНК ретровирусов Находясь в составе геномной ДНК, вирусные гены транскрибируются под контролем LTR LTR, long terminal repeats. Последовательности LTR включают в себя последовательности STR. Возникновение LTR очень важно для экспрессии вирусных генов. Они содержат вирусные регуляторные транскрипционные элементы: промотор, энхансер, и другие. Например, некоторые вирусы содержат элементы, определяющие зависимость вирусной транскрипции от наличия определенных гормонов. LTR и являются теми регуляторными сигналами, которые вирус использует для эксплуатации клеточной транскрипционной машины в своих целях.Продуктом транскрипции является полноразмерная вирусная РНК. Она должна транслироваться. И здесь вирусу необходимо решить такую проблему: нужно синтезировать много белков, а РНК одна. И в клетках эукариот РНК моноцистронны, то есть предназначены для синтеза только одного белка. Синтез белка в большинстве случаев начинается с ближайшего к кэп-сайту инициирующего кодона.Если просмотреть открытую рамку считывания от этого ближайшего инициирующего кодона, то мы увидим, что если бы вирус пользовался традиционными способами экспрессии, то он смог бы синтезировать только полипептид GAG. А дальше идет стоп- кодон. Как быть с POL и ENV? Кроме того, эти полипептиды очень длинны, а в вирусе содержатся гораздо более короткие. Проблема решается несколькими способами. Во-первых, с помощью сплайсинга эта одна РНК превращается в нашем упрощенном варианте еще в одну, более короткую. При этом последовательности, кодирующие ENV полипептид, оказываются рядом с инициирующим кодоном, ближайшим к кэп-сайту, и начинают транслироваться.Во-вторых, разными для разных ретровирусов способами они ухитряются обойти стоп — кодон после открытой рамки считывания GAG и синтезировать сплавленный полипетид GAG-POL, который содержит последовательности обоих групп белков. В-третьих, полученные длинные полипептиды подвергаются процессингу и разрезаются на множество белков, которые и функционируют либо в роли регуляторных, как, например, обратная транскриптаза, либо в роли структурных, как, например, белки оболочки зрелых вирусов.Иными словами, ретровирусы используют гибкую тоталитарную систему для весьма тонкой регуляции синтеза большого разнообразия белков под контролем одного промотора.
Подсемейство онковирусов на оснавании морфологических характеристик разделяют на четыре группы (рода), обозначая их буквами латинского алфавита: онковирусы типа С, В, D и отдельно онковирус бычьего лейкоза. Наиболее распространены и наибольшее значение имееют онковирусы типа С. Они распространены среди рыб, пресмыкающихся, птиц и млекопитающих, включая человека. Онковирусы типа В обнаружены у мышей и морских свинок, типа D – у обезьян и мангустов. Вирус бычьего лейкоза пока не имеет аналогов среди других животных. В культурах клеток, продуцирующих онковирусы, обнаруживаются онковирусы типа А, которые большинство исследователей считают предшественниками (незрелыми формами) других онковирусов.
40. Комплементация - функциональное взаимодействие двух дефектных вирусов, приводящее к появлению возможности их репродукции в условиях, при которых невозможно размножение каждого вируса в отдельности. При реализации подобных отношений вирусные геномы взаимодействуют косвенно, то есть на уровне кодирующих их веществ. Дефектные вирусы размножаются и передаются горизонтально (то есть от одной особи к другой, в отличие oт вертикального способа - от матери к плоду).Рекомбинация — это физическое взаимодействие между вирусными геномами в смешанно-зараженной клетке приводящее к обмену генетическим материалом между родительскими вирусами. Возможен как обмен полными генами (межгенная рекомбинация), так и участками одного и того же гена (внутригенная рекомбинация). У вирусов животных это взаимодействие может происходить двумя различными способами в зависимости от физической организации вирусного генома. У вирусов, имеющих одну геномную молекулу, включая все ДНК-содержащие вирусы и часть РНК-содержащих вирусов, рекомбинация включает разрыв и воссоединение ковалентной связи в нуклеиновой кислоте с образованием дочерних геномов неродительского типа (внутримолекулярная рекомбинация). Образующийся вирус-рекомбинант обладает свойствами, унаследованными от разных родителейОбычно рекомбинируемые штаммы обладают характерными признаками, которые обозначаются как маркеры. Например, были получены рекомбинанты между вирусами полиомиелита, обладающие повышенной устойчивостью и повышенной чувствительностью к гуанидину, разной ней-ровирулентностью, разной устойчивостью к повышенной температуре, разной чувствительностью к ингибиторам сывороток лошадей и коров и т. п. Для получения рекомбинантов используют штаммы, содержащие два или большее число маркеров.Тест рекомбинации применяют для генетических исследований вирусов. С его помощью возможно построение генетических карт вирусов, в которых определяется, в каких участках генома произошли мутации, а также в условных единицах измеряется расстояние между разными мутациями.
41.Бактериофаги – (от бактерии и греч. fagos – пожиратель; синоним: фаг, бактериальный вирус)- вирус, поражающий бактерии.. Современная классификация бактериофагов включает 13 семейств, подразделенных более чем на 140 родов, которые содержат более 5300 видов фагов.ПроисхождениеВопрос о происхождении фагов не решен. Одни исследователи считают, что фаги - экзогенные агенты. Другие полагают, что фаги имеют эндогенное происхождение, продуцируются бактериями и являются своеобразной формой их развития. В природных биоценозах фаги определяют внутри- и межвидовое микробное равновесие; являются индикаторами загрязнения водоемов бытовыми, сельскохозяйственными и промышленными стоками; косвенным показателем инфицирования животных и человека; движущей силой образования новых вариантов и разновидностей бактерий; лизируя или угнетая патогенные микроорганизмы, обеспечивают естественный антимикробный иммунитет у человека и выздоровление от бактериальных инфекций. РаспространениеУ бактериофагов очень разная морфология и среда обитания. Они живут везде, где есть бактерии: в воде, в почве, в каплях дождя, на поверхностях предметов, овощей, фруктов, на шерсти животных, на коже человека и внутри организма. Чем богаче среда микроорганизмами, тем больше в ней бактериофагов. Особенно много бактериофагов в черноземе и почвах, в которые вносились органические удобрения. В 1 мм3 обыкновенной воды - около миллиарда бактериофагов.
42. Семейство парвовирусов (parvus - маленький) поражают млекопитающих, птиц, насекомых. Включает в себя три рода: парвовирусы, депендовирусы и эритровирусы. К роду парвовирусы относятся: вирус крыс, или вирус Килхема (прототипный вирус), парвовирусы свиней, крупного рогатого скота, лошадей, собак, кроликов, кур, вирусы энтерита норок и гусей, алеутской болезни норок, панлейкопении кошек, мелкий вирус мышей, а также вирусы, происхождение которых не выяснено. В род эритровирусы включен парвовирус человека (В 19), вызывающий апластические кризы при хронической анемии и являющийся этиологическим агентом инфекционной эритемы детей. Возможными представителями рода являются парвовирусы обезьян и бурундуков. Род депендовирусов объединяет аденоассоциированные вирусы (ААВ) человека и обезьян (пять типов), крупного рогатого скота, собак и птиц. Типовой вид — ААВ типа I. Возможными представителями рода являются ААВ лошадей и овец. Депендовирусы, в отличие от других парвовирусов — дефектны, то есть размножаются только в присутствии вирусов-помощников, роль которых выполняют аденовирусы или герпесвирусы. Недефектные парвовирусы вызывают у животных энтериты, гепатиты, миокардиты, геморрагическую энцефалопатию, панлейкопению, гибель эмбрионов и плодов, отставание в росте, подавляют гемопоэз, лимфопоэз и иммунный ответ. Дефектные парвовирусы не оказывают какого-либо клинически выраженного эффекта. Вирионы парвовирусов представляют собой безоболочечные изометрические частицы с кубической симметрией диаметром 25 нм. Это довольно мелкие вирусы животных. Капсид парвовирусов состоит из 32 капсомеров диаметром 3—4 нм. Парвовирусы содержат одноцепочечную линейную ДНК размером 5,2 тн (19—32% массы вирионов). Морфология Это самые мелкие изометрические вирусы с диаметром 18-26 нм. Вирионы парвовирусов представляют собой безоболочечные изометрические частицы с кубической симметрией диаметром 25 нм. Это довольно мелкие вирусы животных. Капсид парвовирусов состоит из 32 капсомеров диаметром 3—4 нм. Парвовирусы содержат одноцепочечную линейную ДНК размером 5,2 тн (19—32% массы вирионовОсобенности репликации РепродукцияХотя в вирионах содержится ДНК разной полярности, транскрибируется только «минус-нить». При транскрипции образуется три основных транскрипта, которые имеют общий 3‘ – конец. Самая короткая иРНК кодирует все три вирусных структурных белка. Другие транскрипты кодируют неструктурные белки. Парвовирусы размножаются в ядре клеток, находящихся в поздней S фазе или ранней G2 фазе цикла клеточного деления. Такая особенность репликации парвовирусов является основой многих аспектов патогенеза. Это прежде всего поражение тканей в период эмбрионального развития и у молодых животных, а также клеток лимфоидных органов и эпителия кишечника, которые постоянно находятся в стадии деления. Авирулентный штамм вируса алеутской болезни норок легко адаптировался к размножению в клеточной линии FS (клетки селезенки кошки).
43. ИНТЕРФЕРЕНЦИЯ ВИРУСОВ (от лат. inter, здесь — взаимно и ferio — ударяю, поражаю), тип взаимодействия между вирусами, при к-ром наблюдается подавление репродукции одного вируса другим в клетках, смешанно заражённых двумя вирусами. Проявляется на разных стадиях вирусной инфекции и м. б. обусловлена конкуренцией за клеточные рецепторы при адсорбции вируса на клеточной поверхности, за участки репликации нуклеиновой к-ты и трансляции, истощением метаболитов в клетке, индукцией интерферона и др. причинами. И. в. используют для обнаружения, идентификации и титрования нецитопатогенных вирусов. Интерференцией вирусов обозначают состояние невосприимчивости к вторичному заражению клетки, уже инфицированной вирусом. Различают интерференцию гетерологическую и гомологическую. Гетерологическая интерференция. Инфицирование одним вирусом полностью блокирует возможность репликации второго вируса в пределах одной клетки. Один из механизмов гетерологической интерференции связан с угнетением адсорбции другого вируса путём блокирования или разрушения специфичных рецепторов. Другой механизм связан с ингибированием трансляции мРНК любой гетерологичной мРНК в инфицированной клетке. Гомологическая интерференция. Процесс типичен для многих дефектных вирусов, особенно для повторно пассируемых in vitro и с высокой множественностью инфицирования. Дефектные вирусы обычно не способны к самостоятельной репродукции. Их репродукция возможна лишь при заражении клетки совместно с нормальным вирусом. В подобных взаимодействиях последний называют вирусом-помощником. Иногда дефектный вирус может вмешиваться в репродуктивный цикл нормального вируса и образовывать дочерние дефектные интерферирующие (ДИ) вирусные частицы. Фенотипическое смешивание вирусов наблюдают при одновременном заражении клетки близкородственными вирусами (например, различными сероварами полиовирусов или вирусов Коксаки). В результате образуются вирионы с гибридными капсидами, в состав которых входят капсомеры, кодируемые геномами двух вирусов (рис. 5-8). Образование псевдотипов происходит при множественном инфицировании. Феномен заключается в образовании нуклеокапсида, состоящего из генома одного вируса и капсида близкородственного вируса. Генетические процессы, приводящие к образованию псевдотипов, известны как фенотипическое маскирование. Процесс может развиваться и в обратном направлении при коинфицировании вирусами идентичного псевдотипа. Если все вирионы попавшие в клетку, содержат геном типа 2 и заключены в капсид типа 1, то дочерние популяции будут включать капсид и геном типа 2, так как образование всех их структурных компонентов кодирует геном типа 2.
44. Стадии репликации вирусов:1. Присоединение к клеточной мембране2. Проникновение в клетку3. Перепрограммирование клетки4. Персистенция5. Создание новых вирусных компонентов6. Созревание вирионов и выход из клетки.Присоединение к клеточной мембране — так называемая адсорбция. Обычно для того, чтобы вирион адсорбировался на поверхности клетки, она должна иметь в составе своей плазматической мембраны белок (часто гликопротеин) — рецептор, специфичный для данного вируса. Наличие рецептора нередко определяет круг хозяев данного вируса, а также его тканеспецифичность.
46. Вирусы с сегментированным геномом (буньявирусы, реовирусы, ортомиксовирусы), у которых особью может считаться лишь вирион, содержащий весь набор сегментов нуклеиновой кислоты. Для этой же группы вирусов характерно наличие в популяции неполных или дефектных вирусов, не способных к самовоспроизведению, т. е. лишенных одной из основных характеристик организма. Концевые участки ДНК-генома ретровирусов отличаются от концевых участков РНК-генома. На обоих концах ДНК-генома имеются идентичные последовательности, названные длинными концевыми повторами (LTR), которые выполняют регуляторные функции: содержат промоторы, участвуют в интеграции провируса в клеточный геном и полиаденилировании вирусной РНК. Участок связывания праймера , необходимого для инициации обратной транскрипции, и последовательности, ответственные за сборку вирусов, находятся вне длинных концевых повторов. Кодирующие участки генома содержат структурные гены gag , pol и env . В результате транскрипции генов gag и pol образуется единая молекула мРНК, которая в большинстве случаев транслируется в полипротеин Gag . Однако часть молекул мРНК в результате сдвига рамки считывания дает большой полипротеин Gag-Pol
45. Герпесвирусы (лат. Herpesviridae) это большое семейство ДНК-содержащих вирусов, вызывающее разнообразные болезни не только у человека и других млекопитающих, но и у птиц, рептилий, амфибий, рыб. Герпесвирусами заражено большинство населения нашей планеты.Открыто около 200 видов герпесвирусов. Отличительным признаком вирусов этого семейства является нахождение вируса в клетках латентно, персистируя, бесконечно длительное время, без клинических проявлений. Инфекционные болезни, вызванные вирусами этого семейства, протекают остро, переходят в латентную стадию, не проявляют себя до определённого времени.Вирусы семейства герпесвириде имеют общие биологические свойства. Они имеют эффективные механизмы взаимодействия с иммунной системой хозяина, позволяющие им достичь максимального распространения и сохраняться в организме в течение всей жизни.
В ходе своей жизнедеятельности вирусная ДНК экспрессирует определенные группы генов и, соответственно, кодируемых ими белков, которые, собственно, и определяют жизненный цикл вируса в клетках хозяина, приводя к изменению их фенотипических свойств, то есть трансформации.Морфология
Вирионы семейства вирусов герпеса имеют сферическую форму диаметром от 120 до 300 нм. Внутри зрелой вирусной частицы содержится 35—45 различных белковых молекул.
В центре вириона расположено ядро, размером 75 нм, содержащее ДНК. Ядро окружено икосаэдрическим капсидом.
Размер капсида составляет 100—110 нм. Капсид построен из множества одинаковых, геометрически правильных, белковых структур — капсомер, в образовании которых принимают участия протомеры. Капсомеры точно подобраны и подогнаны друг к другу, образуя икосаэдр. В образовании капсида участвуют шестиугольные и пятиугольные капсомеры. Нуклеокапсид содержит 162 капсомеры: 150 шестиугольных (гексамеры) и 12 пятиугольных (пентамеры) капсомер.
Вокруг капсида имеется аморфный белковый тегумент и всё это заключено в оболочку с гликопротеиновыми шипами.Геном
Вирусный геном представляет собой линейную двухцепочечную молекулу ДНК размером 152261 пара нуклеотидов у герпесвируса 1 человека, процент ГЦ пар составляет 68 %, и содержит 77 генов, все из которых кодируют белки, геном герпесвируса 2 человека представляет собой линейную молекулу ДНК размером 154746 пар нуклеотидов, процент ГЦ пар составляет 70 %, и несёт 77 генов. Классификацияемейство герпесвирусов по классификации Международного комитета по таксономии вирусов (International Committee on Taxonomy of Viruses, ICTV) делится на подсемейства. Используются критерии:--структура генома вируса --белковый состав --характер репликации вируса --среда носительства --тропизма к тканям --распространение вируса в культуре --длительности репродуктивного циклаПо этим признаком различают подсемейства:--α-герпесвирусы (аlphaherpesvirinae, VC 31.1.), --β-герпесвирусы (betaherpesvirinae, VC 31.2.), --γ-герпесвирусы (gammaherpesvirinae, VC 31.3.) --подсемейство неклассифицируемых вирусовВ природе насчитывается восемь типов герпесвирусов, патогенных для человека.
РепликацияЗаражение начинается с прикрепления вируса к клеточным рецепторам. Вирус проявляет большое сродство к клеткам слизистой оболочки эпителия. Вслед за этим происходит слияние оболочки вируса с плазматической или эндосомной мембраной, и лишенный оболочки капсид переносится к порам в ядерной мембране, через которые ДНК вируса попадает в ядро. Транскрипция и репликация вирусной ДНК, а также сборка капсидов происходят в ядре. Вирусная ДНК транскрибируется в ходе репродуктивного цикла клеточной РНК-полимеразой II при участии на всех стадиях цикла ряда вирусных факторов. Синтез продуктов вирусных генов строго регулируется; экспрессия вирусных генов координирована и представляет собой последовательно развернутый во времени каскад событий. Несколько более 50 хорошо представленных генных продуктов образуют по меньшей мере пять групп, отличающихся друг от друга по характеру регуляции синтеза на транскрипционном и посттранскрипционном уровне. Некоторые из генных продуктов относятся к ферментам или ДНК-связывающим белкам, непосредственно вовлеченным в синтез ДНК. Основная масса вирусной ДНК синтезируется по механизму катящегося кольца. Одновременно могут происходить изомеризация и упаковка ДНК. Сборка вируса складывается из нескольких стадий: внутри уже сформировавшихся капсидов упаковывается ДНК, вирусы созревают и выходят из клетки через плазматическую мембрану. Весь процесс может длиться от 12 ч для вируса псевдобешенства до более чем 70 ч для цитомегаловируса человека. Репликация HSV требует около 18 ч.). Наиболее распространённые вирусы этого семействаHSV-1,2 — вирусы простого герпеса 1 и 2 типа(ВПГ 1, 2);HSV-3 — ветряная оспа , опоясывающий лишай;HSV-4 — вирус Эпштейна-Барр ( EBV);CMV — цитомегаловирус (ЦМВ).
46. Вирусы с сегментированным геномом (буньявирусы, реовирусы, ортомиксовирусы), у которых особью может считаться лишь вирион, содержащий весь набор сегментов нуклеиновой кислоты. Для этой же группы вирусов характерно наличие в популяции неполных или дефектных вирусов, не способных к самовоспроизведению, т. е. лишенных одной из основных характеристик организма.Концевые участки ДНК-генома ретровирусов отличаются от концевых участков РНК-генома. На обоих концах ДНК-генома имеются идентичные последовательности, названные длинными концевыми повторами (LTR), которые выполняют регуляторные функции: содержат промоторы, участвуют в интеграции провируса в клеточный геном и полиаденилировании вирусной РНК. Участок связывания праймера , необходимого для инициации обратной транскрипции, и последовательности, ответственные за сборку вирусов, находятся вне длинных концевых повторов. Кодирующие участки генома содержат структурные гены gag , pol и env . В результате транскрипции генов gag и pol образуется единая молекула мРНК, которая в большинстве случаев транслируется в полипротеин Gag . Однако часть молекул мРНК в результате сдвига рамки считывания дает большой полипротеин Gag-Pol .
48. ПАПОВАВИРУСЫ
(Papovaviridae), сем. вирусов, не имеющих оболочки и содержащих кольцевую двухцепочную ДНК. Большинство из них онкогенны либо для естеств. хозяев, либо для лабораторных животных. П. делятся на два рода — Papillomavirus н Polyomavirus. Вирусы рода Papillomavirus (размер 30—50 нм) вызывают папилломатоз у естеств. хозяев. К хорошо изученным вирусам этого рода относятся вирусы: кроличьей папилломы Шоупа, папиллом ротовых полостей кроликов и собак, папиллом человека, лошадей и кр. рог. скота, фибромы оленей. Вирусы рода Polyomavirus (размер 40—45 нм) вызывают латентную инфекцию естеств. хозяев и, как правило, не вызывают у них опухолей, т. к, при этом синтез полных вирусных частиц не происходит. Исключение составляет вирус папилломы хомяков — агент, морфологически принадлежащий к роду Polyomavirus, но ведущий себя подобно вирусу папилломы. Вирус полиомы, давший назв. всей группе, при введении новорождённым мышатам даёт высокий процент опухолей. Онкогенен для мн. видов лабораторных животных (мыши, крысы, хомяки, хорьки, морские свинки и кролики). Вирус ОВ-40 — латентный вирус макак-резус и циномольгус; онкогенен для новорождённых хомяков, вызывает недифференцированные опухоли, чаще на месте введения. При внутривенном заражении у хомяков развиваются лимфоцитозные лейкемии и различные саркомы. Хомячий папилломатозный вирус (Graffi) вызывает у естеств. хозяев папилломы и в 30—80% случаев лимфомы и лейкозы, саркомы у крыс и фибросаркомы у новорождённых кроликов. Полиомавнрусы были выделены у человека. Наиболее изученные из них — ВК и JC, онкогенные для хозяев. Имеются и неонкогенные П. (вакуолизирующий вирус кроликов, К-вирус мышей и П. свиней).
47. Продуктивная вирусная инфекция с образованием дочерних популяций и характерными клиническими проявлениями возможна лишь при наличии в заражённом организме чувствительных клеток, в которых осуществляется репродуктивный цикл возбудителя. Например, возбудитель полиомиелита может реплицировать только в клетках ЖКТ и ЦНС приматов и человека. Абортивная инфекция развивается при проникновении возбудителя в нечувствительные клетки (например, при попадании вируса лейкоза коров в организм человека) либо в клетки, не способные обеспечить полный репродуктивный цикл (например, находящиеся в стадии клеточного цикла G0). Способность клеток к поддержанию вирусспецифических репродуктивных процессов также подавляет ИФН, противовирусный эффект которого направлен против самых различных вирусов.Персистирующая вирусная инфекция возникает при таком взаимодействии между вирусом и заражённой клеткой, когда в последней продолжается выполнение собственных клеточных функций. Если заражённые клетки делятся, образуется инфицированный клон. Таким образом, увеличение числа заражённых клеток способствует увеличению общей популяции возбудителя в организме. Тем не менее персистирующие вирусные инфекции обычно нарушают функции клеток, что в конце концов приводит к клиническим проявлениям. У человека развитие персисти-рующих инфекций в определённой степени зависит от возраста. Например, внутриутробное заражение вирусом коревой краснухи или цитомегаловирусом (ЦМВ) приводит к ограниченному по времени персистированию возбудителя. Латентная (скрытая) вирусная инфекция. В то время как персистирующие инфекции сопровождаются постоянным высвобождением дочерних вирусных популяций, при латентных поражениях они образуются спорадически. Репродуктивный цикл подобных возбудителей резко замедляется на поздних стадиях и активируется под влиянием различных факторов. Латентные инфекции характерны для большинства герпесвирусов, вызывающих рецидивирующие и обычно не прогрессирующие заболевания. Инаппарантные инфекции [от лат. in-, отрицание, + арраrео, являться] сопровождаются бессимптомной циркуляцией незначительных количеств возбудителя в отдельных органах. При этом выявить возбудителя можно лишь специальными методами. От бессимптомного носительства подобные поражения отличает большая вероятность возникновения клинических проявлений. Этот термин применяют при целом ряде инфекций, при которых нет явных признаков заболевания. В практике вирусных инфекций у человека часто применяют альтернативный термин «субклиническая инфекция». Собственно, и латентные инфекции можно расценивать как хронически протекающие инаппаратные инфекции, при которых устанавливается баланс между организмом и возбудителем.Дремлющая (криптогенная) вирусная инфекция — форма проявления вирусной инфекции при которой возбудитель в неактивном состоянии находится в отдельных очагах (например, в нервных ганглиях). Клинически инфекция проявляется лишь при резком ослаблении защитных сил организма. Например, вирус герпеса 3 типа, вызывающий при первичном заражении ветряную оспу, пожизненно сохраняется в организме. Рецидив заболевания в форме опоясывающего лишая возможен лишь при нарушениях иммунного статуса (наиболее часто в пожилом возрасте). Медленные вирусная инфекции характеризуются длительным инкубационным периодом (месяцы и годы), в течение которого возбудитель размножается, вызывая всё более явные повреждения тканей. Первоначально возбудитель размножается в ограниченной группе клеток, но постепенно инфицирует всё большее их число. Заболевания заканчиваются развитием тяжёлых поражений и смертью больного. К медленным вирусным инфекциям относят подострый склерозирующий панэнцефалит, ВИЧ-инфекцию и др.
49. Экспрессия и репликация вирусного генома Анализ данных о молекулярных механизмах репликации вирусов позвоночных позволил установить сходство и различия в способах реализации генетической информации вирусов, относящихся к различным таксономическим группам. Благодаря этому оказалось возможным выделить основные типы стратегии экспресии и репликации вирусных геномов. Семейства вирусов, реплицирующиеся по сходному пути, объединены в один тип. Репликация вирусов каждого типа начинается с инициирующих единиц, которыми являются проникшие в клетку вирусные геномы: вирионные РНК или ДНК или вирионные нуклеопротеины. Вирусы, геном которых может служить в качестве мРНК, принято называть вирусами с позитивным (+) геномом. Вирусы с негативным (-) РНК геномом неспособность функционировать в качестве мРНК компенсируют наличием вирионной транскриптазы.Репликация большинства ДНК-вирусов включает механизмы, которые хорошо известны в клеточной биологии: транскрипция мРНК на двуцепочечной ДНК и репликация ДНК. Для РНК-вирусов ситуация является уникальной и связана с генетической информацией, кодируемой РНК. РНК-вирусы с различным типом генома связаны с необходимостью использовать различные пути синтеза мРНК. Кроме (+) оцРНК вирусов, у которых геномная РНК функционирует как мРНК, все другие типы вирусной РНК, прежде всего, должны быть транскрибированы в мРНК. Так как клетки эукариотов не содержат РНК-зависимой РНК-полимеразы, (-) оцРНК вирусы и дцРНК вирусы должны содержать вирионную РНК-зависимую РНК-полимеразу Эукариотические клетки не могут транслировать полицистронные мРНК частями в виде нескольких индивидуальных белков. ДНК-вирусы расщепляют свои полицисторные РНК-транскрипты на моноцисторные мРНК, используя клеточный механизм. Большинство РНК-вирусов, размножающихся в цитоплазме, не имеют доступа к ферментам, осуществляющим РНК-процессинг и сплайсинг в ядре, и вынуждены по-разному решать эту проблему. У вирусов с сегментированным геномом каждый фрагмент является отдельным геном. Другие вирусы имеют полицистронный геном, но образуют моноцистронные РНК-транскрипты, разделяя окончание и реинициацию транскрипции. Некоторые вирусы имеют полицистронную РНК, которая транслируется в полипротеин, который затем расщепляется протеолитически с образованием конечных продуктов.
50. Некоторые вирусы вызывают персистирующую или латентную инфекцию. К ним относятся вирус гепатита В , вирус гепатита С ,вирус бешенства , вирус кори , ВИЧ , Т-лимфотропные вирусы человека , паповавирусы , герпесвирусы , а также некоторыепоксвирусы . РНК-содержащиевирусы способны снижать эффективность иммунного ответа за счет высокой изменчивости их геномов. В ходе первичной и персистирующей инфекции гены вирусов гепатита С и ВИЧ претерпевают существенные перестройки. Поскольку репликация двухцепочечной ДНК (по сравнению с репликацией РНК) сопровождается меньшим числом ошибок, ДНК-содержащие вирусы , персистируя у человека, не подвергаются значительным изменениям.Паповавирусы и герпесвирусы способны длительно сохраняться в некоторых клетках в латентном состоянии, при котором они недоступны для иммунной системы. Реактивация латентной герпетической и паповавирусной инфекции приводит к постоянному или периодическому выделению небольшого количества вирусов из организма здорового носителя. Иммунный ответ носителя в большинстве случаев предотвращает появление симптомов болезни, но не влияет на выделение этих вирусов в окружающую среду, что обеспечивает их распространение среди детей и восприимчивых взрослых и является причиной постоянной циркуляции возбудителей среди населения. Вирус контагиозного моллюска - представительсемейства поксвирусов -вызывает пролиферацию и гипертрофию эпидермиса . Заболевание проявляется папулами розового цвета с пупковидным вдавлением в центре и может длиться несколько месяцев или лет.Гипертрофию тканей при других поксвирусных инфекциях объясняют наличием у возбудителей гомологов клеточных генов, кодирующих факторы роста, в том числе эпидермальный фактор роста . Однако геном вируса контагиозного моллюска не содержит последовательностей, гомологичных известным генам эпидермального фактора роста и фактора роста фибробластов . В то же время в геноме этого вируса присутствует ген, кодирующий гомолог провоспалительных хемокинов . Этот гомолог, связываясь срецепторами хемокинов , предотвращает воспаление. Кроме того, вирус содержит гомолог гена HLA класса I , продукт которого может подавлять цитотоксическое действие Т-лимфоцитов.
51. Аденовирусы были выделены в 1953 г. У. Роу и др. из культуры клеток аденоидов (миндалин) детей, в которых они вызывали ЦПД. В настоящее время известно более 90 серотипов аденовирусов млекопитающих. Из них 49 серотипов являются патогенными для человека. Структура и химический состав. Нуклеокапсид вириона представляет собой сферические частицы диаметром 70-90 нм. Капсид построен из 252 капсомеров по кубическому типу симметрии в форме икосаэдра. От 12 вершин икосаэдра отходят отростки - фибры (нити). Внешняя оболочка отсутствует. Аденовирусы состоят из ДНК и белков. Геном аденовирусов состоит из двунитевой линейной ДНК с молекулярной массой 20-25 мД. С молекулой ДНК ковалентно связан внутренний белок, инициирующий репликацию ДНК. Внутренние белки в комплексе с ДНК формируют сердцевину вириона, расположенную под вершинами капсида. Антигены. В составе капсида содержатся типоспецифические антигены - гликопротеиновые нити, которые обладают гемагглютинирующими свойствами. Нуклеокапсид вириона является комплементсвязывающим антигеном, идентичным для разных серотипов аденовирусов человека. Культивирование и репродукция. Аденовирусы культивируют в первичной культуре клеток почки эмбриона человека, линии клеток Hela, Нер-2 и др. ЦПД аденовирусов связано не только с их репродукцией, но и прямым токсическим действием. Аденовирусы адсорбируются на клеточных рецепторах с помощью нитей. Депротеинизация проникших в клетку вирионов начинается в цитоплазме и завершается в ядре, где освобождается ДНК с прикрепленным к ней терминальным белком. Транскрипция генома и репликация вирусной ДНК происходят в ядре с помощью клеточных ферментов. Вначале синтезируются иРНК, кодирующие синтез вирусоспецифических ферментов, а затем иPHK, несущие информацию о синтезе капсидных белков и нитей. Сборка вирусных частиц происходит в ядре, где образуются кристаллоподобные включения. В каждой клетке синтезируется несколько сотен вирусных частиц. Выход аденовирусов сопровождается разрушением клетки хозяина. Цикл репродукции аденовирусов в клетке продолжается 14-24 ч. Патогенез. В организме человека первичная репродукция аденовирусов происходит в эпителиальных клетках слизистой оболочки дыхательных путей и кишечника, в конъюнктиве глаза и в лимфоидной ткани (миндалины, мезентериальные лимфатические узлы). При циркуляции в крови аденовирусы поражают эндотелий сосудов. Это приводит к экссудативному воспалению слизистых оболочек, к образованию фибринозных пленок и некрозу. Аденовирусы могут проникать через плаценту, вызывая внутриутробные заболевания, аномалии развития плода, смертельные пневмонии новорожденных. Чаще всего аденовирусы вызывают острые респираторные заболевания (фарингиты, ларингиты, трахеобронхиты). У детей и у пожилых людей могут развиться затяжные формы мелкоочаговой или интерстициальной аденовирусной пневмонии (серотипы 3,4, 7, 14). Для аденовирусной инфекции характерно сочетанное поражение слизистой оболочки и лимфоидных тканей миндалин, аденоидов и конъюнктивы глаза (фаринго-конъюнктивальная лихорадка). Нередки случаи эпидемических вспышек конъюнктивитов одного или обоих глаз (серотипы 3,4, 8, 19). Аденовирусные конъюнктивиты и кератоконъюнк-тивиты нередко являются госпитальными инфекциями. Кишечные аденовирусы (серотипы 40, 41) вызывают у детей младшего возраста вспышки гастроэнтерита. В некоторых случаях наблюдаются длительная персистенция аденовирусов в организме человека и переход в хроническую форму инфекции (хронические тонзиллиты, гаймориты, ангины и др.). У детей возможна аллергизация организма, сопровождающаяся развитием астматического бронхита и ларинготрахеита. Ряд серотипов аденовирусов индуцирует опухоли у животных.
52. Для культивирования вирусов используют культуры клеток, куриные эмбрионы и чувствительных лабораторных животных. Эти же методы используют и для культивирования риккетсий и хламидий — облигатных внутриклеточных бактерий, которые не растут на искусственных питательных средах. Лабораторные животные. Видовая чувствительность животных к определенному вирусу и их возраст определяют репродуктивную способность вирусов. Во многих случаях только новорожденные животные чувствительны к тому или иному вирусу (например, мыши-сосунки — к вирусам Коксаки).Преимущество данного метода перед другими состоит в возможности выделения тех вирусов, которые плохо репродуцируются в культуре или эмбрионе. К его недостаткам относятся контаминация организма подопытных животных посторонними вирусами и микоплазмами, а также необходимость последующего заражения культуры клеток для получения чистой линии данного вируса, что удлиняет сроки исследования.
53. Термином «трансляция» называют механизмы, при помощи которых последовательность нуклеотидных оснований мРНК переводится в специфическую последовательность аминокислот в синтезируемом полипептиде. Этому процессу предшествует связывание мРНК с рибосомами. При этом (связывание мРНК и инициация трансляции) происходит «дискриминация» клеточных мРНК, и синтетические процессы на рибосомах переходят под вирусный контроль. Вирусные геномы кодируют синтезы двух классов белков: структурные белки входят в состав дочерних популяций, а неструктурные белки обслуживают процессы репродукции, но не входят в состав дочерних популяций (ингибиторы синтеза клеточных РНК и белков, протеазы и др.). Трансляция РНК-содержащих вирусов. Поскольку вирусный геном кодирует несколько белков, то возможно два варианта трансляции: 1) каждый полипептид синтезируется отдельно от других (тога- и ретровирусы); 2) сначала образуется большой полипептид-предшественник, который в дальнейшем «нарезается» на отдельные полипептиды (пара- и ортомиксовирусы, а также рабдо-, арена- и буньявирусы). Некоторые вирусы используют оба этих механизма. Полипептиды, образующиеся при обоих вариантах трансляции, могут подвергаться посттрансляционной модификации (гликозилирование, фосфорилирование или сульфатирование). Трансляция ДНК-содержащих вирусов. В трансляционных процессах доминирует трансляция отдельных мРНК, кодирующих индивидуальные полипептиды. В отдельных случаях (например, у аденовирусов) не менее трёх белков образуются путём нарезания общего полипептида-предшественника.
54. Особенности течения вирусной инфекции предполагает следующие терапевтические положения:препараты должны отличаться надежностью противовирусного действия при минимальном повреждающем воздействии на клетки макроорганизма;методы применения противовирусных средств ограничены недостаточными знаниями их фармакокинетики;эффективность противовирусных химиопрепаратов в конечном итоге во многом зависит от защитных сил организма, напряженности иммунитета;для практической медицины фактически недоступны методы определения чувствительности вирусов к применяемым химиопрепаратам. По химическому составу и механизму действия противовирусные средства разделяются на три группы: 1) химиопрепараты; 2) интерфероны; 3) индукторы интерферонов. Химиопрепараты. К противовирусным химиопрепаратам относятся аномальные нуклеозиды, производные адамантана, синтетические аминокислоты, аналоги пирофосфата, тиосемикарбазоны и другие вируцидные препараты. Указанные средства в большинстве своем эффективны при лечении гриппа и герпетической инфекции. К ним, к сожалению, быстро формируется резистентность, что существенно влияет на результаты лечения. При некоторых вирусных инфекциях, в частности герпетической, с обнадеживающими результатами использован препарат растительного происхождения - флакозид. Это флавоноид, полученный из растений бархата амурского и бархата Лаваля. Интерфероны (ИФН) относятся к биологическим противовирусным неспецифическим средствам. Они представлены практически во всех клетках организма и направлены на подавление репликации вирусов, их элиминацию и санацию организма. Механизм противовирусного действия ИНФ связан с блокадой синтеза вирусоспецифических белков путем распознавания и дискриминации информационных РНК.Препараты ИНФ делятся по составу на альфа-, бета- и гаммаинтерфероны, а по способу получения - на природные человеческие, лейкоцитарные (первого поколения) и рекомбинантные ИНФ (второго поколения).ИНФ эффективны для лечения вирусных гепатитов, герпеса, острых респираторных инфекций, ВИЧ-инфекций и некоторых других заболеваний. Есть основания полагать, что экзогенные интерфероны, кроме прямого противовирусного действия, оказывают положительное влияние на иммунную систему. Они, в частности, нормализуют регуляторные механизмы клеточного звена иммунитета, способствуют индукции клетками альфа и гамма интерферона.Индукторы интерферона представляют собой весьма разнообразную группу, высоко- и низкомолекулярных природных и синтетических соединений, способных вызвать образование интерферона в организме больного. Использования в комплексной терапии следующих индукторов интерферона: флуореонов, аналогов госсипола, сополимеров пирана, неовир и др. при герпетическом заболевании глаз, гриппе, риновирусной инфекции и прочих заболеваниях. Индукторы интерферона являются новой и весьма перспективной группой противовирусных препаратов.
55.В середине 30-х годов австралийский вирусолог Ф. Вернет «открыл» новое для вирусологии экспериментальное животное — куриные эмбрионы. Для заражения вирусами обычно используют 10—12-дневные куриные зародыши, у которых в это время хорошо развиты оболочки — хорионаллантоисная и амниотиче-ская. При заражении их разными вирусами может развиться вирусная инфекция. При этом размножение вируса происходит в течение 3—4 дней, когда иммунитет еще не успевает развиться.Использование куриных эмбрионов позволило выделить еще несколько вирусов человека — парагриппа, свинки, оспы, гриппа (последние два раньше были выделены от обезьян и хорьков). Однако главное достоинство куриных эмбрионов заключалось не в этом. При заражении экспериментальных животных, чувствительных к тому или иному вирусу, этот последний накапливается во внутренних органах или нервной ткани, откуда его трудно выделить в чистом виде, освободив от клеточных белков. Иное дело куриные эмбрионы: размножаясь в зародышевых оболочках, вирус выделяется в аллантоис-ную и амниотическую жидкость, где накапливается в громадных количествах (до нескольких миллиардов вирионов в 1 мл) В дальнейшем вирус может быть осажден в центрифуге и дополнительно очищен разными методами.Применение куриных эмбрионов привело к подлинной революции в изучении вирусов, которая была продолжена и завершена введением в вирусологическую технику метода культур тканей. Особенно важное значение имела техника культивирования вирусов в куриных эмбрионах для изучения вируса гриппа. Было обнаружено, что вирусы гриппа склеивают (агглютинируют) эритроциты зародыша курицы. На основе этого феномена была разработана техника реакции агглютинации эритроцитов, которая и до сих пор широко применяется для диагностики гриппа и многих других вирусных инфекций. Выделение препаратов очищенного вируса гриппа дало возможность исследовать химический состав вируса гриппа и других вирусов, размножающихся в куриных зародышах, изучить динамику их размножения и др. Техника работы с вирусами на куриных эмбрионах сохранила свое значение и в настоящее время. Кроме куриных эмбрионов, в некоторых случаях используются эмбрионы других птиц — уток, перепелок.
56. К медленным инфекциям относят подострый склерозирущий панэнцефалит (ПСПЭ). ПСПЭ болеют дети и подростки. Поражается ЦНС происходит медленное разрушение интелекта, двигательные нарушения, всегда летальный исход. В крови обнаруживается высокий уровень антител к коревому вирусу. В мозговой ткани были обнаружены возбудители кори. Проявляется заболевание сначала в недомогании, утрате памяти, затем появляется расстройства речи, афазия, расстройства письма -- аграфия, двоение в глазах, нарушение координации движений - апраксия; затем развиваются гиперкинезы, спастические параличи, больной перестает узнавать предметы. Затем наступает истощение больной впадает в коматозное состояние. При ПСПЭ наблюдаются дегенеративные изменения нейронов, в клетках микроглии -- эозинофильные включения. В патогенезе -- происхидит прорыв персистирующего вируса кори в ЦНС через гематоэнцефалический барьер. Частота заболеваемости ПСПЭ -- 1 заболевший на миллион. Диагностика -- с помощью ЭЭГ, определяют также тир противокоревых антител. Профилактика кори одновременно является профилактикой ПСПЭ. У вакцинироваанных против кори заболеваемость ПСПЭ в 20 раз меньше. Лечат интерфероном, но без особого успеха.
57. Интерфероны - это семейство секретируемых гликопротеинов продуцируемых большинством эукариотических клеток в ответ на различные индукторы вирусной и невирусной природы. Все интерфероны индуцируют в клетках-мишенях антивирусное состояние , а также имеют в отношении клеток ряд других биологических функций, например, ингибируют рост и размножение клеток , увеличивают экспрессию поверхностных антигенов, супрессируют некоторые функции Т-лимфоцитов и В-лимфоцитов , увеличивают активность натуральных киллеров и др.Свойства: Интерфероны обладают видотканевой специфичностью. Это означает, что интерферон человека действует только в организме человека, но неактивен в организме других биологических видов. Интерфероны не обладают специфичностью в отношении вирусов и действуют угнетающе на репродукцию различных вирусов, хотя разные вирусы обладают неодинаковой чувствительностью к интерферону. Интерфероны оказывают антивирусное, противоопухолевое, иммуномодулирующее и многие другие действия. Наиболее изучено их антивирусное действие, и именно на вирусных моделях выяснены биологические и другие свойства интерферонов. Интерферон является регулятором различных механизмов иммунного ответа, оказывая стимулирующее или угнетающее действие на иммунные реакции.
58.При использовании культур тканей, так же как и на куриных эмбрионах, удается получить очищенный вирус, который выделяется из клеток в жидкую культуральную среду. Отсюда его можно выделить, осадив в центрифуге, а затем очистить, применяя для этой цели разные методы.Вирусы размножаются только в живых клетках, и выделение возбудителя в заражённой культуре клеток — один из основных методов диагностики вирусных инфекций. Поскольку большинство патогенных вирусов отличает тканевая и типовая специфичность, то почти к каждому вирусу можно подобрать соответствующие клеточные или тканевые культуры, а также создать стандартные условия культивирования (наличие клеток одного типа). Размножение вируса обеспечивают чувствительные (пермиссивные) клетки. Поэтому при выделении неизвестного возбудителя проводят одномоментное заражение 3-4 культур клеток, предполагая, что одна из них может оказаться пермиссивной. Культуры клеток получают диспергированием соответствующих органов и тканей, но чаще используют эмбриональные ткани (человека и животных) либо трансформированные опухолевые клетки. При помещении на соответствующую плоскую поверхность клеточные культуры обычно растут в виде монослоя. Первично-трипсинизированные культуры. Суспензии клеток получают гомогенизированием соответствующих тканей, предварительно обработанных трипсином. Культуры часто представлены клетками смешанного типа и не подлежат повторному культивированию. Жизнеспособность таких культур составляет 2-3 нед. Полуперевиваемые линии клеток представлены диплоидными клетками человека и животных. Культуры ограниченно пригодны к повторному диспергированию и росту (как правило, не более 20-30 пересевов), сохраняя при этом жизнеспособность и не подвергаясь спонтанной трансформации. Перевиваемые линии клеток (гетероплоидные культуры) представлены клетками, подвергнутыми длительному культивированию и спонтанным трансформациям. Культуры способны к многократному диспергированию и перевиванию. Работа с ними менее трудоёмка по сравнению с приготовлениями первичных культур; перевиваемые клетки относительно одинаковы по своей морфологии и стабильны по свойствам. Культуры органов Не все виды клеток способны расти в виде монослоя, в некоторых случаях поддержание дифференцированных клеток возможно только в культуре органа. Обычно это суспензия ткани, обладающей специализированной функцией, также обозначаемая как культура переживающей ткани.
59.Приобретенные факторы антивирусногоиммунитета.Клеточные факторы:лимфоцит,макрофаги.
В отличие от антигенов бактерий, все вирусные антигены имеют белковую природу (гликопротеины, фосфопротеины, нуклео- протеины). Протективными свойствами обладают поверхностные белки, обеспечивающие слияние вируса с клеткой, и некоторые белки, расположенные в более глубоких слоях вируса. Процесс развития вируса в организме хозяина проходит две фазы: внеклеточную и внутриклеточную.
В развитии антивирусного иммунитета участвуют гуморальные и клеточные факторы. Особенности противовирусного иммунитета обусловлены своеобразием строения и биологии вирусов. Иммунитет направлен на нейтрализацию и удаление из организма вируса, его антигенов и зараженных вирусом клеток.
К основным клеточным факторам антивирусного иммунитета относятся специфические цитотоксические Т-лимфоциты, Т-хелперы, ЕК-клет- ки, Т-эффекторы ГЗТ, макрофаги.
Роль макрофагов в противовирусном иммунитете оценивается неоднозначно. Считается, что вирусы из-за очень малых размеров плохо фагоцитируются, проявляют большую устойчивость к лизосомальным ферментам, а некоторые из них, например вирусы медленных инфекций, кори и герпеса, даже размножаются в фагоцитах. В качестве самого серьезного довода против признания защитной роли фагоцитов в противовирусном иммунитете приводятся некоторые данные о том, что, мигрируя, макрофаги диссеминируют репродуцирующиеся в них вирусы на чувствительные клетки. Учитывая это, нельзя забывать, что макрофаги как антигенпрезентирующие клетки участвуют в выработке противовирусных антител, являются продуцентами интерферонов, активно поглощают зараженные вирусами клетки, медленно, но инактивируют многие вирусы. Наконец, способность макрофагов удерживать и переваривать вирусы постепенно нарастает и у взрослых животных выражена в большей степени, чем у новорожденных.
В обеспечении видового иммунитета существенную роль принадлежит Т- цитотоксическим лимфоцитам (Т- киллерам), а также главной системе гистосовместимости (подробнее- в следующих лекциях).
Т- киллеры по представлению антигенов главной системы гистосовместимости класса 1 распознают любые чужеродные антигены (включая мутантные, например- раковые клетки), атакуют и уничтожают их.
60. Индукция интерферонов(индукторы интерферона и их св-ва.)
Интерфероны — общее название, под которым в настоящее время объединяют ряд белков со сходными свойствами, выделяемых клетками организма в ответ на вторжение вируса. Благодаря интерферонам клетки становятся невосприимчивыми по отношению к вирусу. «Определяемый в качестве интерферона фактор должен быть белковой природы, обладать антивирусной активностью по отношению к разным вирусам, по крайней мере, в гомологичных клетках, опосредованной клеточными метаболическими процессами, включающими синтез РНК и белка» Интерфероны человека подразделяют на группы в зависимости от типа клеток, в которых они образуются: α, β и γ. α-Интерфероны включают несколько видов белков с молекулярной массой около 20 кДа. Особое значение имеют интерфероны альфа-2b (для лечения вирусных заболеваний) и бета-1a (применяются для лечения рассеянного склероза).
Индукторы интерферона — это вещества природного или синтетического происхождения, стимулирующие в организме человека продукцию собственного интерферона, который способствует формированию защитного барьера, препятствующего инфицированию организма вирусами и бактериями, а также регулирует состояние иммунной системы и ингибирует рост злокачественных клеток. Перспективными интерфероногенами являются низкомолекулярные производные акридонуксусной кислоты (карбоксиметилакридон — CMA), а также различные производные флуоренонов. Примером известнейших лекарственных препаратов-индукторов интерферона являются циклоферон, тилорон. В 2000-2003 годах успешно прошел клинические испытания, а с 2005 года производится отечественный препарат кагоцел.
За пределами стран бывшего СССР индукторы интерферонов (в том числе в странах Западной Европы и Северной Америки) не зарегистрированы в качестве лекарственных средств, а их клиническая эффективность не опубликована в авторитетных научных журналах. [10]
Синтез интеферона в клетках инициируется различными биологическими и химическими агентами, включая вирусы , некоторые микроорганизмы и их антигены, природные и синтетические полирибонуклеотиды , митогены и др. При этом механизмы индукции интерферонов I и II типов, по-видимому, сильно различаются.
Индукторами интерферона I типа являются двуцепочечные РНК ( дцРНК ) вирусной или синтетической природы. Показано, что практически все вирусы, как РНК-, так и ДНК-содержащие являются индукторами интерферона, хотя по эффективности индукции они могут сильно различаться.
Наиболее эффективными индукторами IFN являются РНК-содержащие вирусы, такие как альфавирусы, ортомиксовирусы и парамиксовирусы. Двуцепочечные формы РНК этих вирусов образуются в процессе транскрипции и репликации вирусного генома вирусспецифическими РНК-полимеразами.
61.М-ды обнаружения вирусов в инфекционном материале.
Вирусологические методы исследования основаны также на иммунологических процессах (взаимодействие антигена с антителами), биологических свойствах вируса (способность к гемагглютинации, гемолизу, ферментативная активность), особенностях взаимодействия вируса с клеткой-хозяином (характер цитопатического эффекта, образование внутриклеточных включений и т.д.).В диагностике вирусных инфекций, при культивировании, выделении и идентификации вирусов, а также при получении вакцинных препаратов широко применяют метод культуры клеток. Для выделения вирусов применяют заражение восприимчивых лабораторных животных, куриных эмбрионов, но чаще всего используют культуру ткани. Наличие вируса обычно определяют по специфической дегенерации клеток (цитопатический эффект), образованию симпластов и синцитиев, обнаружению внутриклеточных включений, а также специфического антигена, выявляемого с помощью методов иммунофлюоресценции, гемадсорбции, гемагглютинации (у гемагглютинирующих вирусов) и т.д. Эти признаки могут обнаруживаться лишь после 2—3 пассажей вируса.Для выделения ряда вирусов, например вирусов гриппа, используют куриные эмбрионы, для выделения некоторых вирусов Коксаки и ряда арбовирусов — новорожденных мышей. Идентификацию выделенных вирусов проводят с помощью серологических реакций и других методов.При работе с вирусами определяют их титр. Титрование вирусов проводят обычно в культуре клеток, определяя наибольшее разведение вируссодержащей жидкости, при котором происходит дегенерация ткани, образуются включения и вирусоспецифические антигены. Для титрования ряда вирусов можно использовать метод бляшек. Бляшки, или негативные колонии вирусов, представляют собой очаги разрушенных под действием вируса клеток однослойной культуры ткани под агаровым покрытием. Подсчет колоний позволяет провести количественный анализ инфекционной активности вирусов из расчета, что одна инфекционная частица вируса образует одну бляшку. Бляшки выявляют путем окрашивания культуры прижизненными красителями, обычно нейтральным красным; бляшки не адсорбируют краситель и поэтому видны как светлые пятна на фоне окрашенных живых клеток. Титр вируса выражают числом бляшкообразующих единиц в 1 мл. Очистку и концентрацию вирусов обычно осуществляют путем дифференциального ультрацентрифугирования с последующим центрифугированием в градиентах концентраций или плотности. Для очистки вирусов применяют иммунологические методы, ионно-обменную хроматографию, иммуносорбенты и т.д. Лабораторная диагностика вирусных инфекций включает обнаружение возбудителя или его компонентов в клиническом материале; выделение вируса из этого материала; серодиагностику. Выбор метода лабораторной диагностики в каждом отдельном случае зависит от характера заболевания, периода болезни и возможностей лаборатории. Современная диагностика вирусных инфекций основана на экспресс-методах, позволяющих получать ответ через несколько часов после взятия клинического материала в ранние сроки после заболевания, К ним относятся электронная и иммунная электронная микроскопия, а также иммунофлюоресценция, метод молекулярной гибридизации, выявление антител класса lgM и др.
Электронная микроскопия вирусов, окрашенных методом негативного контрастирования, позволяет дифференцировать вирусы и определять их концентрацию. Применение электронной микроскопии в диагностике вирусных инфекций ограничивается теми случаями, когда концентрация вирусных частиц в клиническом материале достаточно высокая (105 в 1 мл и выше). Недостатком метода является невозможность отличать вирусы, принадлежащие к одной таксономической группе. Этот недостаток устраняется путем использования иммунной электронной микроскопии. Метод основан на образовании иммунных комплексов при добавлении специфической сыворотки к вирусным частицам, при этом происходит одновременная концентрация вирусных частиц, позволяющая идентифицировать их. Метод применяют также для выявления антител. В целях экспресс-диагностики проводят электронно-микроскопическое исследование экстрактов тканей, фекалий, жидкости из везикул, секретов из носоглотки. Электронную микроскопию широко используют для изучения морфогенеза вируса, ее возможности расширяются при применении меченых антител.Метод молекулярной гибридизации, основанный на выявлении вирусоспецифических нуклеиновых кислот, позволяет обнаружить единичные копии генов и по степени чувствительности не имеет себе равных. Реакция основана на гибридизации комплементарных нитей ДНК или РНК (зондов) и формировании двунитчатых структур. Наиболее дешевым зондом является клонированная рекомбинантная ДНК. Зонд метят радиоактивными предшественниками (обычно радиоактивным фосфором). Перспективно использование колориметрических реакций. Существует несколько вариантов молекулярной гибридизации: точечная, блот-гибридизация, сэндвич-гибридизация, гибридизация in situ и др.Серологические методы в вирусологии основаны на классических иммунологических реакциях: реакции связывания комплемента, торможения гемагглютинации, биологической нейтрализации, иммунодиффузии, непрямой гемагглютинации, радиального гемолиза, иммунофлюоресценции, иммуноферментного, радиоиммунного анализа. Разработаны микрометоды многих реакций, техника их непрерывно совершенствуются. Эти методы используют для идентификации вирусов с помощью набора известных сывороток и для серодиагностики с целью определения нарастания антител во второй сыворотке по сравнению с первой (первую сыворотку берут в первые дни после заболевания, вторую — через 2—3 нед.). Диагностическое значение имеет не менее чем четырехкратное нарастание антител во второй сыворотке. Если выявление антител класса lgM свидетельствует о недавно перенесенной инфекции, то антитела класса lgC сохраняются в течение нескольких лет, а иногда и пожизненно. Антитела класса lgM появляются раньше, чем антитела класса G (на 3—5-й день болезни) и исчезают через несколько недель, поэтому их обнаружение свидетельствует о только что перенесенной инфекции. Антитела класса lgM выявляют методом иммунофлюоресценции или с помощью иммуноферментного анализа, используя анти- m-антисыворотки (сыворотки против тяжелых цепей lgM).
62.Приобретенные факторы антивирусного иммунитета.Вирусные иммуноглобулины.
Антитела (иммуноглобулины, ИГ, Ig) — это особый класс гликопротеинов, присутствующих на поверхности B-лимфоцитов в виде мембраносвязанных рецепторов и в сыворотке крови и тканевой жидкости в виде растворимых молекул, и обладающих способностью очень избирательно связываться с конкретными видами молекул, которые в связи с этим называют антигенами. Антитела являются важнейшим фактором специфического гуморального иммунитета. Антитела используются иммунной системой для идентификации и нейтрализации чужеродных объектов — например, бактерий и вирусов. Антитела выполняют две функции: антиген-связывающую и эффекторную (вызывают тот или иной иммунный ответ, например, запускают классическую схему активации комплемента).
Антитела синтезируются плазматическими клетками, которыми становятся некоторые В-лимфоциты в ответ на присутствие антигенов. Для каждого антигена формируются соответствующие ему специализировавшиеся плазматические клетки, вырабатывающие специфичные для этого антигена антитела. Антитела распознают антигены, связываясь с определённым эпитопом — характерным фрагментом поверхности или линейной аминокислотной цепи антигена.
Антитела состоят из двух лёгких цепей и двух тяжелых цепей. У млекопитающих выделяют пять классов антител (иммуноглобулинов) — IgG, IgA, IgM, IgD, IgE, различающихся между собой по строению и аминокислотному составу тяжёлых цепей и по выполняемым эффекторным функциям.
63. Интерфероны - это белки, которые производят клетки нашего организма в ответ на вторжение вирусов. Действуют они таким образом, что клетка становится невосприимчивой к воздействию инфекции. Противовирусные лекарства, созданные на основе интерферонов, могут иметь естественное, эндогенное происхождение или получаться генно-инженерным путем. Также имеют распространение препараты, которые являются производными или химическими аналогами эндогенных интерферонов. Данные противовирусные средства часто используются при гриппе как средство, ускоряющее выздоровление и снижающее риск возможных осложнений. Благодаря интерферонам клетки становятся невосприимчивыми по отношению к вирусу. Классификация Интерфероны человека подразделяют на группы в зависимости от типа клеток, в которых они образуются: α, β и γ.
Выяснилось, что интерферон альфа обладает уникальной способностью почти мгновенно запускать механизмы уничтожения вирусов, патогенных бактерий и грибков, аллергенов и других антигенов. Благодаря альфа интерферону обеспечивается координация действий различных клеток иммунной системы, останавливающих рост и размножение инфекционных агентов. Интерферон альфа предотвращает и замедляет действие Т-супрессоров, подавляющих иммунный ответ В-лимфоцитов и других Т-лимфоцитов на антигены. Интерферон альфа за счет увеличения количества рецепторов на мембране иммунных клеток усиливает процесс захвата и поглощения ими чужеродных агентов, активирует выработку специфических антител, разрушающих антигены. Интерферон альфа участвует в формировании механизма защиты против внутриклеточных возбудителей. Под его воздействием усиливается образование белков на клеточной мембране, тем самым улучшается процесс распознавания и уничтожения антигенов Т-клетками.
Фармакологическое действие. Человеческий фибробластный бета-интерферон, который получают посредством супериндукиии фибробластов человека стимулятором Poll I : С в присутствии ингибиторов обменных процессов. Является высоковидоспеиифическим гликопротеином (сложным белком) с молекулярной массой 200 000 дальтон, который при контакте со специфическими мембранными рецепторами продуцирует синтез мРНК (матричной рибонулеиновой кислоты) и клеточных белков, препятствующих нормальной репродукции (размножению) вирусов. Препарат обладает противовирусной, а также иммуномодулируюшей (влияющей на защитные свойства организма) и противоопухолевой активностью. Стимулирует фагоцитоз (процесс активного захвата и уничтожения фагоцитами /клетками крови/ болезнетворных микроорганизмов), образование антител (белков крови, образующихся в ответ на попадание в организм чужеродных белков и токсинов) и лимфокинов (биологически активных веществ, образующихся клетками, участвующими в выработке иммунитета /защитных сил организма/), усиливает цитотоксичность (повреждающее клетки действие) NK -клеток и макрофагов (клеток крови, способные захватить и уничтожить болезнетворные микробы).
Гамма-интерферон представляет собой и важнейший фактор, активирующий макрофаги ; он способствует более эффективному уничтожению макрофагами внутриклеточных микроорганизмов, запуская поврежденные ранее микробицидные механизмы макрофагов и вызывая гибель внутриклеточных микроорганизмов. Кроме того, гамма-интерферон действует синергично с клеточным ядом, лимфотоксином , индуцируя экспрессию рецепторов лимфотоксина на клетках мишенях. Интерферон гамма способен подавить пролиферацию клеток эритроидного ростка, выработку эритропоэтина почками и высвобождение железа из макрофагов.
64. Применение метода гемагглютинации в вирусологии.
-Агглютинация представляет собой склеивание клеток или отдельных частичек — носителей антигена с помощью иммунной сыворотки к этому антигену.
-Реакция пассивной, или непрямой, гемагглютинации (РПГА, РНГА). В ней используют эритроциты или нейтральные синтетические материалы (например, частицы латекса), на поверхности которых сорбированы антигены (бактериальные, вирусные, тканевые) или антитела. Их агглютинация происходит при добавлении соответствующих сывороток или антигенов. Эритроциты, сенсибилизированные антигенами, называют антигенным эритроцитарным диагностикумом и используют для выявления и титрования антител. Эритроциты, сенсибилизированные антителами. называют иммуноглобулиновыми эритроцитарными диагностикумами и применяют для выявления антигенов. Реакцию пассивной гемагглютинации используют для диагностики заболеваний, вызванных вирусами (грипп, аденовирусные инфекции, вирусный гепатит В, корь, клещевой энцефалит, крымская геморрагическая лихорадка и др.).
-Реакция торможения гемагглютинации (РТГА) основана на феномене предотвращения (торможении) иммунной сыворотки гемагглютинации эритроцитов вирусами, используется для выявления и титрования противовирусных антител. Она служит основным методом серодиагностики гриппа, кори, краснухи, эпидемического паротита, клещевого энцефалита и других вирусных инфекций, возбудители которых обладают гемагглютинирующими свойствами. например, для серодиагностики клещевого энцефалита в лунки панели разливают двукратные разведения сыворотки больного на щелочном боратном буферном растворе. Затем добавляют определенное количество, обычно 8 АЕ (агглютинирующих единиц), антигена клещевого энцефалита и после 18 ч экспозиции при t°4° вносят взвесь гусиных эритроцитов, приготовленную на кислом фосфатно-буферном растворе. Если в сыворотке крови больного есть антитела к вирусу клещевого энцефалита, то антиген нейтрализуется и агглютинация эритроцитов не происходит.
66. Система интерферона(ИФН) — важнейший фактор неспецифической резистентности организма человека.Открыли интерферон Айзексом и Линденманном 1957г.В настоящее время интерферон относят к классу индуцируемых белков клеток позвоночных. Важнейшие их функции: антивирусная, противоопухолевая, иммуномодулирующая и радиопротективная.
Различают три ИФН: а-ИФН синтезируют лейкоциты периферической крови; бета-ИФН синтезируют фибробласты ; у-ИФН — продукт стимулированных Т-лимфоцитов, макрофагов. По способу образования различают интерферон типа I (образуется в ответ на обработку клеток вирусами, молекулами двухцепочечной РНК, полинуклеотидами и радом низкомолекулярных природных и синтетических соединений) и ИФН типа II (продуцируется лимфоцитами и макрофагами, активированными различными индукторами; действует как цитокин.Интерферон I. Основной биологический эффект — подавление синтеза вирусных белков.Интерферон II (бета-интерферон) активирует эффекторные функции NK-клеток, Т-лимфоцитов, моноцитов, тканевых макрофагов и гранулоцитов, проявляющих антителозависимую и антите-лонезависимую цитотоксичность,блокирует депротеинизацию («раздевание») вирусов, высвобождение зрелых вирусных частиц из клетки, а также нарушает метилирование вирусной РНК. В смешанных культурах интерферон-чувствительных и интерферон-резистентных клеток «антивирусное состояние» чувствительных клеток распространяется и на популяции резистентных клеток.
Интерферон подавляет репродукцию вирусов, воздействуя на транскрипцию их геномов тремя различными способами.
Первый способ состоит в индукции синтеза 2',5'-олигоаденилатсинтетазы . В присутствии двухцепочечной РНК 2',5'-олигоаденилатсинтетаза полимеризует АТФ с образованием 2',5'-олигоаденилатов, которые в свою очередь активируют рибонуклеазу L , разрушающую одноцепочечные РНК.
Второй способ заключается в индукции синтеза протеинкиназы PKR . Эта протеинкиназа, которая также активируется двухцепочечной РНК, путем фосфорилирования блокируетфактор инициации трансляции eIF2альфа , что приводит к подавлению синтеза белка в зараженной клетке.
В основе третьего способа лежит индукция синтеза белков Мх , обладающих ГТФазной активностью и имеющих особое значение для подавления репродукции вирусов гриппа ивезикулярного стоматита .
Интерфероны действуют неизбирательно, блокируя синтез не только вирусных, но и клеточных РНК и белков, что, вероятно, и приводит к гибели зараженной клетки.
67. Иммунологические методы исследования — диагностические методы исследования, основанные на специфическом взаимодействии антигенов и антител.И.м широко применяют в лабораторной диагностике инфекционных болезней. Этиологию заболевания устанавливают также на основании прироста антител к возбудителю в сыворотке крови реконвалесцента по сравнению с пробой, взятой в первые дни болезни. На основе И. м. и. изучают иммунитет населения по отношению к массовым инфекциям, например к гриппу, а также оценивают эффективность профилактических прививок. В зависимости от их механизма и учета результатов выделяют:1.Реакции, основанные на феномене агглютинации. Агглютинация представляет собой склеивание клеток или отдельных частичек — носителей антигена с помощью иммунной сыворотки к этому антигену. Реакцию агглютинации бактерий используют для диагностики многих инфекционных болезней: бруцеллеза, туляремии, брюшного тифа и паратифов, бациллярной дизентерии, сыпного тифа,для определения группы крови.2. Реакции, основанные на феномене преципитации. Преципитация происходит в результате взаимодействия антител с растворимыми антигенами. Простейшим примером реакции преципитации является образование в пробирке непрозрачной полосы преципитации на границе наслоения антигена на антитело.Каждая пара антиген — антитело формирует индивидуальную полосу преципитации, и реакция не зависит от наличия в исследуемой системе других антигенов и антител.3.Реакция связывания комплемента позволяет титровать антигены или антитела по степени фиксации комплемента комплексом антиген — антитело. Реакцию применяют для серодиагностики сифилиса (реакция Вассермана), вирусных и бактериальных инфекций.4.Реакция нейтрализации основана на способности антител нейтрализовать некоторые специфические функции макромолекулярных или растворимых антигенов, например активность ферментов, токсины бактерий, болезнетворность вирусов. Реакцию используют для обнаружения антистрептолизинов, антистрептокиназы и антистафилолизинов.5.Реакции с использованием химических и физических меток. (ИФА)Иммунофлюоресценция заключается в использовании меченных флюорохромом антител. Меченное флюорохромом антитело образует с антигеном комплекс антиген — антитело, который становится доступным наблюдению под микроскопом в УФ-лучах, возбуждающих свечение флюорохрома. Реакцию используют для изучения кл антигенов, выявления вируса в зараженных клетках и обнаружения бактерий и риккетсий в мазках,для диагностики бешенства. 6.Иммуноблоттинг состоит из 3 этапов: разделения биологических макромолекул на отдельные белки с помощью электрофореза в полиакриламидном геле; переноса разделенных белков из геля на твердую подложку; выявления на подложке искомых .Используют при диагностике ВИЧ-инфекции.
68. Размножение (репликация) вирусов - процесс, в ходе которого вирус, используя собственный генетический материал и синтетический аппарат клетки-хозяина, воспроизводит подобное себе потомство. В самом общем виде репликация вируса на уровне единичной клетки складывается из нескольких последовательных стадий:--прикрепление вируса к клеточной поверхности;--проникновение через наружные мембраны клетки;--обнажение генома;--синтез (транскрипция) нуклеиновой кислоты вируса с образованием дочерних молекул геномной НК и, в случае ДНК-содержиших вирусов, информационной вирусной мРНК;--синтез вирус-специфических белков;--сборка новых вирионов и выход их из пораженной клетки.
Прохождение всех указанных стадий составляет один цикл размножения. На уровне системы клеток в виде ткани или органа циклы размножения часто бывают асинхронными, и вирус из пораженных клеток проникает в здоровые. В эксперименте синхронизации циклов репликации удается достичь за счет высокой множественности заражения, при которой на каждую клетку приходится не менее 10 инфекционных частиц вируса. Размножение вируса обычно сопровождается подавлением биологических функций клетки и нарушениями в клеточном метаболизме, в крайней форме оно ведет к полному разрушению клетки с высвобождением вирусного потомства (цитопатогенный эффект).
Репликация вируса осуществляется в цитоплазме. Сборка клеток хозяина, заполнение капсида также осуществляются в цитоплазме; высвобождение вируса сопровождается лизисом клетки.
69. Вакцины — иммунобиологические препараты, предназначенные для активной иммунопрофилактики, то есть для создания активной специфической невосприимчивости организма к конкретному возбудителю. Вакцин разделяют на живые, инактивированные (убитые, неживые), молекулярные (анатоксины) генно инженерные и химические; по наличию полного или неполного набора Аг — на корпускулярные и компонентные, а по способности вырабатывать невосприимчивость к одному или нескольким возбудителям — на моно- и ассоциированные.
Живые вакцины — препараты из аттенуированных (ослабленных) либо генетически изменённых патогенных микроорганизмов, а также близкородственных микробов, способных индуцировать невосприимчивость к патогенному виду . Поскольку все живые вакцины содержат микробные тела, то их относят к группе корпускулярных вакцинных препаратов. Наиболее известны вакцина против возбудителя жёлтой лихорадки, противополи-омиелитная вакцина Сэйбина, вакцины против гриппа, кори, краснухи, паротита и аденовирусных инфекций. Дивергентные вакцины . В качестве вакцинных штаммов используют микроорганизмы, находящиеся в близком родстве с возбудителями инфекционных болезней. Аг таких микроорганизмов индуцируют иммунный ответ, перекрёстно направленный на Аг возбудителя. Наиболее известны и длительно применяются вакцина против натуральной оспы (из вируса коровьей оспы) и БЦЖ для профилактики туберкулёза (из микобактерий бычьего туберкулёза).
70. Для выделения вирусов применяют заражение восприимчивых лабораторных животных, куриных эмбрионов, но чаще всего используют культуру ткани. Наличие вируса обычно определяют по специфической дегенерации клеток (цитопатический эффект), образованию симпластов и синцитиев, обнаружению внутриклеточных включений.
Для выделения вирусов используют куриные эмбрионы, для выделения некоторых вирусов Коксаки и ряда арбовирусов — новорожденных мышей. Идентификацию выделенных вирусов проводят с помощью серологических реакций и других методов.
При работе с вирусами определяют их титр. Титрование вирусов проводят обычно в культуре ткани, определяя наибольшее разведение вируссодержащей жидкости, при котором происходит дегенерация ткани, образуются включения и вирусоспецифические антигены. Для титрования ряда вирусов можно использовать метод бляшек. Бляшки, или негативные колонии вирусов, представляют собой очаги разрушенных под действием вируса клеток однослойной культуры ткани под агаровым покрытием. Подсчет колоний позволяет провести количественный анализ инфекционной активности вирусов из расчета, что одна инфекционная частица вируса образует одну бляшку. Бляшки выявляют путем окрашивания культуры прижизненными красителями, обычно нейтральным красным; бляшки не адсорбируют краситель и поэтому видны как светлые пятна на фоне окрашенных живых клеток. Титр вируса выражают числом бляшкообразующих единиц в 1 мл.
Очистку и концентрацию вирусов обычно осуществляют путем дифференциального ультрацентрифугирования с последующим центрифугированием в градиентах концентраций или плотности. Для очистки вирусов применяют иммунологические методы, ионно-обменную хроматографию, иммуносорбенты и т.д.
71. Фаги способны изменять все свои свойства: форму и размеры негативных колоний, спектр литического действия, способность к адсорбции на микробной клетке, устойчивость к внешним воздействиям, антигенные свойства. Особенно часто наблюдаются изменения морфологии негативных колоний, спектра литического действия и превращение умеренных фагов в вирулентные.Изменения фагов могут быть наследственными (мутации) и ненаследствеипыми (фенотипические). Фенотипические изменения зависят от условий, в которых образуются фаговые частицы. Выд два механизма изменчивости клеток под влиянием фагов:Трансдукция (перенос). При размножении определенных умеренных фагов на чувствительных к ним культурах фаговая частица захватывает какой-нибудь фрагмент генетического материала данной клетки. При воздействии этим же фагом на другую чувствительную к нему культуру он передает новой культуре захваченный фрагмент. При трансдукции фаг играет роль механического переносчика. Один фаг может переносить разные свойства.Трансдукция происходит редко: из одного и более миллионов фаговых частиц только одна способна осуществлять трансдукцию. При помощи трансдукции удавалось перенести от клеток-доноров клеткам-реципиентам различные свойства: токсичность, устойчивость к антибиотикам, способность продуцировать определенные ферменты, антигенные и другие свойства.Лизогенные конверсии (превращения). Как уже отмечалось, при лизогенизации клеткахозяин приобретает устойчивость к данному фагу, а также способность продуцировать зрелые частицы этого фага, при лизогенизации клетка приобретает новые, точно определенные свойства, характер которых зависит от особенностей данного фага.В отличие от трансдукции, при которой фаг выступает в роли механического переносчика генетического материала, при лизогенизации сам фаг (вернее, его нуклеиновая кислота) является тем генетическим материалом, который в виде профага придается генетическому материалу клетки. Поэтому при лизогенизации не имеет значения культура, на которой размножался данный умеренный фаг.Наиболее детально лизогенные конверсии изучены у некоторых патогенных бактерий, преимущественно у дифтерийной палочки и сальмонелл.
72. Пассивная иммунизация - введение антител к каким-либо антигенам. С помощью пассивной иммунизации можно создать только временный иммунитет продолжительностью 1-6 нед. Хотя пассивная иммунизация вызывает кратковременное повышение устойчивости к возбудителю, ее действие проявляется немедленно. Повторная пассивная иммунизация не усиливает иммунитет и часто сопровождается осложнениями. Ее обычно проводят после контакта с возбудителем и при невозможности активной иммунизации.К пассивной иммунизации прибегают для создания временного иммунитета после контакта с возбудителем инфекции в тех случаях, когда активная иммунизация по тем или иным причинам не проводится заранее (например, против цитомегаловируса , против бешенства ). Пассивную иммунизацию применяют также для лечения заболеваний, вызванных бактериальными токсинами (в частности, дифтерии ), укусов ядовитых змей , укусов пауков и для специфической ( анти-Rh0(D)-иммуноглобулин ) и неспецифической ( антилимфоцитарный иммуноглобулин ) иммуносупрессии . Для пассивной иммунизации пользуются тремя видами препаратов: - нормальными человеческими иммуноглобулинами (устаревшее название- гаммаглобулин ) для в/м или в/в введения; - специфическими человеческими иммуноглобулинами с высоким содержанием антител против определенных возбудителей (например, против вируса гепатита В или против вируса varicella-zoster ); - специфическими сыворотками, в том числе антитоксическими, полученными от иммунизированных животных.
73. На основании особ-тей жизнен цикла бактериофаги раздел на 2 группы:- вирулентные бактериофаги — фаги, жизненный цикл которых завершается лизисом клетки хозяина и выходом зрелых фаговых частиц- умеренные или лизогенизирующие бактериофаги — фаги, способные после проникновения в бактериальную клетку переходить в состояние профага и длительное время реплицироваться совместно с бактериальным геномом, передаваясь очередному поколению бактерий. 1896 год - открытие бактериофагов Британским бактериологом Эрнестом Ханкин.1898 год - бактериофаги исследованы российским ученым Николаем Гамалея. В этом же году фаги стали использовать при лечении ран и различных инфекций.1920-е годы - Феликс Д'Эрель - канадский сотрудник Института Пастера (Париж) назвал бактериофаги «бактериофагами» и охарактеризовал их : «вирусы, размножающиеся в бактериях».1940-е годы - везде, кроме СССР разработки бактериофагов вычеркнуты из числа перспективных исследований. В СССР исследования продолжаются. Во всем мире популярность приобретает метод применения антибиотиков.
1980-е годы Эффективность лечения антибиотиками значительно понизилась. Бактерии выработали лекарственную устойчивость.Интерес к фаговой терапии возобновился.
Начало 2000-х годов - Гленн Моррис - сотрудник Университета Мэриленд (США) совместно с НИИ бактериофагов, микробиологии и вирусологии в Тбилиси наладил испытания фаговых препаратов для получения лицензии на их применение в США.
Июль 2007 года- бактериофаги одобрены для использования в США.
75. Под активной иммунизацией понимают стимуляцию иммунного ответа путем введения в организм антигена в той или иной форме. Повторная иммунизация способствует более выраженному иммунному ответу и повышению устойчивости к возбудителю. При инфекциях с длительным инкубационным периодом , например при бешенстве , активная иммунизация позволяет предупредить заболевание даже после заражения. Активная иммунизация была описана еще древнегреческим историком Фукидидом, заметившим, что люди, пережившие эпидемию чумы в Афинах, не заболевали ею при последующих эпидемиях.
Для активной иммунизации применяют два типа вакцин:
- содержащие живых ослабленных возбудителей (например, противокоревая )
- содержащие инактивированных возбудителей (например, противочумная ), их обезвреженные токсины (например, столбнячный анатоксин ) или специфические антигены. Среди последних встречаются рекомбинантные белковые антигены ( вакцина против гепатита В ) и углеводные антигены - в виде очищенных капсульных полисахаридов ( пневмококковая вакцина ) или полисахаридов, конъюгированных с белковым носителем, например с дифтерийным или столбнячным анатоксином ( вакцина против Haemophilus influenzae типа В ).
Для активной иммунизации против многих инфекций, в том числе полиомиелита и гриппа , используют оба типа вакцин.
Живые (аттенуированные) вакцины вызывают иммунный ответ, значительно более близкий к естественному ответу на инфекцию, чем инактивированные (убитые) вакцины. В зависимости от типа антигена активная иммунизация приводит к формированию временного или постоянного иммунитета.
Выпускаемые в настоящее время вакцины представлены в табл. 21.5 . В ней указаны дозы, путь введения, эффективность и побочные эффекты каждой вакцины. В Центре по контролю заболеваемости можно приобрести вакцины, находящиеся на стадии разработки. Их применяют только по специальным показаниям.
74. Взаимоотношения иммунитета и инфекции определяют развитие очень многих заболеваний. В полной мере сила и «разумность» инфекции проявляются в примере динамического противостояния живых систем - вирусной инфекции и иммунитета. Если вирус «спрятался» в клетках организма человека и заблокировал их апоптоз, то найти такую инфекцию и избавить организм от нее иммунная система может с помощью Т-клеток -киллеров. Они обнаруживают небольшие фрагменты вирусных белков, встроенных на поверхность инфицированной клетки. Задача Т-киллеров - выявить все инфицированные клетки и убить их путем апоптоза, чтобы не навредить соседним неинфицированным клеткам. Так и происходит в большинстве случаев, но когда Т-клетки-киллеры не обнаруживают признаков инфекции на поверхности инфицированных клеток и превращаются в бесполезное оружие иммунитета, на помощь приходят NK-клетки, имеющие точно такой же аппарат убийства других клеток, как и Т-киллеры. Такой иммунный контроль вирусной инфекции высокоэффективен. При встрече организма с вирусной инфекцией продукция интерферона (растворимого фактора, вырабатываемого вирус-инфицированными клетками, способного индуцировать антивирусный статус в неинфицированных клетках) становится наиболее быстрой реакцией на заражение, формируя защитный барьер на пути вирусов намного раньше специфических защитных реакций иммунитета, стимулируя клеточную резистентность, - делая клетки непригодными для размножения вирусов. Продукция и секреция цитокинов относятся к самым ранним событиям, сопутствующим взаимодействию микроорганизмов с макрофагами. Этот ранний неспецифический ответ на инфекцию важен по нескольким причинам: он развивается очень быстро, поскольку не связан с необходимостью накопления клона клеток, отвечающих на конкретный антиген; ранний цитокиновый ответ влияет на последующий специфический иммунный ответ. Интерферон активирует макрофаги, которые затем синтезируют интерферон-гамма, ИЛ-1, 2, 4, 6, ФНО, в результате макрофаги приобретают способность лизировать вирус-инфицированные клетки. Интерферон-гамма является специализированным индуктором активации макрофагов, который способен индуцировать экспрессию более 100 разных генов в геноме макрофага. Продуцентами этой молекулы являются активированные Т-лимфоциты (Тh1-тип) и естественные киллеры (NK-клетки). Интерферон-гамма индуцирует и стимулирует продукцию провоспалительных цитокинов (ФНО, ИЛ-1, 6), экспрессию на мембранах макрофагов, антигенов МНС II; гамма-интерферон резко усиливает антимикробную и противовоспалительную активность путем повышения продукции клетками супероксидных радикалов, а усиление иммунного фагоцитоза и антителоопосредованной цитотоксичности макрофагов под влиянием гамма-интерферона связано с усилением экспрессии Fc-рецепторов для JgG. Активирующее действие интерферона-гамма на макрофаги опосредовано индукцией секреции этими клетками ФНО -альфа. Максимум продукции ИЛ-4 наступает через 24-48 ч с момента активации клеток. При этом ИЛ-4 рассматривается как цитокин, ограничивающий иммуновоспалительные реакции и снижающий ответ организма на инфекцию, угнетая при этом экспрессию гамма-интерферона. Интерферон-гамма ин витро усиливает фагоцитарную активность нейтрофилов, что обусловлено усилением экспрессии Fc-рецепторов и поверхностных белков семейства интегринов на нейтрофилы. Это позволяет нейтрофилам осуществлять цитотоксические функции и фагоцитоз. Взаимодействие цитокина с клеткой определяется универсальной биологической системой, специфическим механизмом которой является рецепторный аппарат, связанный с восприятием метаболического кода. Для проявления биологической активности цитокина необходимо присутствие на поверхности чувствительных клеток специфических рецепторов, которые могут экспрессироваться параллельно с синтезом цитокина. Рецепторы цитокинов представляют собой комплексы, состоящие из двух и более рецепторных молекул, которые объединяются на мембране клетки-мишени и образуют высокоаффинный рецепторный комплекс. Большинство рецепторов состоит из отдельных молекул, связывающих цитокины, которые ассоциируются после связывания лиганда с сигналпередающим рецепторным компонентом; часть рецепторов существует как растворимые изоформы, способные связывать и растворять цитокины, а часть функционирует как многокомпонентные блоки; механизм комплексирования субъединиц рецепторов объясняет плейотропные и дублирующие эффекты цитокинов, имеющих большое структурное сходство.
76.Бактериофаги – (от бактерии и греч. fagos – пожиратель; синоним: фаг, бактериальный вирус)- вирус, поражающий бактерии.. Современная классификация бактериофагов включает 13 семейств, подразделенных более чем на 140 родов, которые содержат более 5300 видов фагов.Форма:Бактериофаги имеют размер 0,1-0,2 миллимикрона (миллионны доли миллиметра), что примерно составляет 1/1,000 часть от бактериальной клетки величиной около 5 микрон. Выглядят бактериофаги необычно. Есть среди бактериофагов такие, что похожи на маленькие космические станции: аккуратные кристаллы с четкими гранями, стоящие на ножках-фибриллах. Стенки корпуса кристалла выстроены из молекул белка, а внутри конструкции находится генная информация бактериофага – ДНК или РНК. Частицы сложноустроенных бактерий (напр. Т-четных бактерий) имеют головку и отросток, или "хвост". Головка состоит из белковой оболочки и заключённой в ней ДНК или РНК. В отростке различают полый стержень, окружённый чехлом, содержащим сократительные белки, подобные мышечным, и находящуюся на дистальном конце стержня базальную пластинку с шипами и нитями (от последних зависит специфическая адсорбция бактериофага на клетке-хозяине. Место обитания У бактериофагов очень разная морфология и среда обитания. Они живут везде, где есть бактерии: в воде, в почве, в каплях дождя, на поверхностях предметов, овощей, фруктов, на шерсти животных, на коже человека и внутри организма. Чем богаче среда микроорганизмами, тем больше в ней бактериофагов.Св-ва: Бактериофаги – естественные ограничители популяции бактерий.Каждый бактериофаг проникает в "свою" бактерию путем специального механизма и начинает там размножаться. Цикл - время с момента заражения бактерии до выхода потомства длится всего от 15 до 40 минут в зависимости от вида бактериофага.Бактериофаги строго избирательны. Есть бактериофаги стрептококковые, бактериофаги дизентерийные, бактериофаги стафилококковые и т.д., они существуют благодаря бактериям. Где есть бактерии, там есть и бактериофаги: в почве, воде ручья, озера, внутри организма и на коже человека, животного. В микромире бактериофаги играют роль естественных ограничителей численности бактерий. Количество бактериофагов колеблется в зависимости от количества бактерий. Если количество нужных бактериофагу бактерий снижается, то и бактериофагов становится меньше, иначе им негде будет размножаться. Поэтому бактериофаги ограничивают, но не уничтожают полностью популяцию бактерий. Соотношение бактериофагов и соответствующих бактерий находится в таком же балансе, как и соотношение хищников и грызунов в макромире.
80/крайней мере, в гомологичных клетках, опосредованной клеточными метаболическими процессами, включающими синтез РНК и белка».Система комплемента — комплекс сложных белков, постоянно присутствующих в крови. Это каскадная система протеолитических ферментов, предназначенная для гуморальной защиты организма от действия чужеродных агентов, она участвует в реализации иммунного ответа организма. Является важным компонентом как врождённого, так и приобретённого иммунитета.
78. Неканонические вирусы - белковые инфекционные частицы, являющиеся агентами белковой природы, имеющие вид фибрилл размером 10—20x100—200 нм.Прионы (от англ. proteinaceous infectious particles — белковые заразные частицы) — особый класс инфекционных агентов, чисто белковых, не содержащих нуклеиновых кислот, вызывающих тяжёлые заболевания центральной нервной системы человека и ряда высших животных.Открыты эти формы относительно недавно и ещё мало изучены. Прионы ведут к развитию медленных инфекций, вызывающих заболевания центральной нервной системы. Из-за длительного инкубационного периода ими болеют, в основном, пожилые люди. Смертность от медленных инфекций достигает 100%.Симптомы характерные для прионовых заболеваний: --Длительный инкубационный период (несколько лет). --Потеря мышечной координации, приводящей к проблемам с хождением, и другими сложными движениями. --Слабоумие, связанное с потерей памяти. --Бессонница.
Прионовые белки накапливаются в клетках ЦНС в течение развития заболевания, вызывая следующие повреждения:--Увеличение количества астроцитов. -- Истощение дендрито- Формирование в коре мозжечка многочисленных вакуолей (губчатая энцефал - Амилоидозис
Механизмы репродукции прионов
Первично репродукция прионов осуществляется в дендритных клетках, лимфатических железах, селезёнке и тимусе.
Прионы могут распространяться путём аксонального транспорта, из селезёнки через грудной лимфатический проток и далее по нервным стволам, наступает поражение головного мозга и верхних отделов спинного мозга. Штаммовые различия проявляются в длительности инкубационного периода, топографии поражаемых структур мозга, специфичности по отношению к хозяину.
77.. Клеточные факторы, который включает мононуклеарные фагоциты (моноциты, тканевые макрофаги), гранулоциты, нейтрофилы, эозинофилы, базофилы (периферической крови и тканевые или тучные клетки), а также киллерные клетки-естественные ( ЕК-клетки), просто киллеры[K- ] и лимфоинактивированные киллерные клетки (ЛАК-клетки).1 моноциты/макрофаги- полибласты, клетки мезенхимальной природы в животном организме, способные к активному захвату и перевариванию бактерий, остатков погибших клеток и других чужеродных или токсичных для организма частиц. Термин «макрофаги» введён Мечниковым. 2 Нейтрофильные гранулоциты, (НГ) или нейтрофилы, сегментоядерные нейтрофилы, нейтрофильные лейкоциты — подвид гранулоцитарных лейкоцитов, названный нейтрофилами за то, что при окраске по Романовскому они интенсивно окрашиваются как кислым красителем эозином, так и основными красителями, в отличие от эозинофилов, окрашиваемых только эозином, и от базофилов, окрашиваемых только основными красителями.3 Дендритные клетки это гетерогенная популяция антигенпрезентирующих клеток костномозгового происхождения. Морфологически дендритные клетки — крупные клетки (15-20 мкм) круглой, овальной или полигональной формы с эксцентрически расположенным ядром, многочисленными разветвлёнными отростками мембраны.[1] Термин «дендритные клетки» ввёл в 1973 году Ральф Штайнман из Рокфеллеровского университета
4 Естественные киллеры (нормальные) большие гранулярные лимфоциты, обладающие цитотоксичностью против опухолевых клеток и клеток, зараженных вирусами. В настоящее время NK-клетки рассматривают как отдельный класс лимфоцитов. NK выполняют цитотоксические и цитокин-продуцирующие функции. NK являются одним из важнейших компонентов клеточного врождённого иммунитета.
79. По характеру взаимодействия бактериофага с бактериальной клеткой различают вирулентные и умеренные фаги.Вирулентные фаги могут только увеличиваться в количестве посредством литического цикла.Процесс взаимодействия вирулентного бактериофага с клеткой складывается из нескольких стадий:адсорбции бактериофага на клетке, проникновения в клетку,биосинтеза компонентов фага и их сборки,выхода бактериофагов из клетки.Первоначально бактериофаги прикрепляются к фагоспецифическим рецепторам на поверхности бактериальной клетки.Хвост фага с помощью ферментов, находящихся на его конце (в основном лизоцима),локально растворяет оболочку клетки,сокращается и содержащаяся в головке ДНК инъецируется в клетку,при этом белковая оболочка бактериофага остаётся снаружи.Инъецированная ДНК вызывает полную перестройку метаболизма клетки:прекращается синтез бактериальной ДНК,РНК и белков.ДНК бактериофага начинает транскрибироваться с помощью собственного фермента транскриптазы, который после попадания в бактериальную клетку активируется. Синтезируются сначала ранние, а затем поздние иРНК, которые поступают на рибосомы клетки-хозяина, где синтезируются ранние и поздние белки бактериофага. Репликация ДНК бактериофага происходит по полуконсервативному механизму и осуществляется с участием собственных ДНК-полимераз. После синтеза поздних белков и завершения репликации ДНК наступает заключительный процесс — созревание фаговых частиц или соединение фаговой ДНК с белком оболочки и образование зрелых инфекционных фаговых частиц.Продолжительность этого процесса может составлять от нескольких минут до нескольких часов. Затем происходит лизис клетки, и освобождаются новые зрелые бактериофаги. Иногда фаг инициирует лизирующий цикл, что приводит к лизису клетки и освобождению новых фагов. В качестве альтернативы фаг может инициировать лизогенный цикл, при котором он вместо репликации обратимо взаимодействует с генетической системой клетки-хозяина, интегрируясь в хромосому или сохраняясь в виде плазмиды.->вирусный геном реплицируется синхронно с ДНК хозяина и делением клетки, а подобное состояние фага называется профагом. Бактерия, содержащая профаг, становится лизогенной до тех пор, пока при определённых условиях или спонтанно профаг не будет стимулирован на осуществление лизирующего цикла репликации. Переход от лизогении к лизису называется лизогенной индукцией или индукцией профага. На индукцию фага оказывает сильное воздействие состояние клетки хозяина предшествующее индукции, также как наличие питательных веществ и другие условия, имеющие место в момент индукции. Скудные условия для роста способствуют лизогенному пути, тогда как хорошие условия способствуют лизирующей реакции.Очень важным свойством бактериофагов является их специфичность: бактериофаги лизируют культуры определённого вида, более того, существуют так называемые типовые бактериофаги, лизирующие варианты внутри вида, хотя встречаются поливалентные бактериофаги, которые паразитируют в бактериях разных видов.
80. Гуморальный иммунитет. Гуморальные факторы противоинфекционной защиты человека представляют собой различные белки, растворимые в крови и жидкостях организма. Они могут сами обладать антимикробными свойствами или способны активировать другие гуморальные и клеточные механизмы противоинфекционного иммунитета. К неспецифическим гуморальным факторам иммунитета относятся: — циркулирующие в крови интерфероны — они повышают устойчивость клеток к действию вирусов, препятствуют из размножению в клетках;— С-реактивный белок крови — образует комплексы с возбудителями инфекции, вызывая тем самым активизацию системы комплемента, а также некоторые клетки иммунной системы (фагоциты и др.);— белки системы комплемента — обычно неактивны, но приобретают иммунологическую активность под воздействием других факторов иммунитета;— лизоцим — фермент, растворяющий клеточные стенки инфекционных микроорганизмов;— трансферрин — препятствует размножению микроорганизмов.К специфическим факторам гуморального иммунитета относятся белки, выделяемые клетками иммунной системы при специфической ее активации (интерлейкины, специфические антитела разных классов).Интерфероны — общее название, под которым в настоящее время объединяют ряд белков со сходными свойствами, выделяемых клетками организма в ответ на вторжение вируса. Благодаря интерферонам клетки становятся невосприимчивыми по отношению к вирусу. «Определяемый в качестве интерферона фактор должен быть белковой природы, обладать антивирусной активностью по отношению к разным вирусам, по
81. Новые вирусы: ВИЧ, гепатита С, гепатита GB, герпесвирусы 6, 7, 8, атипичной пневмонии, их характеристика и вызываемы ими заболевания.Вич относится к ретровирусам, и для него характерны все особенности жизненного цикла вирусов данного семейства. Геном ВИЧ представлен одноцепочечной молекулой РНК. В инфицированной клетке с помощью вирусного фермента – обратной транскриптазы (ревертазы) – на матрице вирусной РНК синтезируется двухцепочечная молекула ДНК, которая затем встраивается в какой-либо участок одной из хромосом клетки-хозяина. Интегрированная ДНК-копия ретровирусного генома называется провирусом. В таком состоянии ретровирус может долгое время сосуществовать с инфицированным организмом, никак себя не проявляя. Однако, получив определенные молекулярные сигналы, с провирусной ДНК инициируется транскрипция вирусной РНК, а с нее – синтез вирусных белков. Затем следуют сборка многочисленных вирусных частиц и выход их из клетки, приводящий в итоге к гибели зараженных клеток. Отличительное свойство ВИЧ прояется в том, что он адсорбируется на поверхности только тех клеток, которые содержат мембранный белок, называемый антигеном CD4. Такой поверхностный антиген в основном содержат T4-лимфоциты, являющиеся T-хелперами/индукторами (хелпер от англ. helper – помощник) и играющие важнейшую роль в координации работы всей иммунной системы человека. Уничтожение вирусом лимфоцитов этого типа и обусловливает иммуносупрессорное действие ВИЧ. До недавнего времени считалось, что вирусы ОРЗ, гепатита C и ВИЧ относятся к разным группам. Пол Элквист и его коллеги из Университета Висконсин–Мэдисон детально исследовали эти патогены и пришли к выводу, что все они произошли от одного предка.О родстве патогенов свидетельствует cходство в строении белковых оболочек вирусных частиц. К тому же, у всех этих вирусов аналогичный механизм репликации – т.е. копирования новых частиц. Выявление общих черт наиболее распространенных в мире вирусов может привести к созданию высокоэффективных лекарственных препаратов нового поколения. Тестирование ВИЧ-инфекции. Большинство вирусных инфекций (например, грипп, ветряная оспа) развиваются быстро, и врач их идентифицирует прежде всего по клиническим проявлениям у больного. В случае ВИЧ-инфекции такой подход неприменим, так как ее внешние проявления могут наблюдаться лишь спустя месяцы и годы после заражения. Поэтому всеобщее распространение получил метод обнаружения в крови человека антител к вирионным белкам ВИЧ. Первые варианты такого метода – метода иммуноферментного анализа (ИФА) были разработаны уже в 1984 г. Метод ИФА используют для массовых обследований. В случае положительного результата обязательно выполняют дополнительные анализы методически независимыми способами, обеспечивающие достоверность результатов. В частности, для выявления провирусной ДНК в клетках крови используется более чувствительный метод полимеразной цепной реакции (ПЦР). Стадии развития ВИЧ-инфекции. Разработка методов тестирования и многолетние наблюдения за ВИЧ-инфицированными пациентами позволили подробно изучить стадии развития данной инфекции. Согласно принятой классификации, заболевание в своем развитии проходит шесть стадий. --Первая стадия протекает, как правило, бессимптомно и длится 6–12 мес. после заражения. В это время происходит размножение ВИЧ, которое затем затухает. Содержание T4-лимфоцитов в крови при этом обычно близко к норме (около 800 клеток в 1 мл). --Вторая, самая протяженная по времени стадия (обычно 3–5 лет) характеризуется развитием хронической лимфо-аденопатии (увеличением лимфатических узлов) и постепенным снижением содержания T4-лимфоцитов в крови. Самочувствие больного на этой стадии все еще хорошее. --Снижение титра (концентрации) T4-лимфоцитов ниже 400 клеток/мл знаменует наступление третьей стадии, которая характеризуется скрытым (субклиническим) нарушением иммунной системы. --Четвертая стадия ВИЧ-инфекции по внешним проявлениям не отличается от предыдущей, но для нее характерны более глубокие изменения в иммунной системе, которые выявляются лишь дополнительными анализами. --На пятой стадии иммунная система больного угнетается настолько, что появляется клиническое проявление в виде грибкового поражения слизистых полости рта, называемого молочницей. К началу этой стадии концентрация T4-лимфоцитов в крови обычно становится менее 200 клеток/мл. Кроме молочницы на этой стадии часто развиваются стойкие вирусные и/или грибковые заболевания кожи и слизистых (например, хроническая инфекция вирусом простого герпеса). --Через 1-2 года после начала пятой стадии у больного развиваются так называемые хронические оппортунистические инфекции, вызываемые условно-патогенными микроорганизмами, что свидетельствует о глубоких нарушениях иммунной системы. Часто такой инфекцией является тяжелая пневмония, вызываемая простейшими Pneumocystis carinii (пневмоцистоз). Такие осложнения свидетельствуют о переходе ВИЧ-инфекции в последнюю шестую стадию, которая и называется СПИД. Содержание T4-лимфоцитов при этом обычно ниже 100 клеток/мл (у здорового человека – не менее 800 клеток/мл). Данная стадия длится, как правило, не более двух лет и завершается смертью больного. Россия, Украина и Беларусь при этом входят в число лидеров по темпам нарастания заболеваемости. В России, начиная с 1996 г., даже официальные данные регистрируют ежегодное увеличение количества больных в 2–3 раза. По разным подсчетам, в России на настоящий момент могут быть инфицированы от 220 тысяч до 1,5 миллионов человек.
84. Поксви́русы (лат. Poxviridae; англ. рох — «оспа» + вирусы; син. вирусы группы оспы) — семейство вирусов животных, объединяющее самые крупные ДНК-содержащие вирусы, вирионы которых имеют кирпичеобразную или овоидную форму; включает виды, патогенные для человека, например, возбудителей оспы, пустулезного дерматита.Геном, представленный двунитчатой линейной гантелеобразной формы ДНК, покрыт двухслойным капсидом, между слоями которого находятся боковые тела. Поверх нуклеокапсида расположена двухслойная липопротеидная оболочка с воронкообразными фибрами. Поксвирусы обладают наиболее сложным репродуктивным циклом, при этом синтезируется более 100 различных белков, входящих в состав вирионов (большинство образует наружную оболочку). Репродукция поксвирусов характеризуется следующими особенностями.--Транскрипция ДНК начинается до полной депротеинизации вируса, так как она полностью осуществляется вирусными полимеразами.--Репликация происходит только в цитоплазме и полностью независима от клеточных полимераз, так как, в отличие от прочих вирусов, поксвирусы имеют собственную ДНК-зависимую РНК-полимеразу, которая обеспечивает считывание более половины вирусного генома в течение начальной и ранней стадий--В репродуктивном цикле выделяют три стадии — начальную, раннюю и позднюю:--Начальная стадия репродукции поксвирусов запускается сразу же после раздевания вируса и выхода вирусной ДНК в цитоплазму.--Ранняя стадия репродукции поксвирусов. На этом этапе транскрибируется примерно половина вирусной ДНК. Синтезируются ферменты, кодируемые «ранними генами» и участвующие в репликации вирусной ДНК. Параллельно в небольшом количестве образуются структурные белки.--Поздняя стадия репродукции поксвирусов совпадает с началом репликации ДНК (что переключает механизмы транскрипции на считывание второй половины генома). Регуляторные белки блокируют трансляцию «ранней мРНК» и запускают синтез поздних (структурных) белков. Сборка вирионов осуществляется только в цитоплазме посредством реакций мембранного синтеза. Высвобождение зрелых популяций сопровождается лизисом клетки.
82. В рекомбинационном процессе между вирусами, имеющими полный сегментированный геном, происходит перетасовка (пересортировка) их фрагментов и образование рекомбинантов, содержащих родственные, но не свойственные для дикого типа гены, например гены гемагглютининов и неираминидаз других сероваров вируса гриппа типа А. При парных скрещиваниях мутантов с сегментированным геномом формирующиеся на их основе рекомбинанты приобретают полный геном дикого типа лишь в том случае, когда дефектные гены у них находятся в разных фрагментах. Если же обе мутации располагаются на идентичных фрагментах, полноценных рекомбинантов не возникает. Как предполагается, в любых случаях скрещивания РНК-вирусов с сегментированным геномом пересортировка его фрагментов происходит на стадии сборки вирионов при упаковке капсидов. Таким образом, в клетке, зараженной смешанной культурой родственных вирусов с интактными генами, возникают вирусы-рекомбинанты и реассортанты, а при одновременном ее инфицировании диким типом с его мутантом или несколькими мутантами – реактиванты. Генетического взаимодействия между биологически и эволюционно далекими вирусами в природе не происходит вследствие их высокой специфичности по спектру клеток-хозяев и интерференции, т. е. в естественных условиях из гетерогенных вирусных геномов гибридов не возникает. Долгое время невозможно было их получить in vitro искусственным путем. Впервые это удалось П. Бергу. В 1972 г. в Станфордеком университете (США) он сконструировал рекомбинантную (гибридную) ДНК из неполного генома вакуолизирующего клетки обезьяньего вируса SV-40 и части генома умеренного фага лямбда, открыв тем самым путь для дальнейшего исследования структуры и функции генетического аппарата вирусов, становления и развития генной инженерии.
83. Болезни вызываются вирусами — мельчайшими возбудителями инфекционных заболеваний растений и животных. Они настолько малы, что проходят сквозь бактериальные фильтры, за что и получили название фильтрующих вирусов.Вирусы могут размножаться только в живых клетках восприимчивого хозяина, но долго, иногда несколько десятков лет, сохраняются в мертвых, сухих растительных остатках и в почве, не теряя жизнеспособности.Вирусы очень широко распространены в природе, и вызываемые ими заболевания наносят большой вред. Вирусы гораздо менее специализированы, чем грибы и бактерии. Один и тот же вирус может вызывать болезни у многих видов растений.Передается вирусная инфекция от растения к растению различными путями: механическим поражением растения и внесением зараженного сока, например, при пересадке, пикировке или подвязке растений, прививкой больных растений на здоровые, то есть при всех работах с растениями, когда сок зараженного растения может попасть на руки цветовода, а при дальнейшем контакте — на здоровые растения.Источником опасности являются также насекомые — тли, цикады, щитовки, трипсы. Эти насекомые, имеющие сосущий ротовой аппарат, прокалывают с помощью стилета растительные клетки, не вызывая быстрой их гибели, и вносят вирус в растение.Симптомы вирусных болезней очень разнообразны, некоторые из них напоминают симптомы грибных и бактериальных болезней, а также болезней неинфекционного характера (увядание растений, некрозы тканей и другие). Это осложняет диагностику вирусных болезней, и иногда для их точного определения требуется проведение специальных исследований.Однако в ряде случаев болезни, вызываемые вирусами, имеют своеобразные симптомы, которые объединяют в две большие группы: мозаики и желтухи.Мозаика характеризуется неравномерной расцветкой пораженных органов (листьев), чередованием темно-зеленых и светло-зеленых участков или пятен разной величины и формы. Мозаичная расцветка часто имеет различные узоры: дуги, кольца, полоски, черточки, извилистые линии. При некоторых болезнях мозаичная расцветка обнаруживается на лепестках. Кроме изменения окраски, нередко происходит деформация листовой пластинки: морщинистость, курчавость, нитевидность. Мозаика проявляется в распаде хлоропластов, что ведет к ослаблению фотосинтеза, а затем к отмиранию отдельных клеток и участков ткани.Мозаичные болезни могут вызывать отставание в росте, но резко выраженной задержки роста не наблюдается. В зависимости от типа вируса симптомы могут проявляться более или менее ярко. При хорошем уходе и постоянных подкормках растения могут маскировать симптомы заболевания — лишь ил молодых листьях видна характерная мозаичность.Желтухи характеризуются равномерным обеднением листьев хлорофиллом, из-за чего они приобретают желтоватую или светлую окраску — общий хлороз. В листьях накапливается много крахмала, поэтому они становятся более жесткими и хрупкими, в некоторых случаях при сжатии не мнутся, а ломаются с хрустом. При поражении желтухой наблюдаются сильная задержка роста и развития растения и различные уродства цветков.Вирусные болезни типа желтухи часто поражают преимущественно сосудистую систему растений, вызывают гипертрофию ситовидных трубок, омертвение клеток, в результате чего задерживается отток питательных веществ, вырабатываемых листьями, и клетки забиваются крахмалом. Вирусные желтухи сильнее угнетают растение, чем мозаики, поскольку пораженными оказываются не отдельные органы (листья, лепестки), а вся сосудистая система.Способы лечения. Препаратов для лечения вирусных заболеваний растений не существует, поэтому пораженные вирусом растения уничтожают. Иногда заболевшее растение выглядит неплохо и его оставляют, однако в этом случае существует серьезная опасность распространения инфекции, особенно при появлении вредителей — переносчиков вирусов. Больное растение может заразить растения других видов.
86. Коронавирусы (лат. Coronaviridae) — семейство, включающее около 11 видов вирусов, поражающих человека, кошек, птиц, собак, крупный рогатый скот и свиней. Эти вирусы были открыты в 60-х годах у людей, болеющих острыми респираторными заболеваниямиСтроение Геном представлен (+) — однонитевой РНК. Нуклеокапсид окружён белковой мембраной и липосодержащей внешней оболочкой, от которой отходят шиповидные отростки, напоминающие корону.Культивируют на культуре тканей эмбриона человека.Клиника Коронавирусы вызывают острые респираторные и кишечные заболевания. Первичная репродукция в слизистой носоглотки и дыхательных путей, в результате возникает обильный насморк, а у детей — бронхиты и пневмонии. редставители рода коронавирусы имеют вирионы округлой формы диаметром 80—220 нм. Вирионы коронавирусов состоят из нуклеокапсида спиральной симметрии и гликопротеиновой оболочки, на поверхности которой имеются характерные далеко отстоящие друг от друга булавовидные выступы длиной 20 нм, образующие подобие солнечной короны. Некоторые коронавирусы, кроме того, имеют укороченные пепломеры длиной 5 нм. Коронавирусы содержат три или четыре основных структурных белка: нуклеокапсидный белок N; главный пепломерный гликопротеин S; трансмембранные гликопротеины М и Е. Некоторые вирусы, кроме того, содержат НЕ-белок. Торовирусы содержат те же белки, что и коронавирусы, но не содержат Е белок. Торовирус КРС содержит белок НЕ (М, 65000). Среди представителей рода коронавирусы различают три антигенные группы. У представителей рода коронавирусов обнаружены следующие структурные белки. Гликопротеин S (150—180 кД) образует большие выступы на поверхности вирионов.. НЕ гликопротеин присутствует в структуре некоторых коронавирусов. НЕ антиген представляет собой димер (65—70 кД), который формирует короткие отростки на поверхности вириона. Его отсутствие у многих коронавирусов указывает на то, что он не участвует в репликации этого семейства вирусов. М гликопротеин отличается от других гликопротеинов коронавирусов только коротким доменом, экспонированным на оболочке вириона. Моноклональные антитела против этого домена нейтрализуют вирус только в присутствии комплемента. Небольшой Е белок (9—12 кД) также находится в оболочке вириона. М и Е белки участвуют в формировании вириона и выходе его из клетки почкованием. Нуклеокапсидный белок N (50—60 кД) взаимодействует с геномной РНК, формируя нуклеокапсид вируса.
65. В связи с разнообразием структуры вирусов животных разнообразны и способы формирования вирионов, однако можно сформулировать следующие общие принципы сборки 1) у просто устроенных вирусов формируются провирионы, которые затем в результате модификаций белков превращаются в вирионы. У сложно устроенных вирусов сборка осуществляется многоступенчато — сначала формируются нуклеокапсиды или сердцевины, с которыми взаимодействуют белки наружных оболочек;2) сборка сложно устроенных вирусов (за исключением сборки вирусов оспы и реовирусов) осуществляется на клеточных мембранах. Сборка ядерных вирусов происходит с участием ядерных мембран, сборка цитоплазматических вирусов — с участием мембран эндоплазматической сети или плазматической мембраны, куда независимо друг от друга прибывают все компоненты вирусной частицы; 3) у ряда сложно устроенных вирусов существуют специальные гидрофобные белки, выполняющие функции посредников между сформированными нуклеокапсидами и вирусными гликопротеидами. Такими белками являются матриксные белки у ряда минус-нитевых вирусов (ортомиксо-, парамиксо-, рабдовирусов); 4) сборка нуклеокапсидов, сердцевин, провирионов и вири-онов происходит не во внутриклеточной жидкости, а в специальных структурах, предсуществующих в клетке или индуцированных вирусом («фабриках»);5) сложно устроенные вирусы для построения своих частиц используют ряд элементов клетки-хозяина, например липиды, некоторые ферменты, у ДНК-геномного SV40 — гистоны, у оболочечных РНК-геномных вирусов — актин, а в составе арена-вирусов обнаружены даже рибосомы. Клеточные молекулы несут определенные функции в вирусной частице, однако включение их в вирион может явиться и следствием случайной контаминации, как, например, включение ряда ферментов клеточных оболочек или клеточных нуклеиновых кислот.Сборка ДНК-содержащих вирусов. В сборке ДНК-содержащих вирусов есть некоторые отличия от сборки РНК-содержащих вирусов. Как и у РНК-содержащих вирусов, сборка ДНК-содержащих вирусов является многоступенчатым процессом с образованием промежуточных форм, отличающихся от зрелых вирионов по составу полипептидов. Первый этап сборки заключается в ассоциации ДНК с внутренними белками и формировании сердцевин или нуклеокапсидов. При этом ДНК соединяется с предварительно сформированными «пустыми» капси-дами.В результате связывания ДНК с капсидами появляется новый класс промежуточных форм, которые называются неполными формами. Помимо неполных форм с разным содержанием ДНК, существует другая промежуточная форма в морфогенезе — незрелые вирионы, отличающиеся от зрелых тем, что содержат ненарезанные предшественники полипептидов. Таким образом, морфогенез вирусов тесно связан с модификацией (процессингом) белков.Сборка ядерных вирусов начинается в ядре, обычно — в ассоциации с ядерной мембраной. Формирующиеся в ядре Промежуточные формы вируса герпеса почкуются в перинукле-арное пространство через внутреннюю ядерную мембрану, и вирус приобретает таким путем оболочку, которая является дериватом ядерной мембраны. Дальнейшая достройка и созревание вирионов происходят в мембранах эндоплазм этической сети и в аппарате Гольджи, откуда вирус в составе цитоплазматических везикул транспортируется на клеточную поверхность.У непочкующихся липидосодержащих вирусов (вирусов оспы) сборка вирионов происходит в уже описанных цитоплазматических «фабриках», Липидная оболочка вирусов в «фабриках» формируется из клеточных липидов путем автономной самосборки, поэтому липидный состав оболочек значительно отличается от состава липидов в клеточных мембранах Выход вирусных частиц из клеткиСуществует два способа выхода вирусного потомства из клетки: путем взрыва и путем почкования. Выход из клетки путем взрыва связан с деструкцией клетки, нарушением ее целостности, в результате чего находящиеся внутри клетки зрелые вирусные частицы оказываются в окружающей среде. Такой способ выхода из клетки присущ вирусам, не содержащим липопротеидной оболочки (пикорна-, рео-, парво-, папова-, аденовирусы). Однако некоторые из этих вирусов могут транспортироваться на клеточную поверхность до гибели клетки.Выход из клетки путем почкования присущ вирусам, содержащим липопротеидную мембрану, которая является дериватом клеточных мембран. При этом способе клетка может длительное время сохранять жизнеспособность и продуцировать вирусное потомство, пока не произойдет полное истощение ее ресурсов.
85. Реови́русы (лат. Reoviridae) (от англ. respiratory eteric orpha viruses) — семейство РНК-содержащих сферических вирусов. Обнаружены в 1959 году[1]. Вирусные частицы диаметром 60 — 80 нм. Размножаются в цитоплазме. Реовирусы необычайно устойчивы. Сохраняют инфекционные свойства при — 20 °C около 2 лет, 4 °C — более 70 дней, 37 °C — 15—20 дней. Не чувствительны к эфиру, кислотам, формалину. Реовирусы поражают преимущественно молодняк животных.Самым известным представителем реовирусов является ротавирус. Существует 6 родов, в том числе :--фитореовирусы (лат. Phytoreovirus)--фидживирусы (лат. Fijivirus)--орбивирусыНазвание образовано от соединения начальных букв: Respiratory, Еntero, Оrphan. Изометрические вирионы с икосаэдральным типом симметрии, диаметр 60 - 80 нм. Вирион липопротеиновой оболочки не имеет, но иногда покрыт псевдомембраной клеточного происхождения. Сердцевина имеет форму икосаэдра с 12 выпячиваниями из каждого вершинного угла. Плавучая плотность в CsCl 1,36 - 1,39 г/см3, константа седиментации 630S. Молекулярная масса вирионов 65 - 200 мегадальтон. Чувствительны к жирорастворителям, термо- и кислотоустойчивы. Геном состоит из 10 - 12 молекул двунитчатой РНК с молекулярной массой от 0,2 до 3 мегадальтон и общей молекулярной массой около 12 - 20 мегадальтон. Сегменты РНК не гибридизируются между собой. Капсид вирионов двухслойный. Все реовирусы имеют транскриптазу, или РНК-полимеразу, которая транскрибирует двунитчатую РНК генома в однонитчатую РНК, функционирующую как тРНК. Транскриптазной активностью обладают вирионы, лишенные внешней капсулы. В вирионе 8-10 полипептидов. Репликация и созревание происходят на цитоплазматических матриксах; при атом часто образуются включения, содержащие кристаллы из вирусных частиц. Семейство состоит из родов Reovirus и Rotavirus (хозяева - позвоночные), Orbivinis {хозяева - позвоночные и насекомые), род Coltivirus, Phytoreovirus , Fijivirus (хозяева - растения и насекомые) и группы вирусов цитоплазменного полиэдроза насекомых. В пределах рода часты генетические рекомбинации.
89. Семейство иридовирусы является обширным и сложным. Оно включает три рода вирусов: ранавирусы (вирус лягушек 3), лимфоцистивирусы и род без названия (вирус золотистых рыб 1). Несколько представителей семейства иридовирусы связаны с болезнями рыб и амфибий. Наиболее известный вирус лимфоцистита рыб вызывает опухолеоб-разные изменения на коже. Он вызывает заболевание более чем у 90 различных видов морских и пресноводных рыб и является важным патогеном. Иридовирусы — оболочечные вирусы диаметром 300 нм. Иридовирусы позвоночных морфологически подобны вирусу АЧС. Иридовирусы имеют сложный икосаэдрический капсид диаметром 130—170 нм. Геном представлен одной линейной молекулой двухцепочной ДНК размером 95000-190000 пар оснований. Иридовирус москитов имеет геном 440000 пар оснований и является наиболее крупным геномом ДНК вирусов. Для транскрипции и репликации ДНК необходимо ядро клетки, но некоторые ДНК синтезируются и включаются в вирионы в цитоплазме. Концы генома иридовирусов отличаются от концов генома вируса АЧС циркулярными перестановками, концевой избыточностью и содержанием метилированных оснований, подобно ДНК бактерий. Иридовирусы позвоночных размножаются в различных культурах клеток амфибий и млекопитающих при температуре 12-32°С. Их репликация подобна вирусу АЧС. Однако их геном не кодирует РНК полимеразу, а использует клеточную РНК полимеразу II, которая модифицируется структурными белками для преимущественного синтеза вирусной мРНК. Другое отличие заключается в том, что первая стадия репликации ДНК иридовирусов происходит в ядре, а вторая - в цитоплазме с образованием конкатемеров в 10 и более превышающих размер вирусного генома. Иридовирусы позвоночных, также как асфаровирусы, образуют крупные параклисталлические структуры вирионов в цитоплазме инфицированных клето.
88. Род Filovirus семейства Filoviriclae объединяет палочковидные или нитевидные, ветвящиеся вирусы [лат. filum, нить]. Средние размеры вирионов филовирусов 14x80 нм. Геном филовирусов образован молекулой -РНК. Нуклеокапсид организован по типу спиральной симметрии и образует тяж, покрытый суперкапсидом с гликопротеиновыми шипами длиной 7-10 нм. Филовирусы устойчивы к высокой температуре и сохраняют инфекционность в течение 30 мин при 60-70 "С; быстро инактивируются под действием УФ-облучения и жирорастворяющих агентов. Для человека патогенны филовирусы геморрагических лихорадок Марбург и Эбола. Заболевания вызываемые филовирусами регистрируют в экваториальных и субэкваториальных районах Африки. Выявлена циркуляция филовирусов у зелёных мартышек-церкопитеков. Тем не менее обезьян нельзя считать природным резервуаром, так как инфекция у них также протекает остро. Филовирусы. Свойства филовирусов. Болезнь Марбург Продолжительность периода заразительности филовирусами обезьян — до 7-й недели после выздоровления (возбудитель сохраняется в тканях и слёзной жидкости). Человек заражается филовирусами контактным и, возможно, воздушно-капельным путём. Также известны случаи передачи филовирусов при половых контактах. Заражение возможно при контактах с больными приматами и людьми. В некоторых случаях заражение филовирусами происходило при вторичном использовании катетеров и систем для переливания крови либо плохо стерилизованных медицинских инструментов. Патогенез поражений филовирусами напоминает прочие вирусные геморрагические лихорадки, но ведущий фактор — нарушение функций тромбоцитов, приводящее к геморрагическому шоку. Болезнь Марбург Первые вспышки болезни Марбург зарегистрированы в 1967 г. в городах Марбург и Белград. Позднее заболевание наблюдали в ЮАР и Кении. Длительность инкубационного периода болезни Марбург 1-9 сут. Болезнь Марбург начинается остро: характерны повышение температуры тела до 38-40°С, мышечные боли, головная боль, экзантемы и конъюнктивит. Основные проявления болезни Марбург — массивные генерализованные кровоизлияния, протеинурия, поражение сердца. Смерть пациентов наблюдают на фоне развития шока. Летальность 50% (варьирует от 30 до 90%).
87. Семейство Caliciviridae объединяет большую группу сходных по морфологии и отличных по антигенным свойствам РНК-позитивных однонитевых вирусов, вирионы которых имеют характерную морфологию с чашеобразными углублениями на сферической поверхности капсида, откуда происходит их название (calyx, или chalice - чаша). В составе семейства 4 рода: везивирусы, лаговирусы, Норфолк-подобные вирусы (норовирусы) и Саппоро-подобные вирусы (саповирусы). Первые два рода включают вирусы, патогенные для животных, последние два рода включают в основном вирусы, патогенные для человека. Совсем недавно считали, что калицивирусы имеют ограниченный круг хозяев и поражают только свиней, кошек и морских львов. Однако за последнее время получены изоляты от моржей, людей, обезьян, телят, цыплят, норок, рептилий, амфибий и насекомых. Патогенность одних калицивирусов для естественного хозяина доказана, для других — требует выяснения. Некоторые из них еще недостаточно изучены. Прототипным вирусом семейства является вирус везикулярной болезни свиней (ВЭС). Вызываемое им заболевание впервые обнаружено в 1932 г. в Южной Калифорнии и ликвидировано в США в 1956 г. В настоящее время ВЭС считается экзотической болезнью, хотя вирус все еще присутствует у морских млекопитающих и представляет потенциальную угрозу для свиней, о чем свидетельствует возникновение заболевания в 1972 г. в одном свиноводческом хозяйстве на острове Сахалин. Известны калицивирусы, которые связаны с системными заболеваниями. Например, энтеритный калицивирус крупного рогатого скота и энтеритный калицивирус свиней вызывают диарею и анорексию сооответственно у телят и поросят. Калицивирус кур вызывает у цыплят остановку роста и высокую смертность. Калицивирус приматов (Panl) вызывает персистентную инфекцию и образование везикул. Калицивирусы человека вызывают диарею, обезвоживание, лихорадку, колики и недомогание. Один вирус связан с везикулярными поражениями гениталий собак. Известны калицеподобные вирусы. Так, например, из содержимого кишечника поросят с признаками диареи выделен вирус, сходный с калицивирусами. Клетками-мишенями его были эпителий ворсинок тонкого отдела кишечника поросят. Вирус антигенно отличался от возбудителя ВЭС. Калицивирусы легко идентифицируются в РН и методом перекрестного иммунитета.
90. Гепаднавирусы - гепатотропные ДНК-содержащие вирусы. Все гепаднавирусы существуют в виде трех морфологических форм, имеют собственную ДНК-полимеразу и поверхностные и ядерные антигены, аналогичные HBsAg и HBcAg . Вирусы размножаются в печени, но обнаруживаются и в других тканях. Они вызывают острый и хронический гепатит и печеночноклеточный рак . Гепаднавирус типа IВ отличие от других ДНК-содержащих вирусов гепаднавирусы не способны к прямой репликации ДНК. При проникновении вируса в цитоплазму короткая цепь ДНК достраивается с образованием полностью двухцепочечной ДНК, которая поступает в ядро и там транскрибируется под действием клеточной РНК-полимеразы с образованием полных РНК-копий генома и коротких мРНК. РНК-копии генома снова поступают в цитоплазму, после чего вирусная ДНК-полимераза, действуя как обратная транскриптаза, синтезирует на матрице РНК минус-цепь ДНК, а затем РНК разрушается и частично замещается короткой плюсцепью ДНК. На основе мРНК синтезируются вирусные белки; далее происходит сборка вирусов, и они покидают клетку. Вирус, полученный из крови и печеночной ткани больного, не культивируется in vitro, однако выполнена трансфекция вирусной ДНК в ряд клеточных линий, в которых происходят репликация вирусной ДНК и синтез вирусных белков.
