
- •Вопрос 1 «Предмет и задача химии. Значение химии»
- •Вопрос 2. Строение атома. Модели атома (Морозова, Резерфорда, Бора). Теория Бора. Уравнение Планка. Принцип неопределенности Гейзенберга. Волновая функция.
- •Вопрос 3. Квантово-механическое представление о строении атома. Квантовые числа и их физический смысл.
- •Вопрос 4. Распределение электронов в многоэлектронном атоме. Принцип Паули. Правило Гунда. Порядок заполнения электронных подуровней.
- •Вопрос 6. Ковалентная связь. Свойства ковалентной связи: прочность, полярность, насыщаемость, направленность, гибридизация, кратность.
- •Вопрос 7. Обменный и донорно-акцепторный механизм образования ковалентной связи.
- •Вопрос 8. Σ-, π-, δ- связь.
- •Вопрос 9.Методы молекулярных орбиталей (ммо) и валентных связей(мвс). Сравнительная характеристика ммо и мвс.
- •Вопрос 10. Ионная связь и ее свойства.
- •Вопрос 11. Водородная связь и межмолекулярное взаимодействие.
- •Вопрос 12. Комплексные соединения: строение, характер связи, диссоциация. Классификация комплексных соединений.
- •Вопрос 13. Химичёская термодинамика, термодинамические параметры (т, р, V). Внутренняя энергия. Первый закон термодинамики.
- •Вопрос 14. Энтальпия образования вещества. Закон Гесса и его применение.
- •Вопрос 16. Свободная энергия Гиббса. Самопроизвольность протекания реакций.
- •Вопрос 17. Химическая кинетика. Закон действующих масс гомогенных и гетерогенных систем. Скорость прямой и обратной реакции. Константа скорости химической реакции. Порядок и молекулярность реакции.
- •Вопрос 18. Влиятние температуры на скорость химической реакции. Правило Вант-Гоффа. Энергия активации. Уравнение Аррениуса.
- •Вопрос19. Гомогенный и гетерогенный катализ. Катализаторы и ингибиторы
- •Вопрос 20.Химическое равновесие. Смещение хим.Равновесия при изменении условий протекания хим.Процессов. Принцип Ле-Шателье.
- •Вопрос 21. Растворы. Свойства растворов
- •Вопрос 22. Способы выражения концентраций растворов
- •Вопрос 23. Законы растворов???Закон Вант-Гоффа.Закон Генри
- •Вопрос 24. Закон Рауля. Осмос. Физический смысл эбуллиоскопической и криоскопической постоянной.
- •Вопрос 25. Растворы электролитов. Электролитическая диссоциация. Степень диссоциации. Константа диссоциации.
- •Вопрос 26. Сильные электролиты(примеры). Активность ионов в растворах сильных электролитов. Коэффициент активности. Ионная сила.
- •Вопрос 27 Ионное произведение воды. Водородный показатель (рН) растворов.
- •Вопрос 28. Равновесие осадок-раствор. Произведение растворимости. Условия растворения и выпадения осадка.
- •Вопрос 29.Гидролиз солей. Константа гидролиза. Степень гидролиза.
- •Вопрос 30. Дисперсные системы. Коллоидные растворы, свойства.
- •Вопрос 31. Строение мицеллы коллоидов. Оптические и электрические свойства коллоидных растворов.
- •Вопрос 32. Овр. Ионно-электронный метод уравнивания овр. Термодинамическая вероятность протекания овр.
- •Вопрос 33. Электродный потенциал. Старндартный электродный понетциал.Водородный потенциал.Уравнение Нернста.
- •Вопрос 34. Гальванический элемент: устройства, протекающие процессы на аноде и катоде. Эдс и энергия Гиббса гальванического элемента
- •Вопрос 35. Электролиз. Законы Фарадея. Электрохимический эквивалент. Выход по току.
- •Вопрос 36. Электролиз расплавов и растворов на растворимых и нерастворимых электродах. Последовательность разряда ионов при электролизе на аноде и катоде.
- •Вопрос 37. Поляризация, ее причины. Перенапряжение.
Вопрос 30. Дисперсные системы. Коллоидные растворы, свойства.
Дисперсные системы – гетерогенная система, состоящая из 2 или более фаз с сильноразвитой поверхностью раздела между ними.
Вещество, которое в дисперсионной системе образует сплошную фазу наз. дисперсной средой. То, что растворено в виде частиц, капель, пузырьков – дисперсной фазой.
Различают несколько видов систем:
- грубодисперсные (взвеси) – это величины более 100 нМ;
- коллоидные – от 1 до 100 нМ;
- аэрозоли или аэрогели – если дисперсная среда газообразная (туман, дым).
Коллоидные растворы.
Частицы дисп.фазы кол.растворов наз-т кол-ми частицами. Коллоидные частицы несут на себе заряд, что обуславливает притяжение к ним диполей воды. На поверхности частицы созд-ся гидратная оболочка. Св-ва:
1.характерно движение частиц дисп.фазы,вызываемое беспорядочными ударами со стороны молекул среды, находящихся в тепловом движении
2.концентрация кол.растворов одинакова по всему объему системы
3.сохранение кол.степени дисперсности во времени обусловлено наличием одноименного эл-го заряда частиц фазы, вызывающ. их отталкивание
Вопрос 31. Строение мицеллы коллоидов. Оптические и электрические свойства коллоидных растворов.
Мицеллы-частицы в коллоидных системах,состоящие из нерастворимого в данной среде ядра очень малого размера,окруженного очень малой оболочкой адсорбированных ионов и молекул растворителя.
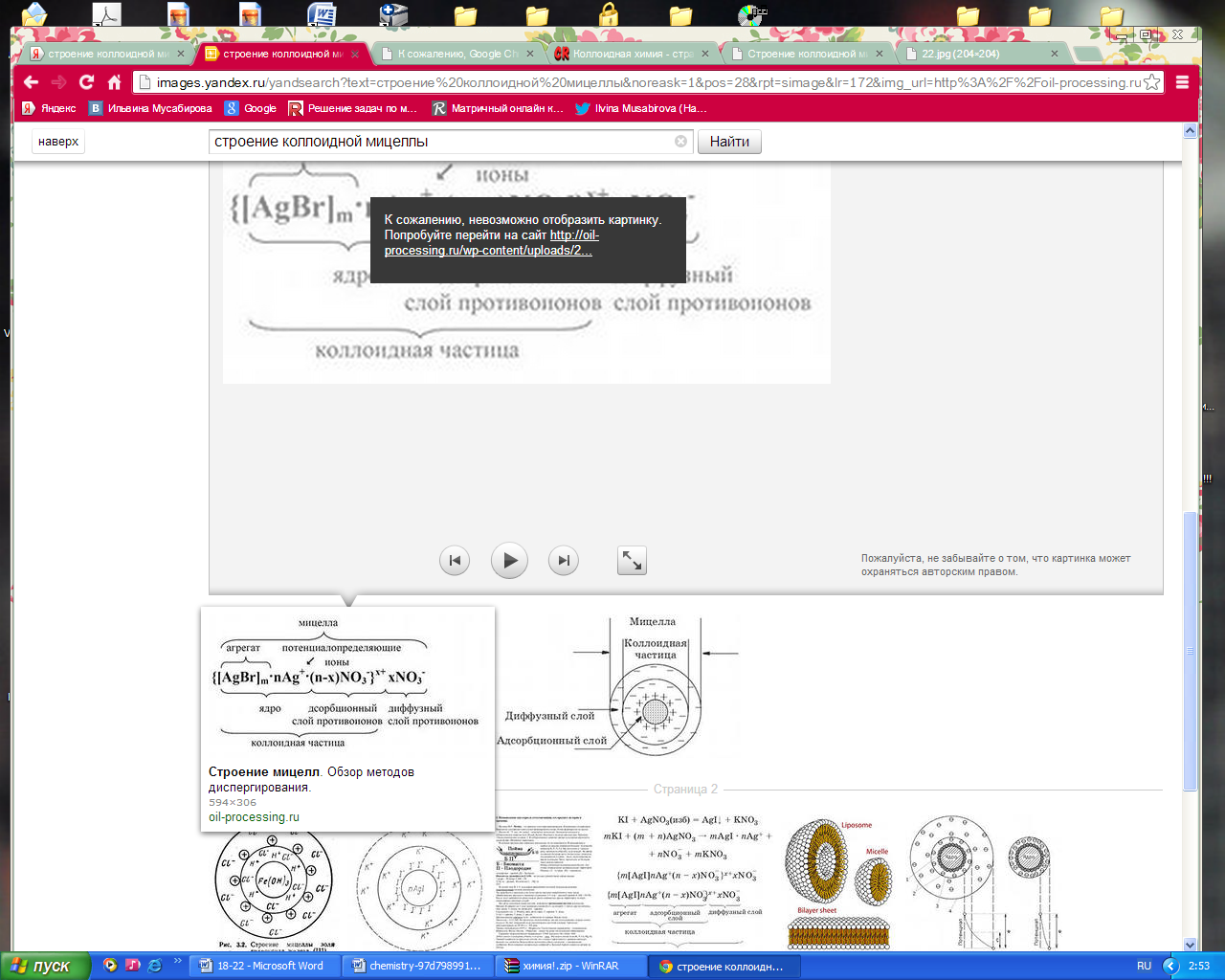
Агрегат-это ядро
Т.е, мицелла:
-ядро
-адсорбирующий слой
-слой противоионов
Кол. частица –
это мицелла и диффузионный слой противоионов.
Оптич. св-во:
Если пропускать пучок света через совершенно прозрачный кол. раствор, то он станов. видимым.
Элект. св-во:
Частицы дисперсной фазы перемещаются к аноду при возд.пост.эл.тока, а частицы дисперсионной среды – к катоду. Дисп. фаза несет на себе заряд противоп.заряду среды.
Вопрос 32. Овр. Ионно-электронный метод уравнивания овр. Термодинамическая вероятность протекания овр.
ОВР-реакции, протекающие с изменением степени окисления.
Степень окисления - условный заряд, вычисленный в предположении, что соед-е сост. только из атомов, ионов и электронов. ОВР сост. из процессов окисления и восстановления. Окисление-процесс отдачи электронов. Восстановление-процесс присоед-я эл-в, понижение ст.окисления. окислитель всегда восстанавливается и наоборот.
Любая ОВР состоит из процессов окисления и восстановления:
Окисление – это процесс отдачи электронов при этом происходит понижение степени окисления.
Восстановление – это процесс присоединения электронов, при этом происходит понижение степени окисления.
Реакции, в кот. ок-ль. и восст-ль предс. собой различные ве-ва наз. межмолекулярными. Если ок-ль и восс-ль атомы одной молекулы - внутримолекулярные.
Разновидностью ОВР является - р-я диспропорционирования, т.е. самопроизв-го окисления или восстановления, это ок-е или восс-е атомов или ионов одной и той же молекулы.
Любую реакцию ОВР рассматривают исходя из осн. определения реакции с переносом электрона для составления электронного баланса и применяют метод полуреакции (электронно-ионный).
Стадии окисления и восст-я разделены: 1.установление формул исх. в-в и продуктов реакции. 2.опред. степени окисления элементов. 3.опред. числа эл-в, отдаваемых восст-ем и приним-х ок-лем. 4.опред. коэффициентов при всех веществах.
Направление по энергии Гиббса. G<0 – в прямом направлении.
Ионно-электронный метод уравнивания ОВР.
K+2(Cr6+2O2-7)2-+3Na+2(S4+O2-3)2-+4H+2(S6+O-24)2-Cr3+2(SO4)2-3+3Na+2(S6+O2-4)2-+K+2S6+O2-4+4H2О,
14H++(Cr6+2O7)2-+6e2Cr3++7H2O6 1
(S4+O3)2-+H2O-2e(S6+O4)2-+2H+ 3
Полуреакции пишем в соответствии с законом сохранения масс и с учётом числа атомов, кот отдают или присоединяют е.
14H++(Cr6+2O7)2-+3H2O+3(SO3)2- 2Cr3++7H2O+3(SO4)2-+6H+.
Уравниваем катионы металлов, которые меняли степень окисления. Уравниваем количество анионов. Правильность подбора проверяем по кислороду.
ОВ процессы зависят от рН. Хорошо протекают в нейтральной среде.
K(Mn7+O4)-+Na2SO3+H2SO4 Na2SO4+Mn2+(SO4)2-+H2SO4+H2O (pH<7);
KMnO4+Na2SO3+H2ONa2SO4+Mn4+O2+KOH (pH7);
KMnO4+Na2SO3+KOHNa2SO4+K2(Mn6+O4)2-+H2O (рН>7).
