
- •1. Макро- и микроструктура металлов. Методы исследования металлов.
- •2. Атомно-кристаллическая структура металлов. Виды кристаллических решеток.
- •3. Дефекты кристаллической решетки металлов.
- •Формирование структуры металлов при кристаллизации.
- •4. Гомогенная (самопроизвольная) кристаллизация.
- •5. Число центров кристаллизации. Величина зерна.
- •6. Гетерогенное образование зародышей. Модифицирование.
- •7. Строение металлического слитка.
- •8. Полиморфные превращения.
- •Фазы и микроструктура в металлических сплавах.
- •2. Химические соединения.
- •3. Механические смеси.
- •Формирование структуры сплавов при кристаллизации.
- •1. Процесс кристаллизации и фазовые превращения в сплавах.
- •2. Диаграммы фазового равновесия.
- •3. Диаграммы состояния сплавов, образующих неограниченные твердые растворы.
- •4. Неравновесная кристаллизация.
- •5. Дендритная (внутрикристаллитная) ликвация.
- •6. Диаграммы состояния сплавов, образующих ограниченные твердые растворы.
- •7. Ликвация по плотности.
- •8. Диаграммы состояния сплавов, компоненты которых имеют полиморфные превращения.
- •1. Компоненты и фазы в системе железо-углерод.
- •2. Диаграмма состояния железо-цементит (метастабильное равновесие).
- •3. Влияние углерода, постоянных примесей и легирующих элементов на свойства стали.
- •1. Теория термической обработки стали. Превращение ферритно-карбидной структуры в аустенит при нагреве.
- •2. Теория термической обработки стали. Рост зерна аустенита при нагреве.
- •2. Теория термической обработки стали. Влияние величины зерна на свойства сталей. Определение и выявление величины зерна.
- •3. Теория термической обработки стали. Перлитное превращение переохлажденного аустенита.
- •4. Теория термической обработки стали. Мартенситное превращение в сталях.
- •5. Влияние легирующих элементов на устойчивость переохлажденного аустенита. Превращение аустенита при непрерывном охлаждении.
- •6. Превращение мартенсита и остаточного аустенита при нагреве.
- •7. Влияние отпуска на механические свойства.
- •8. Виды отпускной хрупкости в легированных сталях.
- •9. Термическое и деформационное старение углеродистых сталей.
- •1. Технология термической обработки стали. Отжиг I рода.
- •2. Технология термической обработки стали. Отжиг II рода.
- •3. Технология термической обработки стали. Закалка, выбор температуры закалки.
- •4. Технология термической обработки стали. Продолжительность нагрева деталей для закалки, охлаждающие среды.
- •5. Технология термической обработки стали. Закаливаемость и прокаливаемость стали.
- •6. Технология термической обработки стали. Внутренние напряжения в закаленной стали.
- •7. Технология термической обработки стали. Способы закалки.
- •8. Технология термической обработки стали. Отпуск стали.
- •9. Краткая характеристика видов термомеханической обработки.
- •10. Технология термической обработки стали. Дефекты, возникающие при термической обработке.
- •1. Теория химико-термической обработки сталей. Понятие эффективной толщины диффузионного слоя.
- •2. Цементация. Образование цементованного слоя. Цементация в твердом и газовом карбюризаторе.
- •3. Азотирование. Технология процесса азотирования.
- •4. Нитроцементация и цианирование. Особенности процессов.
- •5. Борирование, силицирование. Виды диффузионного насыщения металлами.
- •Порошковые антифрикционные материалы на основе железа. Структура. Область применения. Технология получения деталей.
- •Полимеры и пластмассы. Их классификация и способы получения.
- •Неорганические стекла. Классификация и область применения.
2. Диаграммы фазового равновесия.
Диаграммы фазового равновесия или диаграммы состояния показывают в графической форме фазовый состав сплава в зависимости от температуры и концентрации.
Равновесное состояние соответствует минимальному значению энергии Гиббса. Это состояние может быть достигнуто только при малых скоростях охлаждения или длительном нагреве. Истинное равновесие в естественных условиях достигается достаточно редко. В большинстве случаев сплавы находятся в состоянии метастабильного равновесия, то есть в таком состоянии, когда они обладают ограниченной устойчивостью и под влиянием внешних факторов переходят в другие более устойчивые состояния, так как их энергия Гиббса больше минимальной.
Правило фаз. Диаграммы фазового равновесия характеризуют состояние сплавов, полученное после того, когда фазовые превращения уже произошли и закончились. Правило фаз устанавливает зависимость между числом степеней свободы, числом компонентов и числом фаз и выражается уравнением:
C=K+2-Ф
где С–число степеней свободы системы;
К–число компонентов, образующих систему, то есть минимальное число химических элементов, необходимое для образования любой фазы системы;
2–число внешних факторов;
Ф–число фаз, находящихся в равновесии.
Под числом степеней свободы понимают возможность изменения температуры, давления и концентрации без изменения числа фаз, находящихся в равновесии.
При изучении физико-химических равновесий сплавов за внешние факторы, влияющие на состояние сплава, принимают температуру и давление. Применяя правило фаз к металлам, можно принять изменяющимся только один внешний фактор–температуру, так как давление (за исключением очень высокого) мало влияет на фазовое равновесие сплавов в жидком и твердом состоянии. Тогда уравнение примет вид: C=K+1-Ф.
Число степеней свободы не может быть дробным числом и не может быть меньше нуля, а, следовательно, Ф≤К+1, то есть число фаз в сплаве, находящихся в равновесии, не может быть больше, чем число компонентов плюс один. (Следовательно, в двойной системе в равновесии не может находиться не более трех фаз; в тройной системе–не более четырех и т.д.)
Если в равновесии в системе с определенным числом компонентов находится максимальное количество фаз, то число степеней свободы системы равно нулю. Такое равновесие называется нонвариантным (безвариантным). Сплав из данного числа фаз может существовать только при постоянной температуре и определенном составе всех находящихся в равновесии фаз.
В случае уменьшения числа фаз на одну против максимально возможного число степеней свободы возрастает на единицу (С=1). Такую систему называют моновариантной. Когда С=2, система бивариантна.
У
Рис. 12. Зависимость энергии Гиббса
от состава сплава.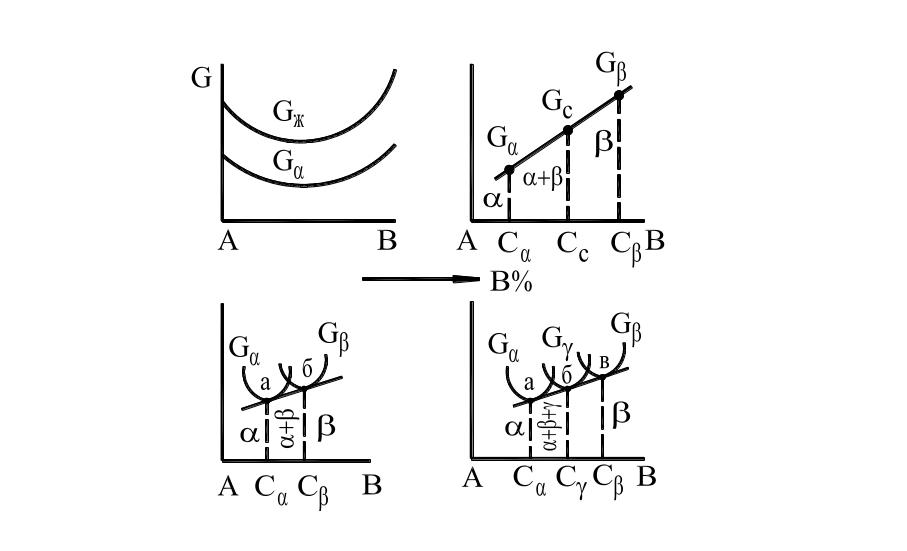
Если сплав состоит из одной фазы, например, жидкого или твердого раствора α, то энергия Гиббса (Gж, Gα) при постоянном давлении и температуре зависит от ее природы и состава фазы (Рис. 12. а). Для случая, приведенного на рис. 12, а, устойчив твердый раствор α, так как у него меньше энергия Гиббса (Gα), чем у жидкой фазы (Gж).
Если сплав состоит из двух или более фаз, то при постоянной температуре и давлении ее энергия Гиббса определяется по правилу смешения (Рис. 12. б).
Точка Gc, характеризующая энергию Гиббса сплава, лежит на прямой, соединяющей точки, характеризующие энергию Гиббса α- и β-фаз (Gα и Gβ) и делит прямую на отрезки, обратно пропорциональные массовым количествам α- и β-фаз.
Если α- и β-фазы могут изменять свой состав, то энергия Гиббса каждой фазы зависит от концентрации и может изменяться так как это показано на рис. 12, в.
Состав фаз, находящихся в равновесии при данной температуре, отвечает точкам Cα и Cβ. Двухфазное состояние соответствует концентрациям, лежащим в пределах Cα— Cβ, где энергия Гиббса смеси двух фаз, определяемая точками на прямой ab, меньше свободной энергии отдельных фаз. Составы, имеющие концентрацию меньше, чем Cα, в условиях равновесия будут состоять только из α-фазы, а сплавы с концентрацией более Cβ – из β-фазы.
В двухкомпонентной системе при некоторых условиях, например, при нонвариантном равновесии (C=0), могут существовать одновременно три фазы (жидкая и два твердых раствора). Тогда состав фаз, находящихся в равновесии, определяется проекцией на ось концентраций точек касания прямой линии – к кривым Gα, Gβ, Gγ (точки Cα, Cβ, Cγ). При данной температуре в равновесии могут существовать (Рис. 12. г): одна α-фаза в сплавах, имеющих концентрацию менее Cα; три фазы α, γ, β в сплавах концентрации в пределах Cα— Cβ и состава, отвечающего точкам Cα, Cγ и Cβ (в этих пределах изменяется только количественное соотношение между фазами); одна β-фаза устойчивая в сплавах, имеющих концентрацию более Cβ.
По кривым свободной энергии можно построить основные типы диаграмм состояния. Обычно диаграммы строят экспериментально, а термодинамические равновесия и правило фаз используют при анализе опытных данных.
Для построения диаграмм состояния используют термический анализ. Для этой цели экспериментально получают кривые охлаждения отдельных сплавов и по их перегибам или остановкам определяют температуры соответствующих превращений. Эти температуры называются критическими точками.
