
- •Представление о современной квантово-механической модели атома. Характеристика состояния электронов в атоме с помощью набора квантовых чисел. Электронные формы химических элементов.
- •Последовательность заполнения энергетических уровней и подуровней электронами в многоэлектронных атомах. Принцип Паули. Правило Гунда. Принцип минимума энергии.
- •Энергия ионизации и энергия сродства к электрону. Характер их изменения по периодам и группам периодической системы д.И.Менделеева. Металлы и неметаллы.
- •Электроотрицательность химических элементов. Характер изменения электроотрицательности по периодам и группам периодической системы д.И.Менделеева. Понятие степени окисления.
- •Основные типы химической связи. Ковалентная связь. Основные положения метода валентных связей. Сигма- и Пи- ковалентные связи.
- •Два механизма образования ковалентной связи: обычный и донорно-акцепторный.
- •Геометрическая форма и полярность молекул.
- •Ионная связь как предельный случай поляризации ковалентной связи. Электростатическое взаимодействие ионов.
- •Химические свойства основных,кислотных и амфотерных оксидов.
- •Основания. Химические свойства оснований. Амфотерные состояния,реакции их взаимодействия с кислотами и щелочами.
- •Характерные реакции
- •Кислоты. Бескислородные и кислородные кислоты. Свойства кислот (серная,соляная,азотная).
- •Основные понятия химической кинетики. Скорость химической реакции. Факторы,влияющие на скорость реакции в гомогенных и гетерогенных процессах. Катализ.
- •Влияние концентрации на скорость химической реакции. Закон действующих масс.
- •Влияние температуры на скорость химической реакции. Энергия активации.
- •Химическое равновесие. Константа равновесия,её зависимость от температуры. Возможность смещения равновесия химической реакции. Принцип Ле-Шателье.
- •Реакции без участия и с участием электронов. Ионно-обменные и окислительно-восстановительные реакции.
- •Изображение реакций ионного обмена
- •Правила написания реакций ионного обмена
- •Описание
- •Окисление
- •Восстановление
- •Окислительно-восстановительная пара
- •Виды окислительно-восстановительных реакций
- •Примеры Окислительно-восстановительная реакция между водородом и фтором
- •Окисление, восстановление
- •Взаимодействие с металлами:
- •Взаимодействие с другими неметаллами:
- •Способы выражения количественного состава раствора: массовая,молярная и нормальная концентрация, модальность. Массовая доля
- •Объёмная доля
- •Молярность (молярная объёмная концентрация)
- •Нормальная концентрация (мольная концентрация эквивалента, или просто «нормальность»)
- •Мольная (молярная) доля
- •Моляльность (молярная весовая концентрация, моляльная концентрация)
- •Титр раствора
- •Растворимость. Равновесие в гетерогенных системах. Произведение растворимости малорастворимых неорганических веществ.
- •Водные растворы электролитов. Сильные и слабые электролиты. Константа и степень диссоциации. Закон разбавления Оствальда.
- •Электролитическая диссоциация воды. Константа диссоциации воды. Ионное произведение воды.
- •Водородный показатель pH среды для растворов электролитов. Шкала pH. Формулы для расчёта pHдля сильных и слабых кислот и оснований.
- •Диссоциация сильных электролитов. Активность ионов в растворах. Коэффициент активности. Представление об ионной силе растворов.
- •Гидролиз солей. Факторы, влияющие на процесс гидролиза. Расчёты pHгидролиза солей по катиону и аниону.
- •Степень гидролиза
- •Электродный потенциал. Возникновение скачка потенциала на межфазной границе. Водородный электрод. Стандартный водородный электрод.
- •Электродные системы,их классификация. Ox- и Red-определяющие частицы в электродных системах разного типа.
- •Уравнение Нернста для расчёта электродных потенциалов электродных систем различных типов. Газовые водородный и кислородный электроды. Редокси-электроды.
- •Электрохимический потенциал как показатель ox-red свойств веществ. Определение вероятности протекания овр по разности потенциалов реагирующих веществ.
- •Понятие о гальваническом элементе. Катодные и анодные процессы в гальваническом элементе. Эдс гальванического элемента. Схемы гальванических элементов.
- •Электрохимическая коррозия металлов в различных средах.
- •Химическое взаимодействие металлов с растворами обычных кислот и кислот окислителей.
- •Процесс электролиза. Катодные и анодные процессы. Порядок разряда частиц на аноде и катоде в зависимости от значения их электродного потенциала.
- •Роль воды в анодном и катодном процессах. Электролиз с инертным растворяющимся анодом.
- •Расчёты масс веществ-продуктов электролиза по закону Фарадея.
- •Математический вид
- •Классификация анионов и групповые реагенты
- •Классификация анионов
- •Связь сульфидной классификации катионов с электронной конфигурацией атомов и ионов
- •Методы количественного анализа-гравиметрический и титриметрический (объёмный).
- •Виды титриметрического анализа
- •Типы титрования
- •Виды титриметрического анализа
- •Особенности строения атома углерода. Неорганические соединения углерода (оксиды,карбонаты и гидрокарбонаты,карбиды) и их свойства.
Связь сульфидной классификации катионов с электронной конфигурацией атомов и ионов
Растворимость солей и гидроксидов катионов, лежащая в основе аналитической классификации, как и все другие свойства катионов, функционально связана с положением соответствующих элементов в периодической системе.
Катионы s-элементов, обладающие 2- и 8-электронным внешним слоем (Li+, Na+, K+, Mg2+, Са2+, Sr2+, Ba2+ и др.), являются слабыми поляризаторами и почти не поляризуются сами. При взаимодействии подобных катионов с сульфид-ионами не происходит заметной деформации электронных оболочек. Такие катионы,
как правило, не образуют труднорастворимых в воде сульфидов и относятся к I и II аналитическим группам. Катионы Ag+, Hg2+, As(III), As(V), Sn+, Sb(III), Pb2+, Bi3+ и др., обладающие многоэлектронным внешним слоем (18 и 18 + 2), являются сильными поляризаторами и в то же время легко поляризуются сами. При взаимодействии подобных катионов с легко деформируемыми электронными оболочками сульфид-ионов происходит сильная поляризация обоих ионов и значительная деформация их внешних электронных оболочек. В соответствии с этим все катионы, обладающие внешней электронной структурой 18е- или (18 + 2e-) как правило, образуют сульфиды с очень малыми значениями констант растворимости и потому принадлежат к IV и V аналитическим группам.
Катионы с переходной электронной структурой, т. е. с незаконченным 18-электронным внешним слоем (Mn2+, Fc2+, Fe3+, Co2+, Ni2+ и др.), занимают промежуточное положение. Являясь сравнительно сильными поляризаторами, они в то же время заметно поляризуются сами и потому при взаимодействии с сульфид-ионами дают труднорастворимые сульфиды. Эти катионы образуют III аналитическую группу. Их сульфиды имеют значительно большие значения констант растворимости, чем катионы IV и V групп.
Таким образом, сульфидная классификация катионов, основанная на признаке, имеющем на первый взгляд чисто практический характер, ни в коей мере не случайна, а связана с электронной конфигурацией атомов и ионов.
Группа катионов |
I |
II |
III |
IV |
V |
||
А |
Б |
А |
Б |
||||
Характеристика группы |
Сульфиды и карбонаты растворимы в воде |
Сульфиды растворимы в воде, карбонаты - нет |
Сульфиды или образующиеся вместо них гидроксиды растворимы в разбавленных кислотых |
Сульфиды нерастворимы в разбавленных кислотых |
|||
Гидроксиды амфитерны |
Гидроксиды неамфотерны |
Сульфиды нерастворимы в Na2S |
Сульфиды растворимы в Na2S |
Хлориды нерастворимы в воде |
|||
Катионы |
Na+, K+, NH4+ |
Mg2+, Ca2+, Sr2+, Ba2+ |
Al3+, Cr3+, Zn2+ |
Fe2+, Fe3+, Mn2+, Co2+, Ni2+ |
Cu2+, Bi3+, Cd2+ |
As(III, V), Sb(III, V), Sn2+, Sn(IV), Hg2+ |
Ag+, Hg22+, Pb2+ |
Групповой реагент |
Нет |
(NH4)2CO3 |
(NH4)2S в присутствии NH4OH и NH4Cl |
H2S в присутствии HCl |
HCl |
||
Акво - ионы меди (II) [Си(Н2О)п]2+ окрашены в голубой цвет, поэтому растворы солей меди (II) имеют голубую окраску с разными оттенками (от голубой до сине-зеленой). В водных растворах акво - ионы меди (II) частично гидролизуются с образованием растворимых гидроксо-аквокомплексов состава [Cu(H2O)n.m(OH)m]2-m по схеме:
[Cu(H2O)]2+ + mH2O = [Cu(H2O)n.m(OH)m] m + тН3О+
1.Реакция с щелочами.
Си2++ 2 ОН-— Си(ОН)2 (сине-зеленый)
Смесь осторожно нагревают до кипения и кипятят до потемнения осадка. Си(ОН)2 разлагается, теряя воду и образуется черный осадок оксида меди (II) СuО: Сu (ОН)2 — СuО (черный) + Н2О
Осадок Сu (ОН)2 растворяется в кислотах, в растворах аммиака (с образованием комплекса [Cu(NH3)4] + синего цвета), комплексообразующих органических кислот (лимонная, винная), частично растворим в концентрированных щелочах с образованием гидроксокомплексов меди (II).
2.Реакция с аммиаком (фармакопейная).
СuСЬ + NHrH2O — Си(ОН)С1 |(сине-зеленый) В избытке аммиака осадок растворяется с образованием ярко синего раствора:
Сu (ОН)С1 + 4 NH3-H2O — [Cu(NH3)4]2+ + ОН- + СГ + 4 Н2О В кислой среде комплексный тетрамминмедь (II) - катион разрушается:
[Си(Ш3)4]2+(ярко - синий) + 4 Н3О+ — [Сu (Н2О)4]2+(голубой) + 4 NH4+ и окраска раствора из ярко-синей переходит в голубую (цвет аквокомплекса меди (II)). К аммиачному комплексу меди (II) прибавляют по каплям разбавленный раствор одной из кислот - НС1, HNO3 или H2SO4. Окраска раствора из ярко - синей переходит в голубую. Мешают катионы Со2+, Ni2+, олово (II).
3.Реакция с гексацианоферратом (II) калия.
2Cu2+ + [Fe(CN)6]4- — Си2[Ре(СЫ)6]|(красно-коричневый).
Капельный метод на фильтровальной бумаге: на лист фильтровальной бумаги, пропитанной раствором ферроцианида калия, наносят каплю раствора соли меди (II). На бумаге образуется красно-коричневое пятно.
Осадок не растворяется в разбавленных кислотах, но растворяется в 25%-м водном аммиаке:
Cu,[Fe(CN)6] + 12 NH3+ 4 Н2О — ( NH4)4[Fe(CN)6] + 2 [Cu(NH3)4](OH)2 Проведению реакции мешают катионы, также образующие окрашенные осадки .и ферроцианидов (Fe3+, Со2т, Ni2+).
4.Реакция с тиосульфатом натрия.
2Си2+ + 2 82О32Хиз6ыток) + 2 Н2О — Cu2S |(темно-бурый) + §j +4 H++~2SO42~
Выпадает темный осадок, содержащий смесь Cu:S и S.
5. Реакция с купроном (1-бензоиноксимом).
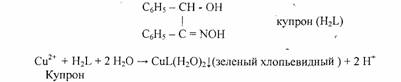
Реакцию проводят в аммиачной среде. Осадок не растворяется в избытке аммиака.
6. Реакция восстановления меди (II) металлами до металлической меди (фармакопейная).Реакцию дают металлы, расположенные в ряду напряжений металлов левее меди.
Cu2+ + Zn -- Си + Zn2+
Си2+ + Fe -> Си + Fe2+
3 Си2+ +2 А1 -► 3 Си +2 А13+
8. Соли меди окрашивают пламя газовой горелки в изумрудно-зеленый цвет. Реакция с тиоцианат - ионами.
Си2+ + 2 SCN- — Cu(SCN)2J-+ CuSCN| + SCN- Образуется
черный осадок Cu(SCN)2, постепенно переходящий в белый CuSCN.
Другие реакции меди (II).
Катионы Си + с сульфид -ионами дают черный осадок сульфида меди CuS; с фосфатами
- голубой осадок Си3(РО4)2. Известны реакции комплексообразования меди (II) с различными органическими реагентами - купроином, купфероном, дитиоксамидом и др.
