
- •Тема 22. Элементы ivб группы: титан, цирконий, гафний.
- •Пертанфторо-титанат калия образуется в виде труднорастворимого осадка при смешении водных растворов фторидов калия и титана
- •Сухой способ получения этого соединения заключается в восстановлении гекса —титаната калия в токе водорода при 770° с
- •Получение:
- •Физические свойства:
- •Химические свойства:
Тема 22. Элементы ivб группы: титан, цирконий, гафний.
ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ.
В подгруппу титана входят элементы побочной подгруппы IV группы — титан, цирконий, гафний и искусственно полученный курчатовий. Металлические свойства выражены у этих элементов сильнее, чем у металлов главной подгруппы четвертой группы — олова и свинца. Атомы элементов подгруппы титана имеют в наружном слое по два электрона, а во втором снаружи слое—по 10 электронов, из которых два — на d-подуровне. Поэтому наиболее характерная степень окисленности металлов подгруппы титана равна +4.
В свободном состоянии титан и его аналоги — типичные металлы, по внешнему виду похожие на сталь. Все они тугоплавки, устойчивы по отношению к воздуху и к воде.
ТИТАН.
Титан очень распространен в природе; его содержание в земной коре составляет 0,6 % (масс), т. е. выше, чем содержание таких широко используемых в технике металлов, как медь, свинец и цинк.
Минералы, содержащие титан, находятся в природе повсеместно. Важнейшими из них являются: титаномагнетиты FeTiO3∙nFe3O4, ильменит FeTiO3, сфен CaTiSiO5 и рутил ТiO2. В СССР месторождения титановых руд находятся на Урале.
МЕТАЛЛИЧЕСКИЙ ТИТАН, ЕГО ПОЛУЧЕНИЕ ИЗ ПРИРОДНОГО СЫРЬЯ, СВОЙСТВА, ПРИМЕНЕНИЕ.
При промышленном получении титана руду или концентрат переводят в диоксид титана ТiO2, который затем подвергают хлорированию. Однако даже при 800—1000 °С хлорирование протекает медленно. С достаточной для практических целей скоростью оно происходит в присутствии углерода, связывающего кислород в основном в СО:
ТiO2 + 2Сl2 + 2С = TiCl4 + 2СО
Получающийся хлорид титана(IV) восстанавливают магнием
TiCl4 + 2Mg = Ti + 2MgCl2
а образующуюся смесь подвергают нагреванию в вакууме. При этом магний и его хлорид испаряются и осаждаются в конденсаторе. Остаток — губчатый титан — переплавляют, получая компактный ковкий металл.
Примеси кислорода, азота, углерода резко ухудшают механические свойства титана, а при большом содержании превращают его в хрупкий материал, непригодный для практического использования. Поскольку при высоких температурах титан реагирует с названными неметаллами, его восстановление проводят в герметичной аппаратуре в атмосфере аргона, а очистку и переплавку — в высоком вакууме.
Для получения небольших количеств титана высокой чистоты применяют иодидный метод.
Металлический титан плавится при 1665°С; плотность его равна 4,505 г/см3. Титан — довольно активный металл; стандартный электродный потенциал системы Ti/Ti2+ равен —1,63 В. Однако благодаря образованию на поверхности металла плотной защитной пленки титан обладает исключительно высокой стойкостью против коррозии, превышающей стойкость нержавеющей стали. Он не окисляется на воздухе, в морской воде и не изменяется в ряде агрессивных химических сред, в частности в разбавленной и концентрированной азотной кислоте и даже в царской водке.
Титан лишь немного тяжелее алюминия, но в 3 раза прочнее его. Это открывает перспективы применения титана в различных областях машиностроения. Достаточно указать, что использование деталей из титана и его сплавов в двигателях внутреннего сгорания позволяет снизить массу этих двигателей примерно на 30%.
СПЛАВЫ ТИТАНА.
При высокой температуре титан соединяется с галогенами, кислородом, серой, азотом и другими элементами. На этом основано применение сплавов титана с железом (ферротитана) в качестве добавки к стали. Титан соединяется с находящимися в расплавленной стали азотом и кислородом и этим предотвращает выделение последних при затвердевании стали — литье получается однородным и не содержит пустот.
Соединяясь с углеродом, титан образует карбид. Из карбидов титана и вольфрама с добавкой кобальта получают сплавы, по твердости приближающиеся к алмазу.
Диоксид титана ТiO2 — белое тугоплавкое вещество, нерастворимое в воде и разбавленных кислотах. Это—амфотерный оксид, но как основные, так и кислотные свойства выражены у него слабо.
Применяется ТiO2 при изготовлении тугоплавких стекол, глазури, эмали, жароупорной лабораторной посуды, а также для приготовления белой масляной краски, обладающей высокой кроющей способностью {титановые белила).
Сплавлением ТiO2 с ВаСO3 получают титанат бария ВаТiO3-Эта соль имеет очень высокую диэлектрическую проницаемость и, кроме того, обладает способностью деформироваться под действием электрического поля. Кристаллы титаната бария применяются в электрических конденсаторах высокой емкости и малых размеров, в ультразвуковой аппаратуре, в звукоснимателях, в гидроакустических устройствах.
СОСТОЯНИЕ ТИТАНА (IV) В ВОДНЫХ РАСТВОРАХ.
В водных растворах Ti находится преимущественно в 4-валентном состоянии, но в определенных условиях существуют комплексы, в которых валентность титана равна трем. Малый ионный радиус позволяет ему приобретать заметную долю электронной плотности кислородного донора с образованием прочной ковалентной связи. Значения электроотрицательности для TiOH и TiO - 2,43 и 2,56 соответственно. Сродство ионов Ti+4 настолько велико, что комплексы практически всегда содержат кислород и образуют в растворах титана(IV) цепи с гидроксильными и кислородными мостиками.
Химия титана даже в разбавленных растворах оказывается связанной с процессами полимеризации.
В растворах титан может находиться в форме простых и комплексных ионов, а также в коллоидно-дисперсном состоянии. Превалирование той или иной формы зависит от условий получения и хранения раствора, его концентрации, содержания примесей и других факторов.
В водных сернокислых растворах существование ионов Ti4+ невозможно, так как Ti существует в виде гидратных комплексов Ti(H2O)64+, подвергающихся гидролизу с депротонизацией. С позиций представлений о льдоподобной структуре воды выполненные расчеты по данным кажущихся мольных объемов позволяют предполагать нахождение Ti(H2O)64+ как в каркасе структуры воды, так и в ее пустотах.
Прямых доказательств существования ионов титанила TiO2+ в растворе нет. Однако наличие TiO-группы в ряде соединений не вызывает сомнения.
ГИДРОЛИЗ ГАЛОГЕНИДОВ ТИТАНА.
Все тетрагалогениды ЭГ4 гигроскопичны, а большинство из них (кроме полимерных фторидов) легко гидролизуются. Так как основный характер гидроксидов Э(ОН)4 при переходе от титана к цирконию и гафнию несколько усиливается, степень гидролиза галогенидов в этом же ряду уменьшается. В разбавленных растворах гидролиз протекает полностью с образованием гидратированных оксидов:
TiCl4 + (2+n)H2O = TiO2∙n H2O + 4HCl
Этот процесс в действительности многостадиен и протекает через промежуточные стадии образования гидроксокомплексов с последующим возникновением многоядерных изокомплексов, в которых атомы титана (и его аналогов) соединены либо через гидроксогруппы (оловые мостики), либо через атомы кислорода (оксоловые мостики). Характерной особенностью, накладывающей отпечаток на всю химию элементов подгруппы титана, является то, что на промежуточных стадиях гидролза Э (+4) образуются устойчивые комплексные катионы:
Э4+ + Н2О = ЭО2+ + 2Н+
Эти катионы TiO2+, ZrO2+, HfO2+ соответственно называются титанил, цирконил, гафнил. Они очень устойчивы.
ГИДРОЛИЗ ТИТАНАТОВ.
Титанаты, цирконаты, гафнаты щелочных металлов растворяются в воде, их водные растворы неустойчивы и со временем разлагаются вследствие гидролиза. Для ускорения процесса через раствор пропускают углекислый газ:
K2TiO3 + (x+1)H2O + 2CO2 = TiO2∙xH2O↓ + 2KHCO3 Соединения двух- и трехвалентных металлов в воде нерастворимы, для их разложения используют кислоты. При длительном взаимодействии гидратированных диоксидов титана, циркония и гафния с концентрированными растворами щелочей образуются гексагидроксокомплексы, которые содержат октаэдрические анионы [M(OH)6]2-. Они могут быть выделены из растворов в виде солей с крупными катионами металлов, например K2[Ti(OH)6], K2[Hf(OH)6].
ПРОЦЕССЫ ОЛЯЦИИ И ОКСОЛЯЦИИ (ГИДРОКСИДЫ И ОСНОВНЫЕ СОЛИ ТИТАНА).
Со временем осадок титановой кислоты стареет за счет превращении гидроксильных мостиков в оксоловые:
Т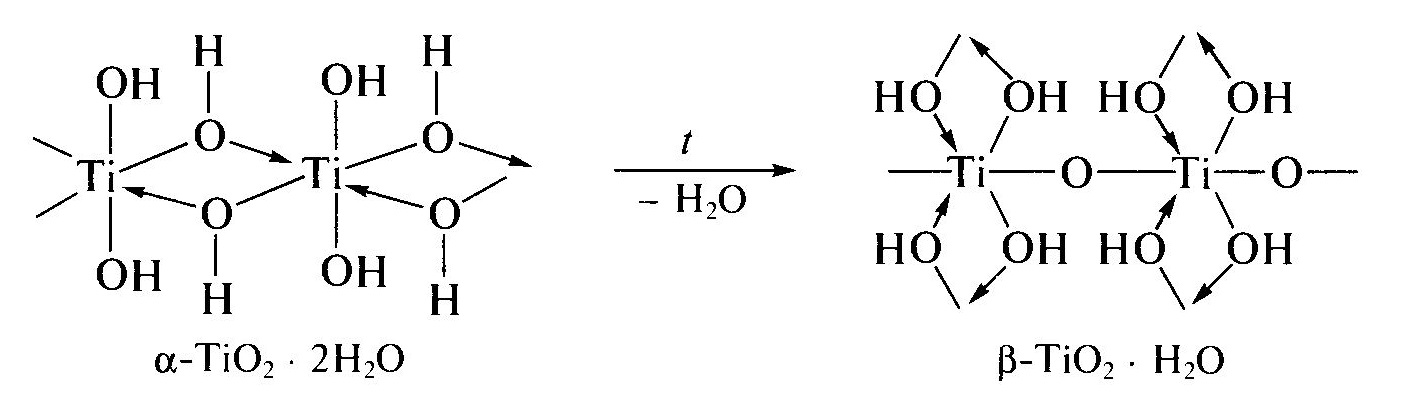 акой
процесс называют оксоляцией.
Ему способствует повышение температуры,
увеличение концентрации солей титана,
щелочная среда и длительное хранение
раствора. Оксоловый полимер (β-титановая
кислота, β-TiO2∙xH2O,
x≈1)
содержит меньшее число OH-групп
и молекул воды, за счет дополнительных
связей Ti-O-Ti
между разными макромолекулами приобретает
каркасное строение и поэтому отличается
химической инертностью – не реагирует
с растворами кислот и щелочей.
Процесс
оляции
- образование оловых мостиков
(гидроксомостиков) за
акой
процесс называют оксоляцией.
Ему способствует повышение температуры,
увеличение концентрации солей титана,
щелочная среда и длительное хранение
раствора. Оксоловый полимер (β-титановая
кислота, β-TiO2∙xH2O,
x≈1)
содержит меньшее число OH-групп
и молекул воды, за счет дополнительных
связей Ti-O-Ti
между разными макромолекулами приобретает
каркасное строение и поэтому отличается
химической инертностью – не реагирует
с растворами кислот и щелочей.
Процесс
оляции
- образование оловых мостиков
(гидроксомостиков) за
счет обобществления ОН-групп соседними молекулами мономера.
Гидроксид титана(II) — неорганическое соединение гидроокись металла титана с формулой Ti(OH)2, чёрный порошок, не растворимый в воде.
Гидроксид титана(III) — неорганическое соединение, гидроокись металла титана с формулой Ti(OH)3, коричнево-фиолетовый осадок, не растворимый в воде.
Оксид титана(IV) (диоксид титана, двуокись титана, титановые белила, пищевой краситель E171) TiO2 — амфотерный оксид четырёхвалентного титана. Является основным продуктом титановой индустрии (на производство чистого титана идёт лишь около 5 % титановой руды).
Соли титана в воде легко гидролизуются с образованием основной соли титана и серной кислоты.
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ ТИТАНА.
К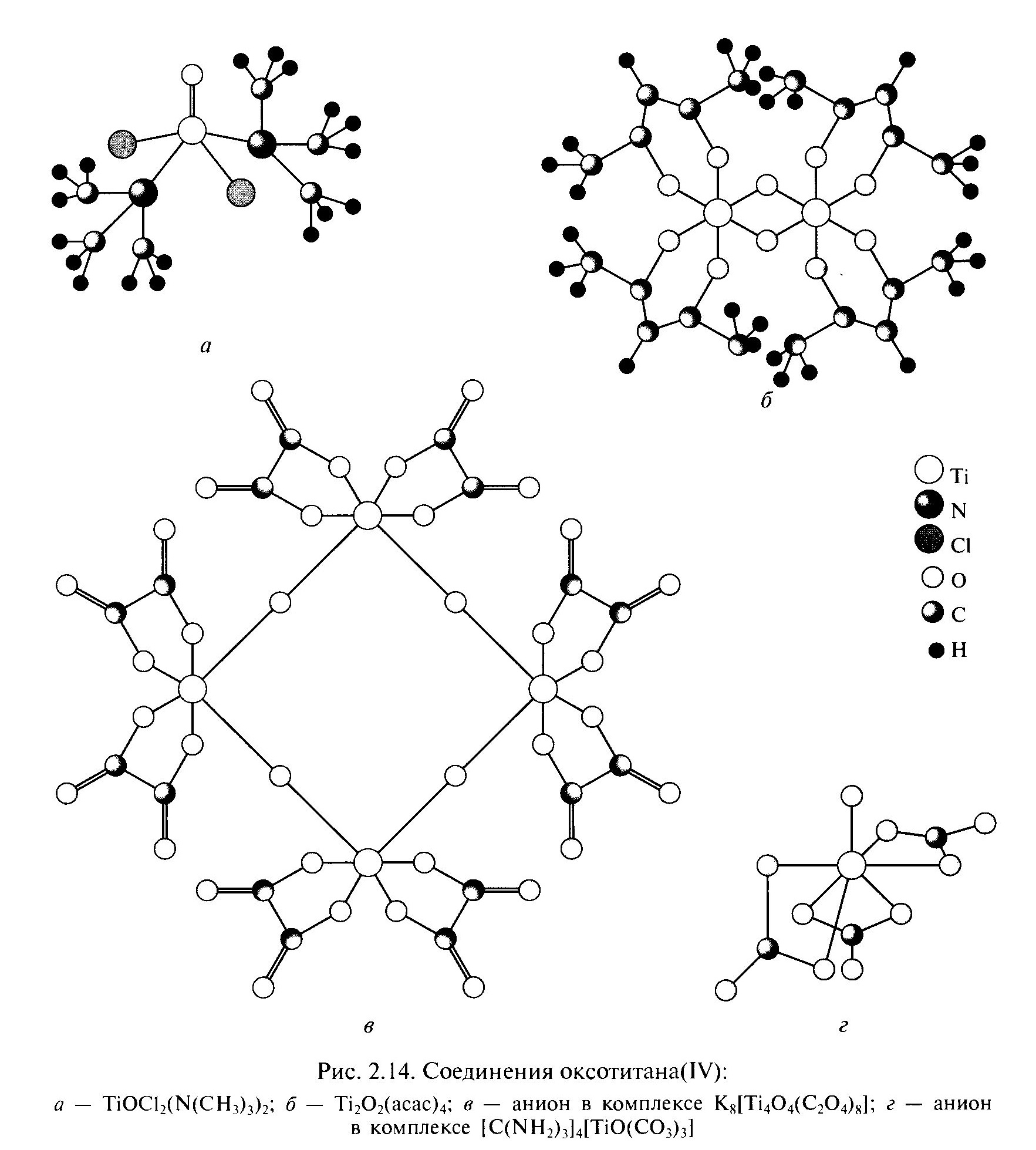 атионные
и нейтральные комплексы титана (IV)
часто представляют собой олигомеры с
мостиковыми атомами кислорода. Примером
могут служить биядерный ацетилацетонат
Ti2O2(асас)4
с мостиковыми атомами кислорода (рис
2,14 б), образующиеся при взаимодействии
бензольного раствора тетрохлорида
титана с бутиратом калия и ацетилацетоном,
или оксалатный комплекс K8[Ti4O4(C2O4)8],
представляющий собой циклический
тетрамер (рис 2,14 в). Аммиачные комплексы
титана (IV)
устойчивы лишь в неводной среде. Из них
стоит упомянуть димер [(NH3)5Ti-O-Ti(NH3)5]I4,
в котором два атома титана связаны между
собой оксомостиком.
атионные
и нейтральные комплексы титана (IV)
часто представляют собой олигомеры с
мостиковыми атомами кислорода. Примером
могут служить биядерный ацетилацетонат
Ti2O2(асас)4
с мостиковыми атомами кислорода (рис
2,14 б), образующиеся при взаимодействии
бензольного раствора тетрохлорида
титана с бутиратом калия и ацетилацетоном,
или оксалатный комплекс K8[Ti4O4(C2O4)8],
представляющий собой циклический
тетрамер (рис 2,14 в). Аммиачные комплексы
титана (IV)
устойчивы лишь в неводной среде. Из них
стоит упомянуть димер [(NH3)5Ti-O-Ti(NH3)5]I4,
в котором два атома титана связаны между
собой оксомостиком.
Сплавление диоксида титана с приросульфатом калия приводит к образованию комплексной соли:
TiO2 + 2K2S2O7 = K2[Ti(SO4)3] + K2SO4
всё до из учебника, после из интернета(в этом вопросе)
К наиболее известным комплексным соединениям титана относятся:
