
- •17.Элементы va группы: азот, фосфор, мышьяк, сурьма, висмут. Общая характеристика элементов.
- •Получение: Получают либо взаимодействием солей с nh3 в водном растворе, либо действием газообразного или жидкого nh3 на твердые соли. Например, аммиачный комплекс меди образуется в результате реакции:
- •Получение: Чистый n2o3 может быть получен в виде голубой жидкости при низких температурах (–20 с) из эквимолекулярной смеси no и no2.
- •Химические свойства:
- •Строение:в газовой фазе планарная молекула азотистой кислоты существует в виде двух конфигураций цис- и транс-. При комнатной температуре преобладает транс-изомер.
- •Получение:
- •Химические свойства:Типичный кислотный оксид. N2o5 легко летуч и крайне неустойчив. Разложение происходит со взрывом, чаще всего — без видимых причин:
- •Строение:
- •Стибин, или гидрид сурьмы, SbH3 — ядовитый газ, образующийся в тех же условиях, что и арсин. При нагревании он еще легче, чем арсин, разлагается на сурьму и водород.
- •Синтез:
- •Физические свойства:
- •Химические свойства:
- •Металлургия
- •Катализаторы
- •Термоэлектрические материалы
- •Детекторы ядерных излучений
- •Легкоплавкие сплавы
- •Измерение магнитных полей
- •Производство полония-210
- •Химические источники тока
- •Обработка прочных металлов и сплавов
- •Ядерная энергетика
- •Магнитные материалы
- •Медицина
- •Пигменты
- •Косметика
Строение:
Пары оксида фосфора(V) имеют состав P4O10. Твердый оксид склонен к полиморфизму. Существует в аморфном стекловидном состоянии и кристаллическом. Для кристаллического состояния известны две метастабильные модификации пентаоксида фосфора — гексагональная Н-форма (а = 0,744 нм, = 87°, пространств, гр. R3С) и орторомбическая О-форма (а = 0,923 нм, b = 0,718 нм, с = 0,494 нм, пространств, гр. Рпат), а также одна стабильная орторомбическая О-форма (а =1,63 нм, b= 0,814 нм, с =0,526 нм, пространств. гр. Fdd2). Молекулы P2O5 (Н-форма) построены из 4 групп PO4 в виде тетраэдра, вершины которого занимают атомы фосфора, 6 атомов кислорода располагаются вдоль ребер, а 4 — по оси третьего порядка тетраэдра. Эта модификация легко возгоняется (360оС) и активно взаимодействует с водой. Другие модификации имеют слоистую полимерную структуру из тетраэдров PO4, объединенные в 10-членные (О-форма) и 6-членные (О'-форма) кольца. Эти модификации имеют более высокую температуру возгонки (~580оС) и менее химически активны. H-форма переходит в О-форму при 300—360оC.
ОРТО-, ПИРО- И МЕТАФОСФОРНЫЕ КИСЛОТЫ, ИХ СОЛИ.
Фосфорные кислоты. Оксиду фосфора(V) отвечает несколько кислот.
Ортофосфорная кислота: Н3РO4 образует бесцветные прозрачные кристаллы, плавящиеся при 42,35 °С. В воде она растворяется очень хорошо. Ортофосфорная кислота не принадлежит к числу сильных кислот. Будучи трехосновной, она образует три ряда солей: средние и кислые с одним или с двумя атомами водорода в кислотном остатке. Средние соли фосфорной кислоты называют ортофосфатами или просто фосфатами, кислые — гидрофосфатами;
Na3PO4; Са3(РO4)2 — трехзамещенные, или средние фосфаты. Na2HPO4; СаНРO4 — двухзамещенные фосфаты, или гидрофосфаты. NaH2PO4; Са(Н2Р04)2 — однозамещенные фосфаты, или дигидрофосфаты.
Дигидрофосфаты растворимы в воде; из гидрофосфатов и средних фосфатов хорошо растворимы лишь соли щелочных металлов и аммония.
В водных растворах фосфаты гидролизуются. При этом растворы средних солей щелочных металлов имеют сильно щелочную реакцию. Например, рН 1 % раствора Na3P04 равен 12,1. В случае кислых солей гидролиз сопровождается диссоциацией кислотного остатка (см. § 92). Поэтому растворы гидрофосфатов щелочных металлов имеют слабо щелочную реакцию, а растворы дигидро-фосфатов этих „металлов — слабокислую. Например, рН 1% раствора Na2HP04 равен 8,9, a NaH2P04 —6,4.
В лаборатории фосфорную кислоту можно получать окислением фосфора 30 %-ной HN03. Реакция протекает согласно уравнению;
ЗР + 5HNO3 + 2Н2O = ЗН3РO4 + 5NO↑
В промышленности фосфорную кислоту получают двумя методами; экстракционным и термическим. В основе экстракционного метода лежит обработка природных фосфатов серной кислотой:
Са3(РO4)2 + 3H2SO4 = 3CaSO4↓ + 2Н3РO4
Образующуюся фосфорную кислоту отфильтровывают от сульфата кальция и концентрируют выпариванием. Термический метод состоит в восстановлении природных фосфатов до свободного фосфора с последующим его сжиганием и растворением образующегося фосфорного ангидрида в воде. Получаемая по этому методу термическая фосфорная кислота отличается более высокой чистотой и повышенной концентрацией.
Помимо производства удобрений, фосфорную кислоту используют при изготовлении реактивов, многих органических веществ, для создания защитных покрытий на металлах. Фосфаты кальция и аммония применяются при производстве эмалей, в фармацевтической промышленности.
Все другие фосфорные кислоты представляют собой продукты соединения тетраэдров РO4. В большинстве своем эти кислоты не выделены в свободном состоянии, а известны в виде смесей, в водных растворах или в виде солей. В зависимости от способа соединения групп РO4 в фосфатные комплексы эти кислоты разделяются на полифосфорные и метафосфорные кислоты. Полифосфорные кислоты и их соли — полифосфаты — построены из цепочек —РO3—О—РO3—. В метафосфорных кислотах и их солях—ме-тафосфатах — тетраэдры РO4 образуют кольца.
Из полифосфорных кислот в кристаллическом состоянии выделена только простейшая двуфосфорная (или пирофосфорная) кислота Н4Р2O7, образующая бесцветные кристаллы, плавящиеся при 61 °С. Ион P2O74- построен из двух тетраэдров РO4 с общим атомом кислорода.
Двуфосфорная кислота хорошо растворяется в воде и является несколько более сильной кислотой, чем H3PO4. Ее соли называются дифосфатами, или пирофосфатами.
Метафосфорные кислоты имеют общую формулу НnРnO3n, где n может принимать значения от 3 до 8; однако часто их состав выражают простейшей формулой НРO3. Эти кислоты представляют собою стеклообразные вещества. В раствор они переходят в виде полимеров, имеющих кольцевую структуру. С течением времени кольца расщепляются и образуются цепные полифосфорные кислоты. Метафосфорные кислоты ядовиты. Известны соли метафосфорных кислот—метафосфаты. Некоторые из них выделены в виде кристаллов, например Na3P3O9, Na4P4O12, Са3(Р3O9)2. Метафосфаты применяются для умягчения воды и снижения ее коррозионной активности, для удаления накипи с паровых котлов, а также входят в состав некоторых моющих средств.
СТРОЕНИЕ ФОСФОРНЫХ КИСЛОТ И ФОСФАТОВ.

Важнейшая из них — это ортофосфорная кислота Н3РО4, называемая обычно просто фосфорной. Другие фосфорные кислоты представляют собою полимерные соединения. В анионе всех фосфорных кислот атом фосфора, находящийся в состоянии 5р3-гибридизации, окружен четырьмя атомами кислорода, расположенными в вершинах тетраэдра. Ортофосфорная кислота построена из изолированных тетраэдров, в других фосфорных кислотах тетраэдры РO4 объединены через атомы кислорода в агрегаты, содержащие от двух до весьма большого числа — порядка 105—-атомов фосфора.
П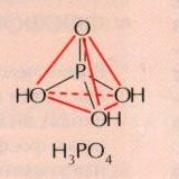 о
химическому строению молекула H3PO4
представляет собой искаженный тетраэдр
(sp3
– гибридизация
атома фосфора), в котором три вершины
заняты гидроксильными группами, а
четвертая – атомом кислорода:
о
химическому строению молекула H3PO4
представляет собой искаженный тетраэдр
(sp3
– гибридизация
атома фосфора), в котором три вершины
заняты гидроксильными группами, а
четвертая – атомом кислорода:
ГИДРОЛИЗ ФОСФАТОВ, ИХ ТЕРМИЧЕСКАЯ УСТОЙЧИВОСТЬ.
В водном растворе ортофосфаты подвергаются гидролизу, причем pH среды при переходе от средней соли к кислой закономерно снижается. Ниже приведены гидролитические реакции для 1%-ных растворов с указанием pH.
Na3PO4+H2O=NaOH+Na2HPO4, pH 12.1
Na2HPO4+H2O=NaOH+NaH2PO4, Ph 8.9
Полифосфаты и метафосфаты, как производные более сильных кислот, гидролизуются в меньшей степени. Однако их гидролиз сопровождается расщеплением цепи или распадом цикла, например:
(NaPO3)4+6H2O=2H4P2O7+4NaOH
У всех ортофосфатов есть свойство: безводные соли стабильны при нагревании до температуры плавления.
ФОСФОРНЫЕ УДОБРЕНИЯ.
К важнейшим минеральным удобрениям принадлежат фосфорные удобрения. Природные соединения фосфора — фосфориты и апатиты — содержат фосфор в виде нерастворимого среднего фосфата Са3(РO4)2, который плохо усваивается растениями. Для получения легко усваиваемых удобрений фосфориты подвергают химической переработке, заключающейся в превращении средней соли в кислую. Таким путем приготовляют наиболее важные фосфорные удобрения — суперфосфат, двойной суперфосфат и преципитат.
Для получения суперфосфата мелко размолотый природный фосфорит смешивают с серной кислотой. Смесь энергично перемешивают и загружают в непрерывно действующие камеры, где реакция заканчивается:
Са3(РO4)2 + 2H2SO4 = 2CaSO4 + Ca(H2PO4)2
В результате получается смесь сульфата кальция с дигидрофосфатом Са(Н2РO4)2, сравнительно легко растворимым в воде. Эта смесь в измельченном или гранулированном виде и называется суперфосфатом.
Простой суперфосфат — удобрение со сравнительно невысоким содержанием питательных веществ.
Двойной суперфосфат представляет собой продукт разложения природного фосфата фосфорной кислотой:
Са3(РO4)2 + 4Н3РO4 = ЗСа(Н2РO4)2
В двойном суперфосфате отсутствует сульфат кальция, что снижает затраты на его перевозку и внесение в почву.
Преципитат представляет собой фосфорное удобрение, в состав которого входит гндрофосфат кальция СаНРO4, нерастворимый в воде, но растворяющийся при его внесении в кислые почвы.
Описанные выше фосфорные удобрения называются простыми, так как содержат только один из необходимых растениям элементов. Более перспективными являются сложные минеральные удобрения, содержащие несколько питательных веществ (аммофос, нитрофоска и др.).
Аммофос получают путем взаимодействия фосфорной кислоты с аммиаком. В зависимости от степени нейтрализации образуется моноаммонийфосфат NH4H2PO4 или диаммонийфосфат (NH4)2HPO4.
Нитрофоска — тройное удобрение, содержащее азот, фосфор и калий. Получают нитрофоску сплавлением гидрофосфата аммония (NH4)2HPO4, нитрата аммония NH4NO3 и хлорида (или сульфата) калия.
ФОСФОРИСТЫЙ АНГИДРИД, ЕГО СТРОЕНИЕ, СВОЙСТВА, ПОЛУЧЕНИЕ.
Оксид фосфора(III), или фосфористый ангидрид, Р2O3 получается при медленном окислении фосфора или когда фосфор сгорает при недостаточном доступе кислорода. Это белые кристаллы, плавящиеся при 23,8 °С. Молекулярная масса его при низких температурах соответствует формуле Р4О6. При действии холодной воды оксид фосфора(III) медленно взаимодействует с ней, образуя фосфористую кислоту Н3РO3. Как оксид фосфора(III), так и фосфористая кислота обладают сильно выраженными восстановительными свойствами. Хорошо растворяется в органических растворителях (бензол, сероуглерод). Неустойчив на свету, вначале желтеет, а затем краснеет.
Оксид фосфора(III) существует в виде нескольких аллотропных модификаций. Одна из них имеет молекулярную решетку, в узлах которой дислоцированы димерные молекулы P4O6. Строение этой молекулы, а также структура полимерного оксида P2O3 таковы:
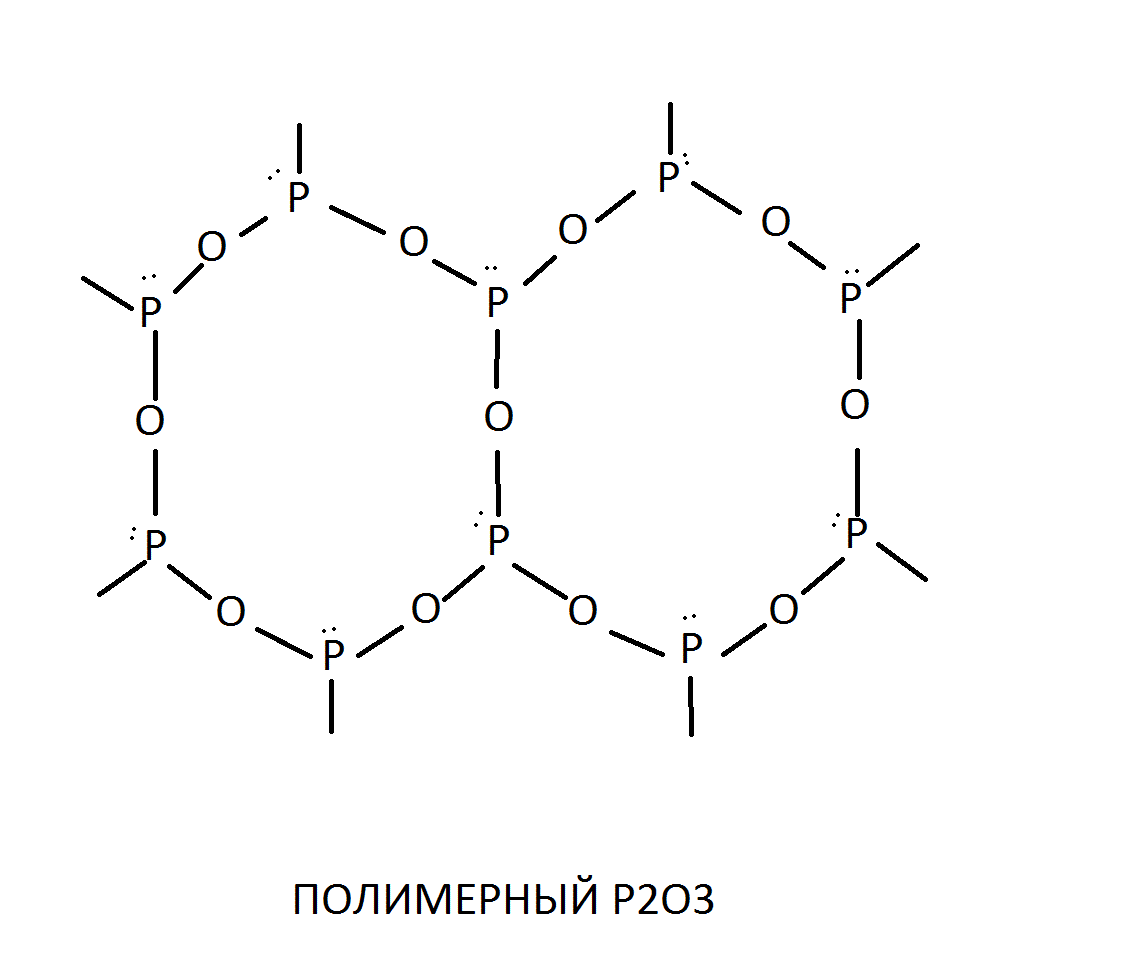

СВОЙСТВА И ПОЛУЧЕНИЕ ФОСФОРИСТОЙ КИСЛОТЫ, ЕЕ СТРУКТУРА, ОСНОВНОСТЬ.
Химический оксид фосфора (+3) имеет кислотную природу: Р2О3 + 3Н2О = 2Н3РО3 Фосфористая кислота - бесцветные легкоплавкие хорошо растворимые в воде кристаллы. По химическому строению она представляет собой искаженный тетраэдр, в центре которого находится атом фосфора с sр3 - гибридными орбиталями, а вершины заняты двумя гидроксогруппами и атомами водорода и кислорода. Атом водорода, непосредственно соединенный с фосфором, не способен к замещению, а потому фосфористая кислота максимум двухосновна и нередко ее изображают формулой Н2[НРО3]. Фосфористая кислота - кислота средней силы. Соли ее - фосфиты получают взаимодействием Р2О3 со щелочами:
Р2О3 + 4NаОН = 2Nа2НРО3 + Н2О
Фосфиты щелочных металлов и кальция легко растворимы в воде. При нагревании фосфористая кислота диспропорционирует:
4Н3РО3 = РН3 + 3Н3РО4
Фосфористая кислота окисляется многими окислителями, в том числе галогенами, например:
Н3РО3 + Сl2 + Н2О = Н3РО4 + 2НСl
Получают обычно фосфористую кислоту гидролизом тригалогенидов фосфора:
РГ3 + 3Н2О = Н3РО3 + 3НГ
ФОСФОРНОВАТИСТАЯ КИСЛОТА, СПОСОБЫ ПОЛУЧЕНИЯ, СТРОЕНИЕ, ОСНОВНОСТЬ.
H3PO2 — сильная одноосновная кислота. Бесцветное твердое вещество, растворимое в воде, спиртах и диоксане. Сама фосфорноватистая кислота и гипофосфиты являются сильнейшими восстановителями.
Фосфорноватистую кислоту получают в две стадии. На первой стадии белый фосфор обрабатывается растовором щелочи:
2Р4(белый) + 3Ва(ОН)2 + 6H2O → 2PH3 + 3Ва(Н2PO2)2
И затем выделяют кислоту, обрабатывая её соль более сильной кислотой (серной):
Ва(Н2PO2)2 + H2SO4 → BaSO4↓ + 2H3PO2
Молекула имеет форму тетраэдра с атомом фосфора в центре, в вершинах тетраэдра находятся два атома водорода, атом кислорода и гидроксогруппа. Поэтому фосфористая кислота, несмотря на наличие трех атомов водорода, является одноосновной.

МЫШЬЯК.
Мышьяк встречается в природе большей частью в соединениях с металлами или серой и лишь изредка в свободном состоянии. Содержание мышьяка в земной коре составляет 0,0005 % (масс). Обычно мышьяк получают из мышьяковистого колчедана FeAsS. При его нагревании в атмосфере воздуха образуется оксид мышьяка (III) As2O3, который далее восстанавливают углем до свободного мышьяка.
Подобно фосфору, мышьяк существует в нескольких аллотропических модификациях. Наиболее устойчив при обычных условиях и при нагревании металлический, или серый, мышьяк. Он образует серо-стальную хрупкую кристаллическую массу с металлическим блеском на свежем изломе. Плотность серого мышьяка равна 5,72 г/см3. При нагревании под нормальным давлением он сублимируется. В отличие от других модификаций, серый мышьяк обладает металлической электрической проводимостью.
В воде мышьяк нерастворим. На воздухе при комнатной температуре он окисляется очень медленно, а при сильном нагревании сгорает, образуя белый оксид As2O3 и распространяя характерный чесночный запах. При высокой температуре мышьяк непосредственно взаимодействует со многими элементами. Сильные окислители переводят его в мышьяковую кислоту, например:
2Аs + 5Сl2 + 8Н2O = 2H3AsO4 + 10НС1
Как свободный мышьяк, так и все его соединения — сильные яды. В соединениях мышьяк проявляет степень окисленности +5, +3 и -3.
АРСИН, РЕАКЦИЯ МАРША.
Гидрид мышьяка, или арсин, AsH3 представляет собой бесцветный, очень ядовитый газ с характерным чесночным запахом, мало растворимый в воде. Арсин образуется при восстановлении всех соединений мышьяка водородом в момент выделения. Например:
As2O3 + 6Zn + 6H2SO4 = 2AsH3↑ + 6ZnSO4 + 3H2O (РЕАКЦИЯ МАРША)
Проба Марша основывается на возможности восстановления соединений мышьяка (III) до арсина с помощью сильных восстановителей. Исследуемую пробу помещают в одну пробирку с соляной кислотой и добавляют к данной смеси металлический цинк. Добавка небольшого количества сульфата меди ускоряет реакцию, активируя цинк. Выделяющийся газообразный арсин пропускают через раскаленную стеклянную трубку. При наличии мышьяка в пробе на месте нагрева наблюдается образование зеркала металлического мышьяка. Германий и сурьма также дают металлические зеркала, которые, однако, не растворяются в аммиачном растворе перекиси водорода.
Арсин сравнительно нестоек и при нагревании легко разлагается на водород и свободный мышьяк. Это свойство арсина используется для открытия мышьяка в различных веществах. На анализируемое вещество действуют восстановителем и, если в нем содержится какое-либо соединение мышьяка или мышьяк в свободном состоянии, то образуется AsH3. Далее продукты восстановления нагревают, арсин разлагается, а выделяющийся мышьяк образует на холодных частях прибора характерный черный блестящий налет, называемый «мышьяковым зеркалом».
АРСЕНИДЫ, ИХ СВОЙСТВА И СТРОЕНИЕ.
С некоторыми металлами мышьяк образует соединения — арсениды, многие из которых можно рассматривать как продукты замещения водорода в арсине атомами металла — например, Cu3As, Ca3As2.
Арсениды – кристаллические, высокоплавкие соед. с металлическим блеском, обычно серебристо-белого или светло-серого цвета (иногда желтого или красного). Обладают полупроводниковой, полуметаллической или металлической (низшие) проводимостью. Некоторые арсениды переходных металлов, напр. Cr2As и Fe2As, - антиферромагнетики. Высокими точками Нееля отличаются CrAs (823 К), Mn2As (580 К). MnAs - ферромагнетик. Некоторые арсениды, напр. MoAs2, Pd2As, при Т <1 К становятся сверхпроводниками.
Щелочные металлы образуют арсениды типов MAs и M3As, для Na и К известны NaAs5 и KAs2. Из элементов подгруппы 1б Сu образует плавящийся конгруэнтно Cu3As наряду с др. низшими (напр., Cu8As, Cu6As) и высшими (напр., CuAs) А. Элементы II группы образуют А. типа M3As2, плавящиеся конгруэнтно, и высшие MAs2 (М - Be, Cd, Zn), MAs3 и MAs4 (М - щел.-зем. металл).
Элементы подгруппы IIIa, кроме Т1, образуют плавящиеся конгруэнтно моноарсениды MAs, кристаллизующиеся в структуре сфалерита. Это-полупроводники с понижающимися от В к In т-рами плавления и уменьшающейся шириной запрещенной зоны. Для В известен также низший арсенид B6As. Элементы подгруппы IVa (кроме С и Рb) образуют плавящиеся конгруэнтно MAs. Для Si и Ge также известны MAs2, для Sn - Sn3As4. Для элементов подгруппы Ti характерны соед. M4As, MAs, MAs2. Переходные металлы V-VII групп образуют А. состава M3As, M2As, M5As2, MAs, MAs2. Для этих элементов характерна тенденция к уменьшению числа образующихся А. при переходе от четвертого периода к пятому и шестому. Число А. уменьшается также при переходе от V к VII группе и снова увеличивается при переходе к подгруппе NL наиб. число А. известно для V (7) и для Ni (8), тогда как для Re и Os - только по одному (Re3As7 и OsAs2).
Существуют двойные арсениды: MM'As (напр., NaCdAs и FeMnAs), MM2'As2(CaNi2As2 и др.), MIIMIVAs2 (напр., CdGeAs2) и др. Известны тройные интерметаллич. соед. и соли со сложными анионами, напр. XAs4 (X = Ge, Si, Zn, Co и др.), способными образовывать цепочечные, слоистые и каркасные структуры. К А. близки соед. с двумя электроотрицат. элементами в молекуле. Это арсенофосфиды MAsP и арсенохалькогениды, в частности арсеносульфиды MAsS. Большинство из них - полупроводники.
А. щелочных металлов гидролизуются водой с выделением AsH3. Арсениды щел-зем. металлов с водой реагируют медленно, легко - с разб. к-тами. А. тяжелых металлов (d-элементов), как правило, с водой практически не взаимод., реагируют с к-тами и при сплавлении - со щелочами. С увеличением содержания As в молекуле хим. стойкость А. увеличивается. При действии окислителей или при нагр. на воздухе А. окисляются до арсенатов(Ш) или As2O3. Высшие А. при нагр. отщепляют часть As.
Известно ок. 25 прир. минералов, относящихся к А.; важнейшие из них - смальтин CoAs3_x, кобальтин CoAsS, никелин NiAs, лелингит FeAs2, арсенопирит FeAsS, сперрилит PtAs2.
А. получают чаще всего сплавлением As с соответствующим металлом в вакууме, инертной атмосфере, под давлением пара As или под слоем флюса, напр. В 9 О 3, а также действием пара As на металлы. Для получения мелких кристаллов или пленок используют хим. транспортные р-ции. А. могут быть получены взаимод. AsCl3 с металлами, AsH3 с их оксидами, р-рами солей или с металлоорг. соед., сплавлением As с галогенидами металлов, восстановлением арсенантов(V) или арсенатов(Ш) металлов водородом, взаимод. As с р-рами металлов в жидком NH3 и др.
А. применяют в осн. как полупроводниковые материалы. Св-ва важнейших А. приведены в таблице.
Арсенид алюминия Al As-серые кристаллы с металлич. блеском, решетка кубическая типа сфалерита (а =0,5662нм); неустойчив во влажном воздухе, водой и разб. к-тами разлагается с выделением AsH3. Полупроводниковый материал для солнечных батарей, компонент твердых р-ров с GaAs и др. соединениями типа AIIIBV, используемых в лазерах, фотодиодах и др.
Арсенид никеля NiAs - бронзово-желтые или светло-красные кристаллы с металлич. блеском, решетка гексагональная ( а =0,3963 нм, с = 0,5049 нм, z = 2, пространств. группа Р63/mmс); обладает металлич. проводимостью. Перспективен как компонент эвтектич. композиций с GaAs и InAs для приборов, действие к-рых основано на магнито-резистивном эффекте, для детекторов ИК-излучения и др. Перспективные полупроводниковые материалы-Zn3As2, Cd3As2, CdAs2, а также А. типа CdSiAs2.
СОЕДИНЕНИЯ МЫШЬЯКА (III).
Оксид мышьяка(III), или мышьяковистый ангидрид, As2O3 образуется при сгорании мышьяка на воздухе или при прокаливании мышьяковых руд. Это вещество белого цвета, которое называют белым мышьяком. Оксид мышьяка(III) довольно плохо растворяется вводе: насыщенный при 15°С раствор содержит всего 1,5%
As2O3. При растворении в воде оксид мышьяка (III) взаимодействует с нею, и образуется гидроксид мышьяка (III) или мышьяковистая кислота;
As2O3 + ЗН2O = 2As(OH)3
Гидроксид мышьяка(III) амфотерен, но у него преобладают кислотные свойства.
Ортомышьяковистая (или мышьяковистая) кислота Н3АsО3 в свободном состоянии не получена и известна лишь в водном растворе, в котором устанавливается равновесие:
H3AsO3 ↔ Н20 + HAsO2
Это равновесие сильно смещено вправо, т. е. преобладающей формой является метамышьяковистая кислота HAsO2. Константа диссоциации этой кислоты =6∙10-10. При действии щелочей на As2O3 получаются соли мышьяковистой кислоты — арсениты, например:
As2O3 + 6КОН = 2K3AsO3 + 3H2O
Соединения мышьяка(III) проявляют восстановительные свойства; при их окислении получаются соединения мышьяка (V).
СУЛЬФИДЫ И ТИОСОЛИ МЫШЬЯКА (III).
Сульфиды мышьяка: Если пропускать сероводород в подкисленный соляной кислотой раствор мышьяковистой кислоты, то образуется желтый осадок сульфида мышьяка (III) As2S3, нерастворимый в соляной кислоте. Происходящие реакции можно выразить уравнениями:
H3AsO3 + 3HCl ↔AsCl3 + ЗН2О
2AsCl3 + 3H2S = As2S3↓+ 6HC1
Аналогично можно получить желтый осадок сульфида мышьяка(V) As2S5, действуя сероводородом на раствор мышьяковой кислоты в присутствии соляной кислоты:
H3AsO4 + 5HCl ↔ AsCl5 + 4H2O
2AsCl5 + 5H2S = As2S5↓ + 10НСl
При взаимодействии сульфидов мышьяка с сульфидами щелочных металлов Na2S, K2S или с сульфидом аммония (NH4)2S образуются растворимые в воде соли тиомышьяковистой (H3AsS3) и тиомышьяковой (H3AsS4) кислот. Кислоты H3AsS3 и H3AsS4 можно рассматривать как соответствующие кислородсодержащие кислоты мышьяка, в которых весь кислород замещен серой:
As2S3 + 3Na2S = 2Na3AsS3 тиоарсенит натрия
As2S5 + 3Na2S = 2Na3AsS4 тиоарсенат натрия
СОЕДИНЕНИЯ МЫШЬЯКА (V).
Мышьяковая кислота H3AsO4 при обычных условиях находится в твердом состоянии; она хорошо растворима в воде. По силе мышьяковая кислота почти равна фосфорной. Соли ее — арсенаты— очень похожи на соответствующие фосфаты. Известны также мета- и двумышьяковая кислоты. При прокаливании мышьяковой кислоты получается оксид мышьяка (V), или мышьяковый ангидрид, As2O5 в виде белой стеклообразной массы.
Кислотные свойства мышьяковой кислоты выражены значительно сильнее, чем у мышьяковистой. В этом проявляется общая закономерность,согласно которой с повышением степени окисленности элемента кислотные свойства его гидроксидов усиливаются, а основные — ослабевают.
Будучи трехосновной, мышьяковая кислота образует средние (арсенаты) и кислые (гидро- и дигидроарсенаты) соли, например Na3AsO4, Na2HAsO4, NaH2AsO4.
В кислой среде мышьяковая кислота и арсенаты проявляют свойства окислителей.
СУРЬМА.
Сурьма обычно встречается в природе в соединении с серой — в виде сурьмяного блеска, или антимонита, Sb2S3. Несмотря на то, что содержание сурьмы в земной коре сравнительно невелико [0,00005 % (масс.)], сурьма была известна еще в глубокой древности. Это объясняется распространенностью в природе сурьмяного блеска и легкостью получения из него сурьмы. При прокаливании на воздухе сурьмяный блеск превращается в оксид сурьмы Sb2O3, из которого сурьма получается путем восстановления углем.
В свободном состоянии сурьма образует серебристо-белые кристаллы, обладающие металлическим блеском и имеющие плотность 6,68 г/см3. Напоминая по внешнему виду металл, кристаллическая сурьма отличается хрупкостью и значительно хуже проводит теплоту и электрический ток, чем обычные металлы. Кроме кристаллической сурьмы, известны и другие ее аллотропические видоизменения. Сурьму вводят в некоторые сплавы для придания им твердости. Сплав, состоящий из сурьмы, свинца и небольшого количества олова, называется типографским металлом или гартом и служит для изготовления типографского шрифта. Из сплава сурьмы со свинцом (от 5 до 15 %Sb) изготовляют пластины свинцовых аккумуляторов, листы и трубы для химической промышленности. Кроме того, сурьму применяют как добавку к германию для придания ему определенных полупроводниковых свойств.
СОЕДИНЕНИЯ СУРЬМЫ (III) И (V).
Оксид сурьмы(III), или сурьмянистый ангидрид, Sb2O3— типичный амфотерный оксид с некоторым преобладанием основных свойств. В сильных кислотах, например серной и соляной, оксид сурьмы (III) растворяется с образованием солей сурьмы (III):
Sb2O3 + 3H2SO4 = Sb2(SO4)3 + 3H2O
Оксид сурьмы (III) растворяется также в щелочах с образованием солей сурьмянистой H3SbO3 или метасуръмянистой HSbО2 кислоты. Например:
Sb2O3 + 2NaOH = 2NaSbO2 + Н2O
Сурьмянистая кислота, или гидроксид сурьмы(III), Sb(ОН)3 получается в виде белого осадка при действии щелочей на соли сурьмы (III):
SbCl3 + 3NaOH = Sb(OH)3↓+ 3NaCl
Осадок легко растворяется как в избытке щелочи, так и в кислотах.
Соли сурьмы(III), как соли слабого основания, в водном растворе подвергаются гидролизу с образованием основных солей:
SbCl3 + 2Н2O ↔ Sb(OH)2Cl + 2HС1
Образующаяся основная соль Sb(OH)2Cl неустойчива и разлагается с отщеплением молекулы воды:
Sb(OH)2Cl = SbOCl↓ + Н2O
В соли SbOCl группа SbO играет роль одновалентного металла; эту группу называют антимонилом. Полученная основная соль называется или хлоридом антимонила, или хлороксидом сурьмы.
Оксид сурьмы (V), или сурьмяный ангидрид, Sb2O5 обладает главным образом кислотными свойствами; ему соответствует сурьмяная кислота, существующая в водном растворе в нескольких формах. Соли сурьмяной кислоты называются антимонатами.
ОКСИДЫ СУРЬМЫ.
Оксид сурьмы(III): или сурьмянистый ангидрид, Sb2O3 - типичный амфотерный оксид с некоторым преобладанием основных свойств. Нерастворим, образует минералы. В сильных кислотах, например серной и соляной, оксид сурьмы (III) растворяется с образованием солей сурьмы (III), в щелочах с образованием солей сурьмянистой H3SbO3 или метасурьмянистой HSbO2 кислоты. Например: Sb2O3 + 2NaOH = 2NaSbO2 + Н2О Оксид сурьмы(V): или сурьмяный ангидрид, Sb2O5 обладает главным образом кислотными свойствами; желтые кристаллы, растворяется в воде, образуя сурьмяную кислоту, пигмент для керамики. Оксид сурьмы(IV): Sb2O4 образуется при нагревании на воздухе до 800-900° оксида сурьмы(III) или (V). Белый, едва растворимый в воде порошок, при очень сильном нагревании отщепляет кислород с образованием оксида сурьмы(III). Согласно рентгеноструктурным исследованиям, соответствует двойному оксиду сурьмы(III) и (V) или ортоантимонату трехвалентной сурьмы SbIIISbVO4. Легко восстанавливается углем до металла.
СУРЬМЯНИСТАЯ И СУРЬМЯНАЯ КИСЛОТЫ, ИХ СТРОЕНИЕ(про строение не найдено).
Сурьмяная кислота существует в растворе в нескольких формах, например, гексагидроксосурьмяная H[Sb(OH)6]. При осаждении получают гель с переменным содержанием воды, при длительном высушивании — нерастворимую метасурьмяную кислоту HSbO3.
Гидроксид сурьмы(III) или сурьмянистая кислота H3SbO3, получается в виде белого осадка при действии щелочей на соли сурьмы(III): SbCl3 + 3NаОН = Sb (OH)3 +3NaCl Осадок легко растворяется как в избытке щелочи, так и в кислотах. При стоянии даже в воде легко переходит в кристаллический Sb2O3.
АНТИМОНИТЫ И АНТИМОНАТЫ.
Соли сурьмяной кислоты называются антимонатами (антимониатами) или оксистибатами.
Антимониты - соли не выделенной в свободном состоянии сурьмянистой кислоты H3SbO3.
СУЛЬФИДЫ И ТИОСОЛИ СУРЬМЫ.
Сульфиды сурьмы Sb2S3 и Sb2S5 по свойствам аналогичны сульфидам мышьяка. Они представляют собой вещества оранжево-красного цвета, растворяющиеся в сульфидах щелочных металлов и аммония с образованием тиосолей. Сульфиды сурьмы используются при производстве спичек и в резиновой промышленности.
ГАЛОГЕНИДЫ СУРЬМЫ, ИХ СТРОЕНИЕ, ГИДРОЛИЗ.
Трифторид SbF3-бесцветные кристаллы; растворим в воде (83,12% по массе при 25 °С), водных растворах HF, метаноле (54 г в 100 мл); при нагревании на воздухе образует Sb3O2(OH)2F3 и затем SbOF (см. также табл.). Получают взаимодействием Sb2O3, реже SbCl3 с фтористоводородной кислотой; фторирующий реагент в органическое синтезе, протрава при крашении и набивке тканей.
Пентафторид
SbF5-вязкая
жидкость; образует полимеры, устойчивые
в парах до 200-250 °С; хорошо растворим в
воде, жидком HF (с понижением степени
полимеризации и образованием ионов![]() и
и![]() ),
в HSO3F;
образует дигидрат; сильная кислота
Льюиса, растворы SbF5
в HF и HSO3F-сверхкислоты;
с I2
образует
SbIF5
и Sb2IF10,
с серой-SbSF3,
с SbF3-фториды
общей формулы SbF5•(SbF3)n,
где n = 2-5, а также 3SbF5
• 5SbF3;
получают фторированием Sb или Sb2O3,
взаимодействие SbСl5
с HF;
фторирующий реагент в органическое
синтезе, в частности в производстве
фреонов и фторопластов, катализатор
гидрирования и изомеризации.
),
в HSO3F;
образует дигидрат; сильная кислота
Льюиса, растворы SbF5
в HF и HSO3F-сверхкислоты;
с I2
образует
SbIF5
и Sb2IF10,
с серой-SbSF3,
с SbF3-фториды
общей формулы SbF5•(SbF3)n,
где n = 2-5, а также 3SbF5
• 5SbF3;
получают фторированием Sb или Sb2O3,
взаимодействие SbСl5
с HF;
фторирующий реагент в органическое
синтезе, в частности в производстве
фреонов и фторопластов, катализатор
гидрирования и изомеризации.
Т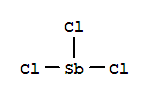 рихлорид
SbСl3-бесцв.
кристаллы ромбич. сингонии; хорошо
растворим в соляной кислоте, воде (~9% по
массе при 25 °С), СНСl3,
ССl4,
бензоле, СS2,
диоксане и др.; легко гидролизуется,
образуя ряд оксохлоридов; кислота
Льюиса; образует аддукты с ацетоном,
триметиламином и др.; иногда выступает
в роли донора электронов, например в
Fe(CO)3(SbCl3)2,
Ni(CO)3SbCl3;
получают взаимодействием конц. соляной
кислоты с Sb2O3;
применяют для получений чистой Sb, как
катализатор в органическое синтезе,
для хлорирования олефинов, гидрокрекинга,
как протраву при крашении тканей, жидкий
SbCl3-неводный
растворитель. С водой образует НС1 и
SbOCl.
рихлорид
SbСl3-бесцв.
кристаллы ромбич. сингонии; хорошо
растворим в соляной кислоте, воде (~9% по
массе при 25 °С), СНСl3,
ССl4,
бензоле, СS2,
диоксане и др.; легко гидролизуется,
образуя ряд оксохлоридов; кислота
Льюиса; образует аддукты с ацетоном,
триметиламином и др.; иногда выступает
в роли донора электронов, например в
Fe(CO)3(SbCl3)2,
Ni(CO)3SbCl3;
получают взаимодействием конц. соляной
кислоты с Sb2O3;
применяют для получений чистой Sb, как
катализатор в органическое синтезе,
для хлорирования олефинов, гидрокрекинга,
как протраву при крашении тканей, жидкий
SbCl3-неводный
растворитель. С водой образует НС1 и
SbOCl.
Пентахлорид SbСl5-бесцв. (часто желтая из-за примеси Cl2) жидкость; разлагается выше 106°С; сильная кислота Льюиса; с водой образует моно- и тетрагидраты; гидролизуется водой; получают хлорированием расплава SbСl3; применяют для получения Sb высокой чистоты, как хлорирующий реагент. С водой образует Н3SbO4
Трибромид (бесцв.)
SbBr3
и трииодид (красный) SbI3-кристаллы;
хорошо растворим в воде, СS2,
ацетоне, СНСl3
и др.; образуют аддукты с эфирами,
альдегидами, меркаптанами и др.; легко
гидролизуются; получают из элементов;
применяют для синтеза др. соединение
Sb (в частности, SbSI, SbSeI, SbSBr, обладающих
полупроводниковыми, пироэлектрич. и
др. свойствами). Пентабромид SbВr5
существует в виде аддуктов, например
SbBr5•O(C2H5)2,
пентаиодид-красные кристаллы с температура
плавления 79 °С, температура кипения 401
°С.

Известны также оксигалогениды SbOX и др., халькогалогениды SbYX (Y = Se, S, Fe, X = Cl, Br, I), смешанные галогениды, фтороантимонаты, хлороантимонаты и др, комплексные сурьмы галогениды.
С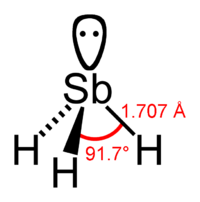 ТИБИН,
ПОЛУЧЕНИЕ, СВОЙСТВА, СТРОЕНИЕ.
ТИБИН,
ПОЛУЧЕНИЕ, СВОЙСТВА, СТРОЕНИЕ.
