- •17.Элементы va группы: азот, фосфор, мышьяк, сурьма, висмут. Общая характеристика элементов.
- •Получение: Получают либо взаимодействием солей с nh3 в водном растворе, либо действием газообразного или жидкого nh3 на твердые соли. Например, аммиачный комплекс меди образуется в результате реакции:
- •Получение: Чистый n2o3 может быть получен в виде голубой жидкости при низких температурах (–20 с) из эквимолекулярной смеси no и no2.
- •Химические свойства:
- •Строение:в газовой фазе планарная молекула азотистой кислоты существует в виде двух конфигураций цис- и транс-. При комнатной температуре преобладает транс-изомер.
- •Получение:
- •Химические свойства:Типичный кислотный оксид. N2o5 легко летуч и крайне неустойчив. Разложение происходит со взрывом, чаще всего — без видимых причин:
- •Строение:
- •Стибин, или гидрид сурьмы, SbH3 — ядовитый газ, образующийся в тех же условиях, что и арсин. При нагревании он еще легче, чем арсин, разлагается на сурьму и водород.
- •Синтез:
- •Физические свойства:
- •Химические свойства:
- •Металлургия
- •Катализаторы
- •Термоэлектрические материалы
- •Детекторы ядерных излучений
- •Легкоплавкие сплавы
- •Измерение магнитных полей
- •Производство полония-210
- •Химические источники тока
- •Обработка прочных металлов и сплавов
- •Ядерная энергетика
- •Магнитные материалы
- •Медицина
- •Пигменты
- •Косметика
Получение: Чистый n2o3 может быть получен в виде голубой жидкости при низких температурах (–20 с) из эквимолекулярной смеси no и no2.
Рекомендуется капать 50%-ю азотную кислоту на твёрдый оксид мышьяка(III):
![]()
N2O3 образуется при охлаждении получающейся смеси газов.
При пропускании электрического разряда через жидкий воздух, N2O3 можно получить в виде порошка голубого цвета:
![]() ;
;
![]() ;
;
![]()
Также N2O3 можно получить действием 50%-ой азотной кислоты на крахмал:
![]()
Химические свойства:
Кислотный оксид.
N2O3
подвержен термической диссоциации:
![]()
При 25 °C содержание N2O3 в смеси газов составляет около 10,5 %. Жидкий оксид азота(III) синего цвета, он также частично диссоциирован.
Являясь азотистым ангидридом, при взаимодействии с водой N2O3 даёт азотистую кислоту:
![]()
При взаимодействии с растворами щелочей образуются соответствующие нитриты:
![]()
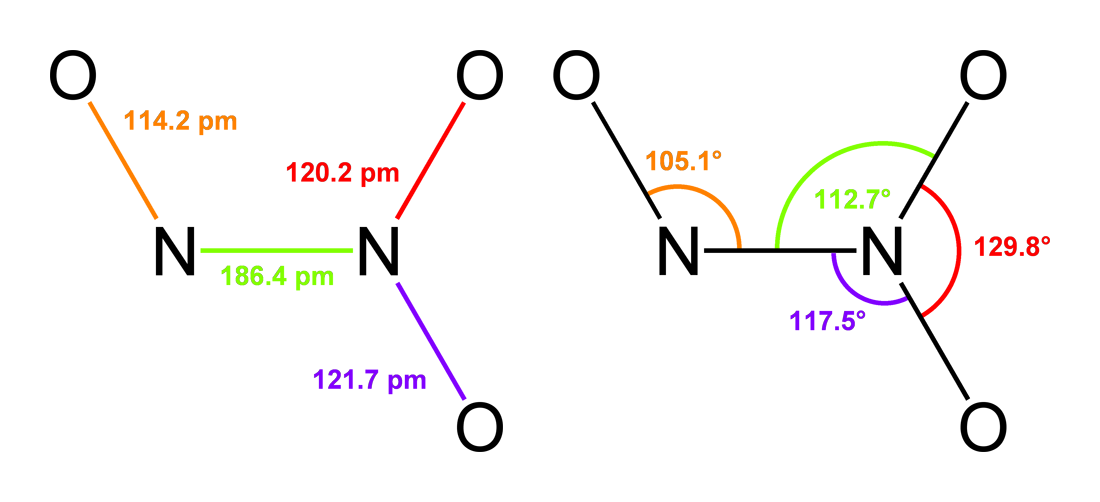
АЗОТИСТАЯ КИСЛОТА, СПОСОБЫ ПОЛУЧЕНИЯ, СТРОЕНИЕ.
Если нагревать нитрат калия или натрия, то они теряют часть кислорода и переходят в соли азотистой кислоты HN02. Разложение идет легче в присутствии свинца, связывающего выделяющийся кислород:
KNO3 + Рb = КNO2+ РbО
Она принадлежит к числу слабых кислот (K = 4∙10-4) и известна только в сильно разбавленных водных растворах. При концентрировании раствора или при его нагревании азотистая кислота распадается:
2HNO2 = NO + NO2 + Н2O
Строение:в газовой фазе планарная молекула азотистой кислоты существует в виде двух конфигураций цис- и транс-. При комнатной температуре преобладает транс-изомер.
|
|
транс-изомер |
цис-изомер |
Вторая структура является более устойчивой. Так, для цис-HNO2(г) ΔG° = −42,59 кДж/моль, а для транс-HNO2(г) ΔG = −44,65 кДж/моль.
Азотистую кислоту можно получить при растворении оксида азота (III) N2O3 в воде:
Также она получается при растворении в воде оксида азота (IV) NO2:
![]()
ОКИСЛИТЕЛЬНОЕ И ВОССТАНОВИТЕЛЬНОЕ ДЕЙСТВИЕ.
Степень окисленности азота в азотистой кислоте равна + 3, т. е. является промежуточной между низшими и высшей из возможных значений, степени окисленности азота. Поэтому HNO2 проявляет окислительно-восстановительную двойственность. Под действием восстановителей она восстанавливается (обычно до NO), а в реакциях с окислителями — окисляется до HNO3. Примерами могут служить следующие реакции:
2HNO2 + 2KI + H2SO4 = 2NO↑ + I2 + K2SO4 + 2H2O
5HNO2 + 2KMnO4 + 3H2SO4 = 5HNO3 + 2MnSO4 + K2SO4 + 3H2O
СОЛИ АЗОТИСТОЙ КИСЛОТЫ.
Соли азотистой кислоты — нитриты — образуют кристаллы, хорошо растворимые в воде (за исключением нитрита серебра). Нитриты термически менее устойчивы, чем нитраты. Нитрит натрия NaNO2 применяется при производстве различных красителей.
При действии на раствор какого-нибудь нитрита разбавленной серной кислотой получается свободная азотистая кислота:
2NaNO2 + H2SO4 = Na2SO4 + 2HNO2
АЗОТНЫЙ АНГИДРИД, СВОЙСТВА, СТРОЕНИЕ, СПОСОБЫ ПОЛУЧЕНИЯ.
Оксид азота (V), или азотный ангидрид, N2O5 — белые кристаллы, уже при комнатной температуре постепенно разлагающиеся на NO2 и O2. Он может быть получен действием фосфорного ангидрида на азотную кислоту:
2HNO3 + Р2O5 = N2O5 + 2НРО3
Оксид азота (V) —очень сильный окислитель. Многие органические вещества при соприкосновении с ним воспламеняются. В воде оксид азота (V) хорошо растворяется с образованием азотной кислоты.
Газообразный
азотный ангидрид состоит из отдельных
молекул, строение которых отвечает
формуле O2N-О-NO2
и имеет неплоскую структуру. В твердом
состоянии N2O5
образован нитратным ионом NO3-
и ионом нитрония NO2+.
Последний содержит такое же число
электронов, что и молекула СO2
и, подобно последней, имеет линейное
строение: О = N+
= О. В парах молекула N2O5 симметрична; ее
строение может быть представлено
следующей валентной схемой, в которой
пунктиром показаны трехцентровые
связи.