
- •17.Элементы va группы: азот, фосфор, мышьяк, сурьма, висмут. Общая характеристика элементов.
- •Получение: Получают либо взаимодействием солей с nh3 в водном растворе, либо действием газообразного или жидкого nh3 на твердые соли. Например, аммиачный комплекс меди образуется в результате реакции:
- •Получение: Чистый n2o3 может быть получен в виде голубой жидкости при низких температурах (–20 с) из эквимолекулярной смеси no и no2.
- •Химические свойства:
- •Строение:в газовой фазе планарная молекула азотистой кислоты существует в виде двух конфигураций цис- и транс-. При комнатной температуре преобладает транс-изомер.
- •Получение:
- •Химические свойства:Типичный кислотный оксид. N2o5 легко летуч и крайне неустойчив. Разложение происходит со взрывом, чаще всего — без видимых причин:
- •Строение:
- •Стибин, или гидрид сурьмы, SbH3 — ядовитый газ, образующийся в тех же условиях, что и арсин. При нагревании он еще легче, чем арсин, разлагается на сурьму и водород.
- •Синтез:
- •Физические свойства:
- •Химические свойства:
- •Металлургия
- •Катализаторы
- •Термоэлектрические материалы
- •Детекторы ядерных излучений
- •Легкоплавкие сплавы
- •Измерение магнитных полей
- •Производство полония-210
- •Химические источники тока
- •Обработка прочных металлов и сплавов
- •Ядерная энергетика
- •Магнитные материалы
- •Медицина
- •Пигменты
- •Косметика
Получение: Получают либо взаимодействием солей с nh3 в водном растворе, либо действием газообразного или жидкого nh3 на твердые соли. Например, аммиачный комплекс меди образуется в результате реакции:
Cu2+ + 4NH3 → [Cu(NH3)4]2+
Водный раствор аммиака при взаимодействии с ионами меди (II) сначала осаждает основные соли переменного состава зеленого цвета, легкорастворимые в избытке реагента. При этом образуется аммиачный комплекс меди сине-фиолетового цвета:
Cu2+ + 4NH4OH = [Cu(NH3)4]2+ + 4H2O
ДРУГИЕ ВОДОРОДНЫЕ СОЕДИНЕНИЯ АЗОТА – ГИДРАЗИН, ГИДРОКСИЛАМИН, АЗОТИСТОВОДОРОДНАЯ КИСЛОТА И ЕЕ СОЛИ. ПОЛУЧЕНИЕ, СТРОЕНИЕ, СВОЙСТВА И ПРИМЕНЕНИЕ ЭТИХ СОЕДИНЕНИЙ.
Гидразин: Гидразин N2H4 — бесцветная жидкость, кипящая при 113,5°С, получается при действии гипохлорита натрия NaCIO на концентрированный раствор аммиака.
Структурная формула
гидразина:
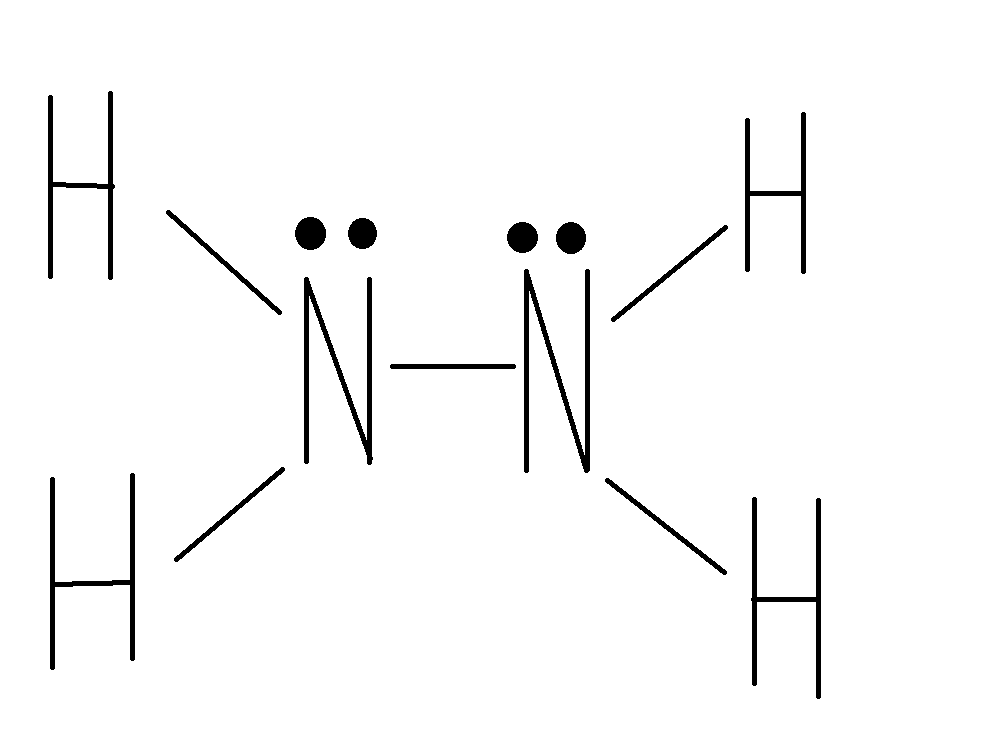
В молекуле гидразина атомы азота имеют неподеленные пары электронов. Это обусловливает способность гидразина к реакциям присоединения. Гидразин хорошо растворяется в воде, а при взаимодействии с кислотами присоединяет по донорно-акцепторному способу один или два иона водорода, образуя два ряда солей — например хлориды гидразония N2H4∙HC1 и N2H4∙2HC1. Таким образом, гидразин обладает основными свойствами.
Гидразин — хороший восстановитель. При его горении в атмосфере воздуха или кислорода выделяется очень большое количество теплоты, вследствие чего гидразин нашел применение в качестве составной части топлива ракетных двигателей. Гидразин и все его производные сильно ядовиты.Гидразин применяют в органическом синтезе, в производстве пластмасс, резины, инсектицидов, взрывчатых веществ, в качестве компонента ракетного топлива.
Гидразина сульфат применяется в случае таких заболеваний, как неоперабельные прогрессирующие распространенные формы, рецидивы и метастазы злокачественных опухолей — рак легкого (особенно немелкоклеточный), молочных желез, желудка, поджелудочной железы, гортани, эндометрия, шейки матки, десмоидный рак, саркома мягких тканей, фибросаркома, нейробластома, лимфогранулематоз, лимфосаркома (монотерапия или в составе полихимиотерапии).
Гидразин и его производные, такие как метилгидразин, несимметричный диметилгидразин и их смеси (аэрозин) широко распространены как ракетное горючее. Они могут быть использованы в паре с самыми разными окислителями, а некоторые и в качестве однокомпонентного топлива, в этом случае рабочим телом двигателя являются продукты разложения на катализаторе. Последнее удобно для маломощных двигателей. Во время Второй мировой войны гидразин был применён в Германии на реактивных истребителях «Мессершмитт Ме-16З».
Гидроксиламин: NH2OH-бесцветные кристаллы ( темп.плавл. около 33°С).
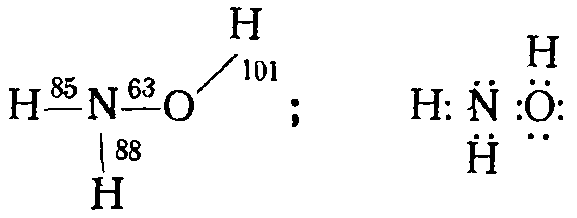
В молекуле гидроксиламина атом азота имеет неподеленную пару электронов. Поэтому, подобно аммиаку и гидразину, он способен к реакциям присоединения с образованием связей по донорно-акцепторному способу. Гидроксиламин хорошо растворяется в воде, а с кислотами дает соли, например хлорид гидроксиламмония (NНзОН)Сl. Степень окисленности азота в гидроксиламине равна —1. Поэтому он проявляет как восстановительные, так и окислительные свойства. Однако более характерна восстановительная способность гидроксиламина. В частности, он применяется как восстановитель (главным образом в виде солей) в лабораторной практике. Кроме того, его используют в производстве некоторых органических веществ. В лаборатории получают разложением в вакууме солей гидроксиламина: (NH3OH)3PO4 или [Mg(NH2OH)6](ClO4)2.
Спиртовой раствор гидроксиламина можно получить действием этанола на NH3OHCl.
В промышленности соли гидроксиламина получают восстановлением NO водородом в присутствии платинового катализатора или гидрированием азотной кислоты, а также действием на азотную кислоту атомарным водородом:
![]()
Азотистоводородная кислота и ее соли: Азидоводород, или азотистоводородная кислота, HN3 может быть получен действием азотистой кислоты HNO2 на водный раствор гидразина; он представляет собой бесцветную жидкость (темп. кип. 36 °С) с резким запахом.
Азидоводород принадлежит к числу слабых кислот (K= 3∙10-5). В водном растворе он диссоциирует на ионы Н+ и N3-. Анион азидоводорода имеет линейное строение. Как сам азидоводород, так и его соли — азиды — очень взрывчаты. Азид свинца Pb(N3)2 применяется для снаряжения капсюлей-детонаторов.
Азиды — в неорганической химии — соли азотистоводородной кислоты HN3 либо соединения неионной природы, содержащие псевдогалогенную азидную группу –N=N+=N-.
Наиболее изучены азиды металлов, среди них известны как простые азиды Mn+(N3-)n, так и двойные (например, K2Cd(N3)4) и смешанные (например, Zn(N3)Cl) азиды. Известны также азиды псевдогалогенной природы - как собственно псевдогалогены фтор-, хлор-, бром- и йодазиды Hal-N3, так и аналоги галогенангидридов кислот (например, карбонилдиазид CO(N3)2 и азидокарбондисульфид (SCSN3)2).
Неорганические азиды в основном образуют металлы с общей формулой Me(N3)n, где n — степень окисления. Многие азиды нестабильны, некоторые используются в качестве взрывчатых веществ (ВВ). Азид свинца применяется как инициирующее ВВ в капсюлях-детонаторах, азид натрия — в автомобильных подушках безопасности.
Азид меди обладает высокой мощностью взрыва и чувствительностью. Азиды серебра, ртути, золота обладают очень большой энергией взрыва.
Азиды щелочных металлов (кроме лития) и тяжелых металлов при нагревании разлагаются на металл и азот, что служит способом получения очень чистых щелочных металлов. Азиды щелочноземельных металлов и лития разлагаются на нитрид металла и азот. Азиды нашли различное применение в производстве химикатов, красителей, пластмасс, резины и в металлургии. Некоторые соединения используются для очистки сточных вод и в качестве химических промежуточных веществ в синтезе, добавок к пищевым продуктам, а также дезинфицирующих средств в жидкостях для мытья посуды и бассейнах.
ГАЛОИДНЫЕ СОЕДИНЕНИЯ АЗОТА.
С галогенами азот непосредственно не взаимодействует, поэтому все галогениды азота получают косвенным путем, например фтористый азот NF3 - при взаимодействии фтора с аммиаком. Как правило, галогениды азота - малостойкие соединения ( за исключением NF3 ) и разлагаются со взрывом.
Водород в аммиаке может замещаться также галогенами. Так, при действии хлора на концентрированный раствор хлорида аммония получается нитрид хлора, или хлористый азот, NC13: NH4CI + ЗСl2 = NCl3 + 4НСl в виде тяжелой маслянистой взрывчатой жидкости.
Подобными же свойствами обладает нитрид иода (йодистый азот), образующийся в виде черного, нерастворимого в воде порошка при действии иода на аммиак. Во влажном состоянии он безопасен, но высушенный взрывается от малейшего прикосновения; при этом выделяются пары иода фиолетового цвета. С фтором азот образует устойчивый фторид азота NF3.
Электроотрицательность хлора и йода меньше, а фтора больше, чем электроотрицательность азота. Отсюда следует, что в соединениях NCl3 и NI3 степень окисленности азота равна —3, а в NF3 она равна +3. Поэтому фторид азота отличается по свойствам от нитридов хлора и иода. Например, при взаимодействии с водою NCl3 или NI3 образуется аммиак, а в случае NF3 получается оксид азота (Ш);
NCl3 + ЗН2O = NH3 + ЗНОСl
2NF3 + 3H2O = N203 + 6HF
ИХ СТРОЕНИЕ.(не нашла)
ОКСИД АЗОТА (II).
Оксид азота(II), или окись азота, NO представляет собой бесцветный трудно сжижаемый газ. Жидкий оксид азота (II) кипит при —151,7°С и затвердевает при —163,7°С. В воде он мало растворим. Электронная структура молекулы NO лучше всего описывается методом МО. Молекула NO имеет на один электрон больше, чем молекулы N2 и СО: этот электрон находится на разрыхляющей орбитали πразр2р. Таким образом, число связывающих электронов превышает здесь число разрыхляющих на пять. Это соответствует кратности связи 2,5 (5:2=2,5). Действительно, энергия диссоциации молекулы NO на атомы (632 кДж/моль) имеет промежуточное значение по сравнению с соответствующими величинами для молекулы O2 (498 кДж/моль), в которой кратность связи равна двум, и молекулы N2 (945 кДж/моль), где связь тройная. Вместе с тем, по энергии диссоциации молекула NO близка к молекулярному иону кислорода O2+ (644 кДж/моль), в котором кратность связи также равна 2,5.При отрыве от молекулы NO одного электрона образуется ион NO+ не содержащий разрыхляющих электронов; кратность связи между атомами возрастает при этом до трех (шесть связывающих электронов). Поэтому энергия диссоциации иона NO+ (1050 кДж/моль) выше энергии диссоциации молекулы NO и близка к соответствующей величине для молекулы СО (1076 кДж/моль), в которой кратность связи равна трем.
СПОСОБЫ ПОЛУЧЕНИЯ В ТЕХНИКЕ И ЛАБОРАТОРИИ, ХИМИЧЕСКИЕ СВОЙСТВА.
В лаборатории оксид азота (II) обычно получают взаимодействием 30—35 %-ной азотной кислоты с медью: 3Cu + 8HN03 = 3Cu(N03)2 + 2NO↑ + 4Н20
Более чистый, не загрязнённый примесями NO можно получить по реакциям:
![]()
![]()
Промышленный способ основан на окислении аммиака при высокой температуре и давлении при участии Pt, Cr2O3 (как катализаторов):
![]()
По химическим свойствам оксид азота (II) относится к числу безразличных оксидов, так как не образует никакой кислоты.
Подобно N2O оксид азота (II) термодинамически неустойчив—• стандартная энергия Гиббса его образования положительна (ΔGобр — 86,6 кДж/моль). Но, опять-таки подобно N2O, при комнатной температуре NO не разлагается, потому что его молекулы достаточно прочны. Лишь при температурах выше 1000 °С его распад на азот и кислород начинает протекать с заметной скоростью. При очень высоких температурах распад NO проходит не до конца — в системе NO—N2—O2 устанавливается равновесие. Благодаря этому оксид азота(II) можно получить из простых веществ при температурах электрической дуги (3000—4000 °С).
В промышленности он является промежуточным продуктом при производстве азотной кислоты .
Для оксида азота(II) характерна окислительно-восстановительная двойственность. Под действием сильных окислителей он окисляется, а в присутствии сильных восстановителей — восстанавливается. Например, он легко окисляется кислородом воздуха до диоксида азота:
2NO+О2 =-- 2N02
В то же время смесь равных объемов NO и Н2 при нагревании взрывает:
2 NO+2Н2
= N2 + 2Н20 +655 кДж
NO+2Н2
= N2 + 2Н20 +655 кДж
В молекуле есть один неспаренный электрон.
ОКСИД АЗОТА (IV), ПОЛУЧЕНИЕ, СТРОЕНИЕ, СВОЙСТВА.
Диоксид (или двуокись) азота NO2 — бурый ядовитый газ, обладающий характерным запахом. Он легко сгущается в красноватую жидкость (темп. кип. 21 °С), которая при охлаждении постепенно светлеет и при —11,2°С замерзает, образуя бесцветную кристаллическую массу. При нагревании газообразного диоксида азота его окраска, наоборот, усиливается, а при 140°С становится почти черной. Изменение окраски диоксида азота при повышении температуры сопровождается и изменением его молекулярной массы. При низкой температуре плотность пара приблизительно отвечает удвоенной формуле N2O4 С повышением температуры плотность пара уменьшается и при 140°С соответствует формуле NO2. Бесцветные кристаллы, существующие при — 11,2°С и ниже, состоят из молекул N2O4. По мере нагревания молекулы N2O4 диссоциируют с образованием молекул темно-бурого диоксида азота; полная диссоциация происходит при 140°С. Таким образом, при температурах от —11,2 до 140 °С молекулы NO2 и N2O4 находятся в равновесии друг с другом:
N2O4↔ 2NO2 -56,9 кДж
Выше 140 °С начинается диссоциация NO2 на NO и кислород. Диоксид азота—очень энергичный окислитель. Многие вещества могут гореть в атмосфере NO2, отнимая от него кислород. Диоксид серы окисляется им в триоксид, на чем основан нитрозный метод получения серной кислоты.
Пары NO2 ядовиты. Вдыхание их вызывает сильное раздражение дыхательных путей и может привести к серьезному отравлению.
При растворении в воде NO2 вступает в реакцию с водой, образуя азотную и азотистую кислоты:
2NO2 + Н2O = HNO3 + HNO2
Поэтому диоксид азота можно считать смешанным ангидридом этих кислот.
Но азотистая кислота очень нестойка и быстро разлагается:
3HNO2 = HNO3 + 2NO + Н2O
Поэтому практически взаимодействие диоксида азота с водой, особенно с горячей, идет согласно уравнению: 6NO2 + 2Н2O = 4HNO3 + 2NO, которое можно получить сложением двух предыдущих уравнений, если предварительно первое из них умножить на три.
В присутствии воздуха образующийся оксид азота немедленно окисляется в диоксид азота, так что в этом случае NO2 в конечном итоге полностью переходит в азотную кислоту:
4NO2 + O2 + 2Н20=4HN03
Эта реакция используется в современных способах получения азотной кислоты.
Если растворять диоксид азота в щелочах, то образуется смесь солей азотной и азотистой кислот, например:
2N02 + 2NaOH = NaN03 + NaN02 + H20
В лаборатории NO2 обычно получают воздействием концентрированной азотной кислотой на медь:
![]()
Также его можно получить термическим разложением нитрата свинца, однако при проведении реакции следует соблюдать осторожность:
![]()
ДИМЕРИЗАЦИЯ ОКСИДА АЗОТА (IV).
В обычном состоянии NO2 существует в равновесии со своим димером N2O4. Склонность к его образованию объясняется наличием в молекуле NO2 неспаренного электрона. При температуре 140 °C диоксид азота состоит только из молекул NO2, он очень тёмного, почти чёрного цвета. В точке кипения NO2 представляет собой желтоватую жидкость, содержащую около 0,1 % NO2. При температуре ниже 21°С — это бесцветная жидкость (или желтоватая из-за примеси мономера). При температуре ниже −12 °C белые кристаллы состоят только из молекул N2O4. Молекула имеет линейное строение
Обычно переработку нитрозных газов ведут при 10 – 500С. В этих условиях часть оксида (IV) димеризуется в тетроксид N2O4. Степень димеризации его существенно зависит от температуры. При температуре выше 1500С равновесие реакции 2 почти полностью сдвинуто влево и тетроксид азота в газе практически отсутствует. Даже при – 200С степень димеризации оксида азота (IV) не превышает 92%.
ОКСИД АЗОТА (I), СТРОЕНИЕ, СПОСОБЫ ПОЛУЧЕНИЯ, СВОЙСТВА.
Оксид азота(I), или закись азота, N2O получается при нагревании нитрата аммония:
NH4NO3=N2O↑ + 2Н2O
Оксид азота(I) представляет собою бесцветный газ со слабым запахом и сладковатым вкусом. Он мало растворим в воде: один объем воды при 20 °С растворяет 0,63 объема N2O.
Оксид азота(I)—термодинамически неустойчивое соединение. Стандартная энергия Гиббса его образования положительна(ΔGобр — 104 кДж/моль). Однако вследствие большой прочности связей в молекуле N2O энергии активации реакций, протекающих с участием этого вещества, высоки. В частности, высока энергия активации распада N2O. Поэтому при комнатной температуре оксид азота(I) устойчив. Однако при повышенных температурах он разлагается на азот и кислород; разложение идет тем быстрее, чем выше температура.
Ни с водой, ни с кислотами, ни со щелочью оксид азота(I) не реагирует.
В нормальных условиях N2O химически инертен, при нагревании проявляет свойства окислителя:
![]()
![]()
При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя:
![]()
При нагревании N2O разлагается:
![]()
Электронная структура молекулы N2O: Атом кислорода, имеющий два неспаренных электрона, образует две ковалентные связи с центральным атомом азота. За счет неспаренного электрона, оставшегося у центрального атома азота, последний образует ковалентную связь со вторым атомом азота. Таким образом, внешние электронные слои атома кислорода и центрального атома азота оказываются заполненными: здесь образуются устойчивые восьмиэлектронные конфигурации. Но во внешнем электронном слое крайнего атома азота размещено только шесть электронов; этот атом может, следовательно, быть акцептором еще одной электронной пары. Соседний же с ним центральный атом азота обладает неподеленной электронной парой и может выступать в качестве донора. Это приводит к образованию по донорно-акцепторному способу еще одной ковалентной связи между атомами азота. Теперь каждый из трех атомов, составляющих молекулу N2O, обладает устойчивой восьмиэлектронной структурой внешнего слоя. Таким образом, в оксиде азота (I) ковалентность центрального атома азота равна четырем, а крайнего – двум.
Вдыхание небольших количеств оксида азота (I) приводит к притуплению болевой чувствительности, вследствие чего этот газ иногда применяют в смеси с кислородом для наркоза. Большие количества оксида азота (I) действуют на нервную систему возбуждающе; поэтому раньше его называли «веселящим газом».
Закись азота получают нагреванием сухого нитрата аммония. Разложение начинается при 170 °C и сопровождается выделением тепла. Поэтому, чтобы не дать протекать ему слишком бурно, следует вовремя прекратить нагревание, так как при температурах более 300 °C нитрат аммония разлагается со взрывом:
![]()
Более удобным способом является нагревание сульфаминовой кислоты с 73%-й азотной кислотой:
![]()
В химической промышленности закись азота является побочным продуктом и для её разрушения используют каталитические конвертеры, так как выделение в виде товарного продукта, как правило, экономически нецелесообразно.
АЗОТИСТЫЙ АНГИДРИД, СТРОЕНИЕ, ПОЛУЧЕНИЕ, СВОЙСТВА.
Оксид азота (III), или азотистый ангидрид, N2O3 представляет собой темно-синюю жидкость, уже при низких температурах разлагающуюся на NO и NO2. Смесь равных объемов NO и NO2 при охлаждении вновь образует N2O3: NO+NO2 ↔N2O3
Оксиду азота (III) соответствует азотистая кислота HNO2. Она образуется при растворении азотистого ангидрида в воде.
Чистый N2O3 может быть получен в виде голубой жидкости при низких температурах (–20 С) из эквимолекулярной смеси NO и NO2.
