
- •17.Элементы va группы: азот, фосфор, мышьяк, сурьма, висмут. Общая характеристика элементов.
- •Получение: Получают либо взаимодействием солей с nh3 в водном растворе, либо действием газообразного или жидкого nh3 на твердые соли. Например, аммиачный комплекс меди образуется в результате реакции:
- •Получение: Чистый n2o3 может быть получен в виде голубой жидкости при низких температурах (–20 с) из эквимолекулярной смеси no и no2.
- •Химические свойства:
- •Строение:в газовой фазе планарная молекула азотистой кислоты существует в виде двух конфигураций цис- и транс-. При комнатной температуре преобладает транс-изомер.
- •Получение:
- •Химические свойства:Типичный кислотный оксид. N2o5 легко летуч и крайне неустойчив. Разложение происходит со взрывом, чаще всего — без видимых причин:
- •Строение:
- •Стибин, или гидрид сурьмы, SbH3 — ядовитый газ, образующийся в тех же условиях, что и арсин. При нагревании он еще легче, чем арсин, разлагается на сурьму и водород.
- •Синтез:
- •Физические свойства:
- •Химические свойства:
- •Металлургия
- •Катализаторы
- •Термоэлектрические материалы
- •Детекторы ядерных излучений
- •Легкоплавкие сплавы
- •Измерение магнитных полей
- •Производство полония-210
- •Химические источники тока
- •Обработка прочных металлов и сплавов
- •Ядерная энергетика
- •Магнитные материалы
- •Медицина
- •Пигменты
- •Косметика
17.Элементы va группы: азот, фосфор, мышьяк, сурьма, висмут. Общая характеристика элементов.
Эти элементы, имея пять электронов в наружном слое атома, характеризуются в целом как неметаллы. Однако способность к присоединению электронов выражена у них значительно слабее, чем у соответствующих элементов VI и VII групп. Высшая положительная окисленность элементов этой подгруппы равна +5, а отрицательная —3. Вследствие относительно меньшей электроотрицательности связь рассматриваемых элементов с водородом менее полярна, чем связь с водородом элементов VI и VII групп. Поэтому водородные соединения этих элементов не отщепляют в водном растворе ионы водорода и, таким образом, не обладают кислотными свойствами. С увеличением атомного номера в группе возрастает радиус атома, уменьшается энергия ионизации и электроотрицательность и усиливается металлический характер элемента.N и P-типичные неметаллы. Bi-металл. As и Sb проявляют как неметаллические свойства, так и металлические. Азот при н. у. находится в виде устойчивых двухатомных молекул с тройными связями, а остальные элементы образуют структуры с одинарными связями друг с другом. С увеличением атомного номера возрастает плотность простых веществ, температуры плавления и кипения (за исключением сурьмы).Мышьяк и сурьма токсичны, очень токсичны их соединения.
Физические и химические свойства элементов подгруппы азота изменяются с увеличением порядкового номера в той же последовательности, которая наблюдалась в ранее рассмотренных группах, но так как неметаллические свойства выражены у азота слабее, чем у кислорода и тем более фтора, то ослабление этих свойств при переходе к следующим элементам влечет за собой появление и нарастание металлических свойств. Последние заметны уже у мышьяка, сурьма приблизительно в равной степени обладает теми и другими свойствами, а у висмута металлические свойства преобладают над неметаллическими.
|
АЗОТ |
ФОСФОР |
МЫШЬЯК |
СУРЬМА |
ВИСМУТ |
Строение внешнего электронного слоя атома |
2s22p3 |
3s23p3 |
4s24p3 |
5s25p3 |
6s26p3 |
Энергия ионизации атома, эВ |
14.53 |
10.49 |
9.82 |
8.64 |
7.3 |
Относительная электроотрицательность |
3.07 |
2.2 |
2.1 |
1.8 |
1.7 |
Радиус атома, нм |
0.071 |
0.13 |
0.148 |
0.161 |
0.182 |
Температура плавления, градусы Цельсия |
-210.0 |
44.1* |
** |
630.5 |
271.3 |
Температура кипения, градусы Цельсия |
-195.8 |
257 |
** |
1634 |
1550 |
Плотность, г/см3 |
0.81*** |
1.83* |
5.72**** |
6.68 |
9.80 |
*Белый фосфор.
**Сублимируется при 615 градусах Цельсия.
***Жидкий при – 196 градусов Цельсия.
****Серый мышьяк
СТЕПЕНИ ОКИСЛЕНИЯ.
Благодаря наличию пяти наружных электронов, высшая положительная окисленность элементов этой подгруппы равна +5, а отрицательная —3.
Азот проявляет: -3,-2,-1,0,+1,+2,+3,+4,+5(чаще -3,+5,+3).
Фосфор так же может иметь с.о. от -3 до +5, наиболее характерны -3, +3, +5.
В соединениях мышьяк проявляет с.о. +5,+3,-3.
Для элементов подгруппы мышьяка стабильность отрицательной степени окисления в ряду As – Sb – Bi уменьшается вплоть до того, что для висмута она вообще не известна.
СПЕЦИФИЧЕСКИЕ СВОЙСТВА АЗОТА.
У атома азота на один электрон больше, чем у атома углерода; согласно правилу Хунда, этот электрон занимает последнюю вакантную 2р-орбиталь. Атом азота в невозбужденном состоянии характеризуется тремя вырожденными 2р-электронами при наличии двух спаренных электронов на 2s-орбитали. Три неспаренных электрона на 2р-орбитали, прежде всего, ответственны за трехковалентность азота. Именно поэтому характеристическим летучим водородным соединением является аммиак, в котором атом азота образует три ковалентные связи по обменному механизму с тремя атомами водорода. У азота нет возможности перехода электронов в возбужденное состояние, так как ближайшие орбитали при n = 3 слишком высоки по энергии. Поэтому максимальная валентность азота равна четырем. При этом три ковалентные связи могут быть образованы по обменному механизму, а одна – по донорно-акцепторному. Однако азот в состоянии N+ может образовывать все четыре связи по обменному механизму. Азот проявляет большое разнообразие степеней окисления: -3, -2, -1, 0, +1, +2, +3, +4 и +5. Наиболее часто встречаются производные от степеней окисления -3,+5 и +3 (NH3, HNO3 и NaNO2).В молекуле азота N2 атомы связаны тройной связью. Энергия диссоциации этой молекулы очень велика (945 кДж/моль), поэтому термическая диссоциация азота делается заметной лишь при очень сильном нагревании (при 3000 °С диссоциирует около 0,1 %).Азот — бесцветный газ, не имеющий запаха и весьма мало растворимый в воде. Он немного легче воздуха: масса 1 л азота равна 1,25 г.
Молекулярный азот — химически малоактивное вещество. При комнатной температуре он взаимодействует лишь с литием. Малая активность азота объясняется большой прочностью его молекул, обусловливающей высокую энергию активации реакций, протекающих с участием азота. Однако при нагревании он начинает реагировать со многими металлами — с магнием, кальцием, титаном. С водородом азот вступает во взаимодействие при высоких температуре и давлении в присутствии катализатора. Реакция азота с кислородом начинается при 3000—4000 °С.
Животные, помещенные в атмосферу азота, быстро погибают, но не вследствие ядовитости азота, а из-за отсутствия кислорода»
СТРОЕНИЕ И СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ.
Азот — бесцветный газ, не имеющий запаха и весьма мало растворимый в воде. Он немного легче воздуха: масса 1 л азота равна 1,25 г. В молекуле азота N2 атомы связаны тройной связью. Энергия диссоциации этой молекулы очень велика (945 кДж/моль), поэтому термическая диссоциация азота делается заметной лишь при очень сильном нагревании (при 3000 °С диссоциирует около 0,1 %). Молекулярный азот — химически малоактивное вещество. При комнатной температуре он взаимодействует лишь с литием. Малая активность азота объясняется большой прочностью его молекул, обусловливающей высокую энергию активации реакций, протекающих с участием азота. Однако при нагревании он начинает реагировать со многими металлами — с магнием, кальцием, титаном. С водородом азот вступает во взаимодействие при высоких температуре и давлении в присутствии катализатора. Реакция азота с кислородом начинается при 3000—4000 °С. Азот плохо растворим в воде и органических растворителях. При комнатной температуре азот реагирует лишь с литием. В условиях повышенных температур он взаимодействует с другими активными металлами с образованием нитридов. С галогенами азот непосредственно не соединяется. Химическая активность азота резко повышается в условиях высоких температур (2500-3000°С), тлеющего и искрового электрического разряда и в присутствии катализаторов. При высоких температурах и давлении и в присутствии катализаторов азот непосредственно реагирует с водородом, кислородом и углеродом и др.элементами.
Фосфор образует несколько аллотропических видоизменений.
Белый фосфор получается в твердом состоянии при быстром охлаждении паров фосфора; его плотность 1,83 г/см3.В чистом виде белый фосфор совершенно бесцветен и прозрачен; продажный продукт обычно окрашен в желтоватый цвет и по внешнему виду похож на воск. На холоду белый фосфор хрупок, но при температуре выше 15 °С становится мягким и легко режется ножом.
На воздухе белый фосфор очень быстро окисляется и при этом светится в темноте. Отсюда произошло название «фосфор», которое в переводе с греческого означает «светоносный». Уже при слабом нагревании, для чего достаточно простого трения, фосфор воспламеняется и сгорает, выделяя большое количество теплоты. Фосфор может и самовоспламениться на воздухе вследствие выделения теплоты при окислении. Чтобы защитить белый фосфор от окисления, его сохраняют под водой. В воде белый фосфор нерастворим; хорошо растворяется в сероуглероде.
Белый фосфор имеет молекулярную кристаллическую решетку, в узлах которой находятся тетраэдрические молекулы Р4. Прочность связи между атомами в этих молекулах сравнительно невелика. Это объясняет высокую химическую активность белого фосфора.
Белый фосфор — сильный яд, даже в малых дозах действующий смертельно.
Если белый фосфор долго нагревать без доступа воздуха при 250—300 °С, то он превращается в другое видоизменение фосфора, имеющее красно-фиолетовый цвет и называемое красным фосфором. Такое же превращение происходит, но только очень медленно, под действием света.
Красный фосфор(полимерная структура) по своим свойствам резко отличается от белого: он очень медленно окисляется на воздухе, не светится в темноте, загорается только при 260 °С, не растворяется в сероуглероде и неядовит. Плотность красного фосфора составляет 2,0— 2,4 г/см3. Переменное значение плотности обусловлено тем, что красный фосфор состоит из нескольких форм. Их структура не вполне выяснена, однако известно, что они являются полимерными веществами.
При сильном нагревании красный фосфор, не плавясь, испаряется (сублимируется). При охлаждении паров получается белый фосфор.
Черный фосфор(слоистая структура подобно графиту) образуется из белого при нагревании его до 200—220 °С под очень высоким давлением. По виду он похож на графит, жирен на ощупь и тяжелее других видоизменений; его плотность равна 2,7 г/см3. Черный фосфор — полупроводник.
При горении фосфора образуется густой белый дым; поэтому белым фосфором снаряжают боеприпасы (артиллерийские снаряды, авиабомбы и др.), предназначенные для образования дымовых завес. Большое количество фосфора идет на производство фосфорорганических препаратов, к числу которых относятся весьма эффективные средства уничтожения насекомых-вредителей.
Свободный фосфор чрезвычайно активен. Он непосредственно взаимодействует со многими простыми веществами с выделением большого количества теплоты. Легче всего фосфор соединяется с кислородом, затем с галогенами, серой и со многими металлами, причем в последнем случае образуются фосфиды, аналогичные нитридам, — например Са3Р2, Mg3P2 и др. Все эти свойства особенно резко проявляются у белого фосфора; красный фосфор реагирует менее энергично, черный вообще с трудом вступает в химические взаимодействия.
Подобно фосфору, мышьяк существует в нескольких аллотропических модификациях. Наиболее устойчив при обычных условиях и при нагревании металлический, или серый, мышьяк. Он образует серо-стальную хрупкую кристаллическую массу с металлическим блеском на свежем изломе. Плотность серого мышьяка равна 5,72 г/см3. При нагревании под нормальным давлением он сублимируется. В отличие от других модификаций, серый мышьяк обладает металлической электрической проводимостью.
В воде мышьяк нерастворим. На воздухе при комнатной температуре он окисляется очень медленно, а при сильном нагревании сгорает, образуя белый оксид As203 и распространяя характерный чесночный запах. При высокой температуре мышьяк непосредственно взаимодействует со многими элементами. Сильные окислители переводят его в мышьяковую кислоту
В свободном состоянии сурьма образует серебристо-белые кристаллы, обладающие металлическим блеском и имеющие плотность 6,68 г/см3. Напоминая по внешнему виду металл, кристаллическая сурьма отличается хрупкостью и значительно хуже проводит теплоту и электрический ток, чем обычные металлы. Кроме кристаллической сурьмы, известны и другие ее аллотропические видоизменения. В своих соединениях сурьма обнаруживает большое сходство с мышьяком, но отличается от него более сильно выраженными металлическими свойствами. Сурьма образует соединения с металлами — антимониды, — которые можно рассматривать как продукты замещения водорода в стибине атомами металла.
В свободном состоянии висмут представляет собой блестящий розовато-белый хрупкий металл плотностью 9,8 г/см3. Его применяют как в чистом виде, так и в сплавах. Чистый висмут используют главным образом в энергетических ядерных реакторах в качестве теплоносителя. С некоторыми металлами висмут образует легкоплавкие сплавы; например, сплав висмута со свинцом, оловом и кадмием плавится при 70 °С. Эти сплавы применяют, в частности, в автоматических огнетушителях, действие которых основано на расплавлении пробки, изготовленной из такого сплава. Кроме того, они используются как припои. На воздухе висмут при комнатной температуре не окисляется, но при сильном нагревании сгорает, образуя оксид висмута Bi2O3. Соляная и разбавленная серная кислоты на висмут не действуют. Он растворяется в азотной кислоте невысокой концентрации и в горячей концентрированной серной.
ОСНОВНЫЕ ПРИРОДНЫЕ СОЕДИНЕНИЯ, ПРИНЦИПЫ ПОЛУЧЕНИЯ ИЗ НИХ ПРОСТЫХ ВЕЩЕСТВ.
АЗОТ: Большая часть азота находится в природе в свободном состоянии. Свободный азот является главной составной частью воздуха, который содержит 78,2 % (об.) азота. Неорганические соединения азота не встречаются в природе в больших количествах, если не считать натриевую селитру NaNO3(чилийская селитра), образующую мощные пласты на побережье Тихого океана в Чили. Почва содержит незначительные количества азота, преимущественно в виде солей азотной кислоты. Но в виде сложных органических соединений — белков — азот входит в состав всех живых организмов. Превращения, которым подвергаются белки в клетках растений и животных, составляют основу всех жизненных процессов. Без белка нет жизни, а так как азот является обязательной составной частью белка, то понятно, какую важную роль играет этот элемент в живой природе. Общее содержание азота в земной коре (включая гидросферу и атмосферу) составляет 0,04 % (масс).
Получение азота из воздуха сводится в основном к отделению его от кислорода. В промышленности это осуществляется путем испарения жидкого воздуха в специальных установках.(Фракционная перегонка жидкого воздуха)
В лабораториях обычно пользуются азотом, поставляемым в баллонах под повышенным давлением или в сосудах Дьюара, Можно получать азот разложением некоторых его соединений, например нитрита аммония NH4NO2
NH4NO2 = N2↑ + 2Н2O
В лаборатории азот получают также нагреванием смеси крепких растворов хлорида аммония и нитрита натрия. Сначала термически неустойчивый нитрит аммония, который разлагается: NH4Cl+NaNO2=(t-нагревание)=N2+2H2O+NaCl
Азот также можно получить окислением аммиака, например бромом:
2NH3+3Br2=6HBr+N2
Наиболее чистый азот получается при термическом разложении
2NaN3=2Na+3N2
ФОСФОР: Из природных соединений фосфора самым важным является ортофосфат кальция Ca3(PO4)2, который в виде минерала фосфорита иногда образует большие залежи. В СССР богатейшие месторождения фосфоритов находятся в Южном Казахстане в горах Каратау. Часто встречается также минерал апатит, содержащий, кроме Са3(Р04)2, еще CaF2 или СаС12. Огромные залежи апатита были открыты в двадцатых годах нашего столетия на Кольском полуострове. Это месторождение по своим запасам самое большое в мире. Фосфор, как и азот, необходим для всех живых существ, так как он входит в состав некоторых белков как растительного, так и животного происхождения. В растениях фосфор содержится главным образом в белках семян, в животных организмах — в белках молока, крови, мозговой и нервной тканей. Кроме того, большое количество фосфора содержится в костях позвоночных животных в основном в виде соединений
ЗСа3(РO4)2∙ Са (ОН)2 и ЗСа3(РO4)2∙СаСO3-Н2O.
В виде кислотного остатка фосфорной кислоты фосфор входит в состав нуклеиновых кислот — сложных органических полимерных соединений, содержащихся во всех живых организмах. Эти кислоты принимают непосредственное участие в процессах передачи наследственных свойств живой клетки.
Сырьем для получения фосфора и его соединений служат фосфориты и апатиты. Природный фосфорит или апатит измельчают, смешивают с песком и углем и накаливают в печах с помощью электрического тока без доступа воздуха.
Чтобы понять происходящую реакцию, представим фосфат кальция как соединение оксида кальция с фосфорным ангидридом (ЗСаО∙Р205); песок же состоит в основном из диоксида кремния Si02. При высокой температуре диоксид кремния вытесняет
фосфорный ангидрид и, соединяясь с оксидом кальция, образует легкоплавкий силикат кальция CaSi03, а фосфорный ангидрид восстанавливается углем до свободного фосфора:
Са3(Р04)2 + 3SiO2 = 3CaSi03 + P2O5
Р2O5 + 5С = 2Р + 5СО
Складывая оба уравнения, получаем:
Са3(РO4)2 + 3SiO2 + 5С = 3CaSiO3 + 2Р + 5СО
Фосфор выделяется в виде паров, которые конденсируются в приемнике под водой.
МЫШЬЯК: Мышьяк встречается в природе большей частью в соединениях с металлами или серой и лишь изредка в свободном состоянии. Содержание мышьяка в земной коре составляет 0,0005 % (масс).
Обычно мышьяк получают из мышьяковистого колчедана FeAsS. При его нагревании в атмосфере воздуха образуется оксид мышьяка (III) As2O3, который далее восстанавливают углем до свободного мышьяка.
СУРЬМА: Сурьма обычно встречается в природе в соединении с серой — в виде сурьмяного блеска, или антимонита, Sb2S3. Несмотря на то, что содержание сурьмы в земной коре сравнительно невелико [0,00005 % (масс.)], сурьма была известна еще в глубокой древности. Это объясняется распространенностью в природе сурьмяного блеска и легкостью получения из него сурьмы. При прокаливании на воздухе сурьмяный блеск превращается в оксид сурьмы Sb2O3, из которого сурьма получается путем восстановления углем.
ВИСМУТ: Висмут — мало распространенный в природе элемент: содержание его в земной коре составляет 0,00002 % (масс). В природе он встречается как в свободном состоянии, так и в виде соединений —висмутовой охры Bi2O3 и висмутового блеска Bi2S3.
Мышьяк, сурьму и висмут в свободном состоянии получают обычно путем карбо- или металлотермического восстановления оксидов. Сульфидные минералы при этом предварительно подвергают окислительному обжигу. Поскольку мышьяк и его аналоги обычно ассоциированы со многими металлами, в процессе восстановления образуются интерметаллические сплавы (твердые растворы, эвтектические смеси, соединения). Для разделения компонентов сплавов в последнее время широко используется хлорная металлургия. Восстановленный продукт подвергают хлорированию. Летучие хлориды мышьяка, сурьмы и висмута отгоняют, подвергают дистилляции, а затем восстанавливают, например, водородом, цинком и т.п. Окончательная очистка мышьяка достигается вакуумной пересублимацией, чему способствует сравнительно высокая летучесть мышьяка.
Сурьму и висмут подвергают окончательной глубокой очистке методами направленной кристаллизации или зонной плавки. Такие методы очистки позволяют получить мышьяк, сурьму и висмут с суммарным содержанием примесей, не превосходящим 10-4-10-6 мас.долей,%.
РОЛЬ СОЕДИНЕНИЙ АЗОТА И ФОСФОРА В ЭКОЛОГИИ И В БИОЛОГИЧЕСКИХ ПРОЦЕССАХ.
АЗОТ: Свободный азот является главной составной частью воздуха, который содержит 78,2 % (об.) азота. Животные, помещенные в атмосферу азота, быстро погибают, но не вследствие ядовитости азота, а из-за отсутствия кислорода. В виде сложных органических соединений — белков — азот входит в состав всех живых организмов. Превращения, которым подвергаются белки в клетках растений и животных, составляют основу всех жизненных процессов. Азот является обязательной составной частью белка, то понятно, какую важную роль играет этот элемент в живой природе. Синтез белка идет с использованием нитратов и аммонийных соединений почвы, которые образуются из атмосферного азота. Образований азотосодержащих соединений из азота атмосферы называется связыванием азота, которое в природе может осуществляться двумя путями: а)образованием оксидов азота при разряде молний; б)превращением азота в аммиак, а затем в нитраты под действием бактерий почвы и корней некоторых растений(клевера, бобовых и др.). После смерти растений и животных азот белков снова превращается в аммонийные соединения. Так возникает кругооборот азота. Нитраты и соединения аммония попадают в почву также в виде удобрений, которые получают из аммиака, синтезируемому по методу Габера:
N2+3H2=2NH3
Реакция протекает при 450-500°С и давлении 30 МПа на железном катализаторе с промоторами (вещество, применяемое в небольших количествах вместе с катализатором для увеличения активности КАТАЛИЗАТОРА) K2O и Al2O3. Основная часть производимого азота расходуется на получение аммиака.
ФОСФОР: Из природных соединений фосфора самым важным является ортофосфат кальция Ca3(P04)2, который в виде минерала фосфорита иногда образует большие залежи. Часто встречается также минерал апатит, содержащий, кроме Са3(Р04)2, еще CaF2 или СаСl2. Фосфор, как и азот, необходим для всех живых существ, так как он входит в состав некоторых белков как растительного, так и животного происхождения. В растениях фосфор содержится главным образом в белках семян, в животных организмах — в белках молока, крови, мозговой и нервной тканей. Кроме того, большое количество фосфора содержится в костях позвоночных животных в основном в виде соединений ЗСа3(Р04)2∙Са (ОН)2 и ЗСа3(Р04)2∙СаС03∙Н20. В виде кислотного остатка фосфорной кислоты фосфор входит в состав нуклеиновых кислот — сложных органических полимерных соединений, содержащихся во всех живых организмах. Эти кислоты принимают непосредственное участие в процессах передачи наследственных свойств живой клетки.
АЗОТ.
Азот — бесцветный газ, не имеющий запаха и весьма мало растворимый в воде. Он немного легче воздуха: масса 1 л азота равна 1,25 г. В молекуле азота N2 атомы связаны тройной связью.
СОВРЕМЕННЫЕ МЕТОДЫ РЕШЕНИЯ ПРОБЛЕМЫ СВЯЗЫВАНИЯ АТМОСФЕРНОГО АЗОТА.
Под действием электрических разрядов в атмосфере азот связывается в оксиды, при растворении которых в воде образуются в конечном счете нитраты. В этом виде азот усваивается растениями и опосредствованно – живыми организмами, в которых он является составной частью белка. При разложении органических остатков азот в молекулярной форме вновь попадает в атмосферу. Таким образом, круговорот азота в природе приводит к накоплению его в свободном состоянии. Молекула N2 является самой устойчивой формой его существования, чем обусловлена так называемая проблема связанного азота. Потребление связанного азота растениями и животными приводит к обеднению окружающей среды соединениями азота. Этот дефицит должен восполняться искусственным путем, поскольку естественное пополнение запасов связанного азота (грозы, деятельность азотобактерий и т.п.) не компенсирует его потери. Исключительное значение в решении проблемы связанного азота имеют две реакции: синтез аммиака и его каталитическое окисление.
АММИАК, ЕГО СТРОЕНИЕ, СПОСОБЫ ПОЛУЧЕНИЯ И СВОЙСТВА.
Азот образует несколько соединений с водородом.В лаборатории аммиак обычно получают, нагревая хлорид аммония NH4C1 с гашеной известью Са(ОН)2. Реакция выражается уравнением
2NH4C1 + Са(ОН)2 = СаС12 + 2Н2O + 2NH3↑
Выделяющийся аммиак содержит пары воды. Для осушения его пропускают через натронную известь (смесь извести с едким натром).
Поскольку этот газ значительно легче воздуха, то его можно собирать в перевернутые вверх дном сосуды.
Аммиак очень хорошо растворим в воде. В химическом отношении аммиак довольно активен; он вступает во взаимодействие со многими веществами. В аммиаке азот имеет самую низкую степень окисленности (—3). Поэтому аммиак обладает только восстановительными свойствами. Если пропускать ток NH3 по трубке, вставленной в другую широкую трубку (рис. 114), по которой проходит кислород, то аммиак можно легко зажечь; он горит бледным зеленоватым пламенем. При горении аммиака образуется вода и свободный азот:
4NH3 + 3O2 = 6Н2O + 2N2
При других условиях аммиак может окисляться до оксида азота NO (см. § 143).
В отличие от водородных соединений неметаллов VI и VII групп, аммиак не обладает кислотными свойствами. Однако атомы водорода в его молекуле могут замещаться атомами металлов. При полном замещении водорода металлом образуются соединения, называемые нитридами. Некоторые из них, например нитриды кальция и магния, получаются при непосредственном взаимодействии азота с металлами при высокой температуре;
3Mg + N2 = Mg3N2
При замещении в молекулах аммиака только одного атома водорода металлами образуются амиды металлов. Так, пропуская аммиак над расплавленным натрием, можно получить амид натрия NaNH2 в виде бесцветных кристаллов:
2NH3 + 2Na = 2NaNH2 + Н2 Вода разлагает амид натрия;
NaNH2 + Н2O = NaOH + NH3↑
Обладая сильными основными и водоотнимающими свойствами, амид натрия нашел применение при некоторых органических синтезах, например, в производстве красителя индиго и некоторых лекарственных препаратов.
Водород в аммиаке может замещаться также галогенами. Так, при действии хлора на концентрированный раствор хлорида аммония получается нитрид хлора, или хлористый азот, NC13 в виде тяжелой маслянистой взрывчатой жидкости.
Подобными же свойствами обладает нитрид иода (йодистый азот), образующийся в виде черного, нерастворимого в воде порошка при действии иода на аммиак. Во влажном состоянии он безопасен, но высушенный взрывается от малейшего прикосновения; при этом выделяются пары иода фиолетового цвета.
С фтором азот образует устойчивый фторид азота NF3.
Электроотрицательность хлора и иода меньше, а фтора больше, чем электроотрицательность азота. Отсюда следует, что в соединениях NCl3 и NI3 степень окисленности азота равна —3, а в NF3 она равна +3. Поэтому фторид азота отличается по свойствам от нитридов хлора и иода. Например, при взаимодействии с водою NCl3 или NI3 образуется аммиак, а в случае HF3 получается оксид азота (Ш);
NCl3 + ЗН20 = NH3 + ЗНОСl
2NF3 + 3H20 = N2O3 + 6HF
Атом азота в молекуле аммиака связан тремя ковалентными связями с атомами водорода и сохраняет при этом одну неподеленную электронную пару:
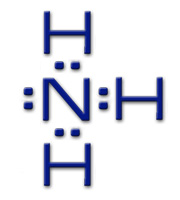
Выступая в качестве донора электронной пары, атом азота может участвовать в образовании по донорно-акцепторному способу четвертой ковалентной связи с другими атомами или ионами, обладающими электроноакцепторными свойствами. Этим объясняется чрезвычайно характерная для аммиака способность вступать в реакции присоединения.
Взаимодействие молекулы NH3 с ионом водорода, приводящее к образованию иона аммония NH4+:
NH3 + H+ = NH4+
В этой реакции аммиак служит акцептором протона и, следовательно, с точки зрения протонной теории кислот и оснований проявляет свойства основания. Действительно, реагируя с кислотами, находящимися в свободном состоянии или в растворе, аммиак нейтрализует их, образуя соли аммония. Например, с соляной кислотой получается хлорид аммония NH4CI:
NH3 + НCl= NH4Cl
Аммиак — слабое основание. В 1 л одномолярного водного раствора аммиака содержится всего лишь 0,0042 эквивалента ионов ОН- и NH4+; такой раствор при 18°С имеет рН 11,77.
СВОЙСТВА И ПРИМЕНЕНИЕ ЖИДКОГО АММИАКА.
При охлаждении до —33,4°С аммиак под обычным давлением превращается в прозрачную жидкость, затвердевающую при —77,8 °С. В жидком аммиаке молекулы NH3 (μ= 1,48 D) связаны между собой водородными связями(из-за полярности связи N-H в жидком и твердом аммиаке между молекулами действуют водородные связи), что обусловливает сравнительно высокую температуру кипения аммиака (—33,4°С), не соответствующую его малой молекулярной массе (17), значительную теплоту испарения и большую величину диэлектрической постоянной (ε=22). Жидкий аммиак, хотя и в незначительной степени, диссоциирует на ионы (автопротолиз), в чём проявляется его сходство с водой:
![]()
Константа самоионизации жидкого аммиака при −50 °C составляет примерно 10−33 (моль/л)².
Жидкий аммиак, благодаря полярности молекул и достаточно высокой диэлектрической проницаемости, является хорошим неводным растворителем. В жидком аммиаке хорошо растворяются щелочи и щелочноземельные металлы, сера, фосфор, иод, многие соли и кислоты. Разбавленные растворы металлов в жидком аммиаке окрашены в синий цвет, концентрированные растворы имеют металлический блеск и похожи на бронзу. При испарении аммиака щелочные металлы выделяются в чистом виде, а щелочноземельные — в виде комплексов с аммиаком [Э(NH3)6] обладающих металлической проводимостью. При слабом нагревании эти комплексы разлагаются на металл и NH3.
Растворенный в NH3 металл постепенно реагирует с образованием амида:
![]()
Жидкий аммиак используют в качестве растворителя. В холодильной технике используется в качестве холодильного агента (R717). Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство достигает 150 млн. тонн. В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. В медицине 10 % раствор аммиака, чаще называемый нашатырным спиртом, применяется при обморочных состояниях (для возбуждения дыхания), для стимуляции рвоты, а также наружно — невралгии, миозиты, укусах насекомых, для обработки рук хирурга. При неправильном применении может вызвать ожоги пищевода и желудка (в случае приёма неразведённого раствора), рефлекторную остановку дыхания (при вдыхании в высокой концентрации).
ВОДНЫЙ РАСТВОР АММИАКА.
Аммиак очень хорошо растворим в воде: 1 объем воды растворяет при комнатной температуре около 700 объемов аммиака. Концентрированный раствор содержит 25 % (масс.) NH3 и имеет плотность 0,91 г/см3. Раствор аммиака в воде иногда называют нашатырным спиртом. Обычный медицинский нашатырный спирт содержит 10 % NH3. С повышением температуры растворимость аммиака уменьшается, поэтому он выделяется при нагревании из концентрированного раствора, чем иногда пользуются в лабораториях для получения небольших количеств газообразного аммиака.
При низкой температуре из раствора аммиака может быть выделен кристаллогидрат NH3∙H20, плавящийся при — 79 °С. Известен также кристаллогидрат состава 2NH3∙H20. В этих гидратах молекулы воды и аммиака соединены между собой водородными связями.
Взаимодействие аммиака с водой тоже приводит к образованию не только гидратов аммиака, но частично и иона аммония:
NH3 + Н2О ↔ NH4++ ОН-
В результате концентрация ионов ОН- в растворе возрастает. Именно поэтому водные растворы аммиака обладают щелочной реакцией. Однако по установившейся традиции водный раствор аммиака обычно обозначают формулой NH4OH и называют гидроксидом аммония, а щелочную реакцию этого раствора рассматривают как результат диссоциации молекул NH4OH.
СОЛИ АММОНИЯ, ИХ ПОЛУЧЕНИЕ, ГИДРОЛИЗ, ТЕРМИЧЕСКАЯ УСТОЙЧИВОСТЬ.
Большинство солей аммония бесцветны и хорошо растворимы в воде. По некоторым своим свойствам они подобны солям щелочных металлов, особенно калия (ионы К+ и NH4+ имеют близкие размеры). Соли аммония получают в ходе реакции нейтрализации, которая осуществляется в процессе взаимодействия аммиака с кислотами. Равновесие в водном растворе аммиака можно сместить вправо добавлением кислоты. При этом в растворе образуются соли аммония. Они получаются также при непосредственном взаимодействии газообразных веществ, например:
NH3+HCl=NH4Cl
Поскольку водный раствор аммиака представляет собой слабое основание, то соли аммония в растворах гидролизуются. Растворы солей, образованных аммиаком и сильными кислотами, имеют слабокислую реакцию.Гидролиз иона аммония обычно записывают в такой форме:
NH4+ + H2O =NH4OH + H+
Однако правильнее рассматривать его как обратимый переход протона от иона аммония к молекуле воды:
NH4+ +H2O=NH3+H3O+
При добавлении щелочи к водному раствору какой-либо соли аммония ионы Н3O+ связываются ионами ОН- в молекулы воды и равновесие гидролиза смещается вправо. NH4+ + OH-= NH3 + H2O.
При нагревании раствора аммиак улетучивается. Таким образом, присутствие любой аммонийной соли в растворе можно обнаружить, нагревая раствор со щелочью (реакция на ион аммония).
Соли аммония термически неустойчивы. При нагревании они разлагаются. Это разложение может происходить обратимо или необратимо. Соли аммония, анион которых не является окислителем или лишь в слабой степени проявляет окислительные свойства, распадаются обратимо. Например, при нагревании хлорид аммония как бы возгоняется — разлагается на аммиак и хлороводород, которые на холодных частях сосуда вновь соединяются в хлорид аммония:
NH4C1 ↔NH3+ НСl
При обратимом распаде солей аммония, образованных нелетучими кислотами, улетучивается только аммиак. Однако продукты разложения — аммиак и кислота, — будучи смешаны, вновь соединяются друг с другом. Примерами могут служить реакции распада сульфата аммония (NH4)2SO4 или фосфата аммония (NH4)3PO4.
Соли аммония, анион которых проявляет более резко выраженные окислительные свойства, распадаются необратимо: протекает окислительно-восстановительная реакция, в ходе которой ион аммония окисляется, а анион восстанавливается. Примерами могут служить распад NH4NO2 или разложение нитрата аммония:
NH4NO3 = N2O↑ + 2Н2O
НИТРИДЫ, АМИДЫ, АММИАКАТЫ.
Нитриды: В отличие от водородных соединений неметаллов VI и VII групп, аммиак не обладает кислотными свойствами. Однако атомы водорода в его молекуле могут замещаться атомами металлов. При полном замещении водорода металлом образуются соединения, называемые нитридами. Некоторые из них, например нитриды кальция и магния, получаются при непосредственном взаимодействии азота с металлами при высокой температуре:
3Mg + N2= Mg3N2
При соприкосновении с водой многие нитриды полностью гидролизуются с образованием аммиака и гидроксида металла. Например:
Mg3N2 + 6Н2O = 3Mg (ОН)2 + 2NH3↑
Водород в аммиаке может замещаться также галогенами. Так, при действии хлора на концентрированный раствор хлорида аммония получается нитрид хлора, или хлористый азот, NCl3
NH4CI + ЗСl2 = NCl3 + 4НС1
в виде тяжелой маслянистой взрывчатой жидкости.
Подобными же свойствами обладает нитрид иода (йодистый азот), образующийся в виде черного, нерастворимого в воде порошка при действии иода на аммиак. Во влажном состоянии он безопасен, но высушенный взрывается от малейшего прикосновения; при этом выделяются пары иода фиолетового цвета.
С фтором азот образует устойчивый фторид азота NF3.
Электроотрицательность хлора и иода меньше, а фтора больше, чем электроотрицательность азота. Отсюда следует, что в соединениях NCl3 и NI3 степень окисленности азота равна —3, а в NF3 она равна +3. Поэтому фторид азота отличается по свойствам от нитридов хлора и иода. Например, при взаимодействии с водою NCl3 или NI3 образуется аммиак, а в случае NF3 получается оксид азота (Ш);
NCl3 + ЗН2O = NH3 + ЗНОСl
2NF3 + 3H2O = N2O3 + 6HF
Амиды: При замещении в молекулах аммиака только одного атома водорода металлами образуются амиды металлов. Так, пропуская аммиак над расплавленным натрием, можно получить амид натрия NaNH2 в виде бесцветных кристаллов:
2NH3 + 2Na = 2NaNH2 + Н2
Вода разлагает амид натрия:
NaNH2 + Н2O = NaOH + NH3↑
Обладая сильными основными и водоотнимающими свойствами, амид натрия нашел применение при некоторых органических синтезах, например, в производстве красителя индиго и некоторых лекарственных препаратов.
Аммиакаты: Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например: [Cu(NH3)4]SO4, [Co(NH3)6] Cl3, [Pt(NH3)6] Cl4. Известны комплексы, аналогичные аммиакатам, в которых роль лиганда выполняют молекулы аминов: CH3NH2 (метиламин), C2H5NH2 (этиламин), NH2CH2CH2NH2 (этилендиамин, условно обозначаемый En) и др. Такие комплексы называют аминатами.
