
- •2.Аминокислоты, строение, классификация. Биологическая роль аминокислот.
- •3. Белки, свойства белков (денатурация, нативность, изоэлектрическая точка белка, белки-коллоиды) Доменная структура белков. Белки-шапероны
- •4. Первичная, вторичная структура белков……
- •5. Третичная, четвертичная структура белков
- •6. Азотистый баланс. Полноценные и неполноценные белки. Биол ценность белков
- •7. Матричный биосинтез белков. Репликация.
- •8. Матричный биосинтез белков. Трансляция.
- •9. Матричный биосинтез белков. Транскрипция.
- •13. Вторичная структура днк. Типы а,в,z. Принципы комплементарности правило Чаргаффа.
- •14. Патологии обмена пуриновых оснований
- •10. Сложные белки. Классификация. Геиопротеины. Строение гема.
- •11. Нуклеиновые кислоты. Строение и биологическая роль.
- •24. Синтез холестерина до мевалоновой кислоты
- •24. Холестерин. Биологическое значение для организма. Атеросклероз
- •30. Липопротеины. Строение классификация биол роль
- •31.Биосинтез триглицеридов о фосфолипидов
- •36. Превращение аминокислот в толстом кишечнике
- •37. Всасывание продуктов распада белков. Судьба всосавшихся.
- •34. Механизм действия ферментов. Изоферменты, мультиферментные системы.
- •35. Переваривание белков в жкт
- •42. Патологии азотистого обмена
- •32. Ферменты…классификация и номенклатура
- •29. Желчные кислоты
- •31. Механизм действия гормонов.
- •50. Гормоны мозгового слоя надпочечников
- •51. Гормоны коркового слоя надпочечников
- •52. Инсулин…глюкагон..
- •53. Сахарный диабет
- •54. Гормоны щитовидной железы
- •55. Гормоны паращитовидной железы
- •16.Витамины, классиф, биол роль…гипо…гипер…
- •23. Липиды и лиоиды….Классификация…
- •22. Тканевое дыхание
- •18. Гликоген….Синтез гликогена
- •16. Витамины – коферменты
- •45. Клеточные мембраны
- •38.Дезаминирование. Биол значение примеры.
14. Патологии обмена пуриновых оснований
Пуриновый обмен — совокупность процессов синтеза и распада пуриновых нуклеотидов. Пуриновые нуклеотиды состоят из остатка азотистого пуринового основания, углевода рибозы (дезоксирибозы), связанного b-гликозидной связью с атомом азота пуринового основания, и одного или нескольких остатков фосфорной кислоты, присоединенных эфирной связью к атому углерода углеводного компонента.При каких заболеваниях возникает нарушение пуринового обмена:
|
|
|
|
К наиболее важным нарушениям пуринового обмена относятся избыточное образование и накопление мочевой кислоты, например при подагре и синдроме Леша — Найхана. В основе последнего лежит наследственная недостаточность фермента гипоксантинфосфатидилтрансферазы, вследствие чего свободные пурины не используются повторно, а окисляются в мочевую кислоту. У детей с синдромом Леши — Найхана отмечаются воспалительные и дистрофические изменения. обусловленные отложением в тканях кристаллов мочевой кислоты: заболевание характеризуется задержкой умственного и физического развития. Нарушение пуринового обмена сопровождается и нарушением жирового (липидного) обмена. Поэтому у многих больных увеличивается масса тела, прогрессирует атеросклероз аорты и коронарных артерий, развивается ишемическая болезнь сердца, стойко повышается артериальное давление. Подагре нередко сопутствуют сахарный диабет, желчнокаменная болезнь, значительные изменения происходят и в почках. Приступы подагры провоцирует прием алкоголя, переохлаждение, физическое и психическое перенапряжение, начинаются обычно ночью сильнейшей болью. |
|
|
|
|


10. Сложные белки. Классификация. Геиопротеины. Строение гема.
Сложные белки – это двухкомпонентные белки, которые состоят из какого-либо простого белка и небелкового компонента, называемого про-стетической группой. При гидролизе сложных белков, помимо свободных аминокислот, освобождается небелковая часть или продукты ее распада. ХРОМОПРОТЕИНЫ Хромопротеины (от греч. chroma – краска) состоят из простого белка и связанного с ним окрашенного небелкового компонента. Различают гемопротеины (содержат в качестве простетической группы железо), маг-нийпорфирины и флавопротеины (содержат производные изоаллоксазина). Хромопротеины наделены рядом уникальных биологических функций: они участвуют в таких фундаментальных процессах жизнедеятельности, как фотосинтез, дыхание клеток и целостного организма, транспорт кислорода идиоксида углерода, окислительно-восстановительные реакции, свето-и цветовосприятие и др. Таким образом, хромопротеины играют исключительно важную роль в процессах жизнедеятельности. Например, подавление дыхательной функции гемоглобина путем введения оксида углерода (СО) либо утилизации (потребление) кислорода в тканях путем введения синильной кислоты или ее солей (цианидов), ингибирующих ферментные системы клеточного дыхания, моментально приводит к смерти организма. Хромопротеины являются непременными и активными участниками аккумулирования энергии, начиная от фиксации солнечной энергии в зеленых растениях и утилизации ее до превращений в организме животных и человека. Хлорофилл (магнийпорфирин) вместе с белком обеспечивает фотосинтетическую активностьрастений, катализируя расщепление молекулы воды на водород и кислород (поглощением солнечной энергии). Гемопротеины (железопорфирины), напротив, катализируют обратную реакцию – образованиемолекулы воды, связанное с освобождением энергии. К группе гемопротеинов относятся гемоглобин и его производные, миогло-бин, хлорофиллсодержащие белкии ферменты (вся цитохромная система, каталаза и пероксидаза). Все они содержат в качестве небелкового компонента структурно сходные железо- (или магний)порфирины, но различные по составу и структуребелки, обеспечивая тем самым разнообразие их биологических функций. Далее более подробно рассмотрено химическое строение гемоглобина, наиболее важного для жизнедеятельности человека и животных соединения.Гемоглобин в качестве белкового компонента содержит глобин, а небелкового – гем. Видовые различиягемоглобина обусловлены глобином, в то время как гем одинаков у всех видов гемоглобина.Основу структуры простетической группы большинства гемосодержа-щих белков составляет порфириновое кольцо, являющееся в свою очередь производным тетрапиррольного соединения – порфирина. Последний состоит из четырех замещенных пирролов:
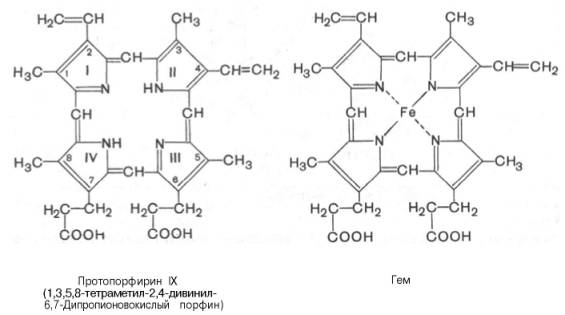 соединенных
между собой метиновыми мостиками
(—СН=). Незамещенный порфирин называется
порфином. В молекуле гема порфин
представлен в виде протопорфирина IX,
содержащего четыре метильные группы
(—СН3),
две винильные группы (—СН=СН2)
и два остатка пропионовой кислоты.
Протопорфирин, присоединяя железо,
превращается в гем.
Из формулы видно, что железо связано
с двумя атомами азота молекулы протопорфирина
ковалентно и с двумя другими
– координационными
связями,
обозначенными пунктирными линиями. В
зависимости от химической природы
групп, находящихся в боковой
цепи, порфирины классифицируют
на этио-, мезо-, копро- и протопорфирины.
Последние наиболее распространены в
природе. Из возможных 15 изомеров про-топорфиринов
благодаря наличию трех разных заместителей
самым распространенным оказался
протопорфирин IX. Гем в
виде гем-порфирина является простетической
группой не только гемоглобина и
его производных, но имиоглобина,
каталазы, пероксидазы и цитохромов b,
с и c1 (см.
главу 9); в то же время в цитохромах а
и a3,
входящих в состав интегрального
комплекса, названного цитохромокси-дазой,
содержится гем а,
называемый также формилпорфирином.
Атом железа расположен
в центре гема-пигмента,
придающего крови характерный
красный цвет. Каждая из 4 молекул гема «обернута»
одной полипептидной цепью.
В молекуле гемоглобина взрослого
человека HbА (от англ. adult – взрослый)
содержатся четыре полипептидные цепи,
которые вместе составляют белковую
часть молекулы – глобин.
Две из них, называемые α-цепями, имеют
одинаковую первичную структуру и по
141 аминокислотному остатку. Две другие,
обозначаемые β-цепями, также идентично
построены и содержат по 146 аминокислотных
остатков. Таким образом, вся молекула белковой
части гемоглобина состоит
из 574 аминокислот.
Во многих положениях α- и β-цепи содержат
разныеаминокислотные
последовательности,
хотя и имеют почти одинаковые
пространственные структуры. Получены
доказательства, что в структурегемоглобинов более
20 видов животных 9 аминокислот в
последовательности оказались одинаковыми,
консервативными (инвариантными),
определяющими функции гемоглобинов;
некоторые из них находятся вблизи гема,
в составе участка связывания с кислородом,
другие – в составе неполярной внутренней
структуры глобулы.
соединенных
между собой метиновыми мостиками
(—СН=). Незамещенный порфирин называется
порфином. В молекуле гема порфин
представлен в виде протопорфирина IX,
содержащего четыре метильные группы
(—СН3),
две винильные группы (—СН=СН2)
и два остатка пропионовой кислоты.
Протопорфирин, присоединяя железо,
превращается в гем.
Из формулы видно, что железо связано
с двумя атомами азота молекулы протопорфирина
ковалентно и с двумя другими
– координационными
связями,
обозначенными пунктирными линиями. В
зависимости от химической природы
групп, находящихся в боковой
цепи, порфирины классифицируют
на этио-, мезо-, копро- и протопорфирины.
Последние наиболее распространены в
природе. Из возможных 15 изомеров про-топорфиринов
благодаря наличию трех разных заместителей
самым распространенным оказался
протопорфирин IX. Гем в
виде гем-порфирина является простетической
группой не только гемоглобина и
его производных, но имиоглобина,
каталазы, пероксидазы и цитохромов b,
с и c1 (см.
главу 9); в то же время в цитохромах а
и a3,
входящих в состав интегрального
комплекса, названного цитохромокси-дазой,
содержится гем а,
называемый также формилпорфирином.
Атом железа расположен
в центре гема-пигмента,
придающего крови характерный
красный цвет. Каждая из 4 молекул гема «обернута»
одной полипептидной цепью.
В молекуле гемоглобина взрослого
человека HbА (от англ. adult – взрослый)
содержатся четыре полипептидные цепи,
которые вместе составляют белковую
часть молекулы – глобин.
Две из них, называемые α-цепями, имеют
одинаковую первичную структуру и по
141 аминокислотному остатку. Две другие,
обозначаемые β-цепями, также идентично
построены и содержат по 146 аминокислотных
остатков. Таким образом, вся молекула белковой
части гемоглобина состоит
из 574 аминокислот.
Во многих положениях α- и β-цепи содержат
разныеаминокислотные
последовательности,
хотя и имеют почти одинаковые
пространственные структуры. Получены
доказательства, что в структурегемоглобинов более
20 видов животных 9 аминокислот в
последовательности оказались одинаковыми,
консервативными (инвариантными),
определяющими функции гемоглобинов;
некоторые из них находятся вблизи гема,
в составе участка связывания с кислородом,
другие – в составе неполярной внутренней
структуры глобулы.
