
- •2.Аминокислоты, строение, классификация. Биологическая роль аминокислот.
- •3. Белки, свойства белков (денатурация, нативность, изоэлектрическая точка белка, белки-коллоиды) Доменная структура белков. Белки-шапероны
- •4. Первичная, вторичная структура белков……
- •5. Третичная, четвертичная структура белков
- •6. Азотистый баланс. Полноценные и неполноценные белки. Биол ценность белков
- •7. Матричный биосинтез белков. Репликация.
- •8. Матричный биосинтез белков. Трансляция.
- •9. Матричный биосинтез белков. Транскрипция.
- •13. Вторичная структура днк. Типы а,в,z. Принципы комплементарности правило Чаргаффа.
- •14. Патологии обмена пуриновых оснований
- •10. Сложные белки. Классификация. Геиопротеины. Строение гема.
- •11. Нуклеиновые кислоты. Строение и биологическая роль.
- •24. Синтез холестерина до мевалоновой кислоты
- •24. Холестерин. Биологическое значение для организма. Атеросклероз
- •30. Липопротеины. Строение классификация биол роль
- •31.Биосинтез триглицеридов о фосфолипидов
- •36. Превращение аминокислот в толстом кишечнике
- •37. Всасывание продуктов распада белков. Судьба всосавшихся.
- •34. Механизм действия ферментов. Изоферменты, мультиферментные системы.
- •35. Переваривание белков в жкт
- •42. Патологии азотистого обмена
- •32. Ферменты…классификация и номенклатура
- •29. Желчные кислоты
- •31. Механизм действия гормонов.
- •50. Гормоны мозгового слоя надпочечников
- •51. Гормоны коркового слоя надпочечников
- •52. Инсулин…глюкагон..
- •53. Сахарный диабет
- •54. Гормоны щитовидной железы
- •55. Гормоны паращитовидной железы
- •16.Витамины, классиф, биол роль…гипо…гипер…
- •23. Липиды и лиоиды….Классификация…
- •22. Тканевое дыхание
- •18. Гликоген….Синтез гликогена
- •16. Витамины – коферменты
- •45. Клеточные мембраны
- •38.Дезаминирование. Биол значение примеры.
31.Биосинтез триглицеридов о фосфолипидов
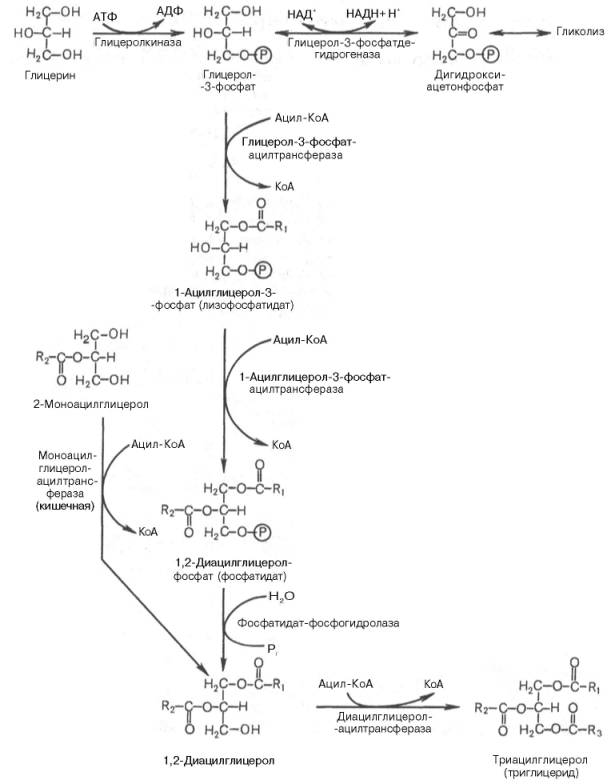
Синтез триглицеридов происходит из глицерина и жирных кислот (главным образом стеариновой, пальмитиновой и олеиновой). Путь биосинтеза триглицеридов в тканях протекает через образование α-глице-рофосфата (глицерол-3-фосфата) как промежуточного соединения. В почках, а также в стенке кишечника, где активность фермента глицеролкиназы высока, глицеринфосфорилируется за счет АТФ с образованием глицерол-3-фосфата:
![]()

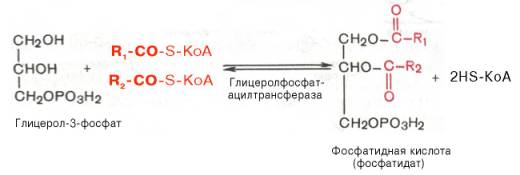
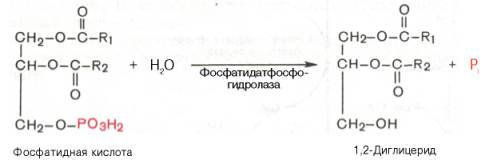

Синтез триглицеридов (триацилглицеролов) в тканях происходит с учетом двух путей образования глицерол-3-фосфата и возможности синтеза триглицеридов в стенке тонкой кишки из β-моноглицеридов, поступающих из полости кишечника в больших количествах после расщепления пищевыхжиров. На рис. 11.6 представлены глицерофосфатный, дигидроксиацетон-фосфатный и β-моноглицеридный (моноацилглицероловый) пути синтеза триглицеридов.
36. Превращение аминокислот в толстом кишечнике
Известно, что микроорганизмы кишечника для своего роста также нуждаются в доставке с пищей определенных аминокислот. Микрофлора кишечника располагает набором ферментных систем, отличных от соответствующих ферментов животных тканей и катализирующих самые разнообразные превращения пищевых аминокислот. В кишечнике создаются оптимальные условия для образования ядовитых продуктов распада аминокислот: фенола, индола, крезола, скатола, сероводорода, метилмер-каптана, а также нетоксичных для организма соединений: спиртов, аминов, жирных кислот, кетокислот, оксикислот и др.
Все эти превращения аминокислот, вызванные деятельностью микроорганизмов кишечника, получили общее название «гниение белков в кишечнике». Так, в процессе распада серосодержащих аминокислот (цистин,цистеин, метионин) в кишечнике образуются сероводород H2S и метил-меркаптан CH3SH. Диаминокислоты –орнитин и лизин – подвергаются процессу декарбоксилирования с образованием аминов – путресцина и кадаверина.
Из ароматических аминокислот: фенилаланин, тирозин и триптофан – при аналогичном бактериальномдекарбоксилировании образуются соответствующие амины: фенилэтиламин, параоксифенилэтиламин (или тира-мин) и индолилэтиламин (триптамин). Кроме того, микробные ферменты кишечника вызывают постепенное разрушение боковых цепей циклических аминокислот, в частности тирозина и триптофана, с образованием ядовитых продуктов обмена – соответственно крезола и фенола, скатола и индола.
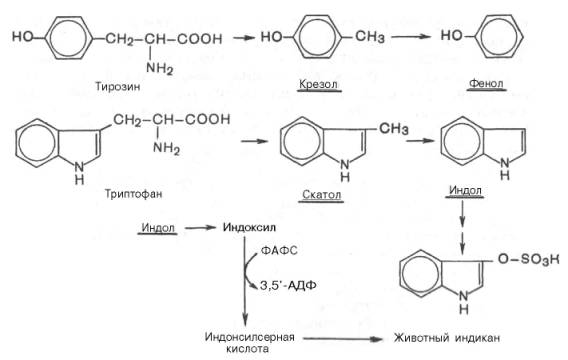
Индол (как и скатол) предварительно подвергается окислению в индоксил (соответственно скатоксил), который взаимодействует непосредственно в ферментативной реакции с ФАФС или с УДФГК. Так, индол связывается в виде эфиросерной кислоты. Калиевая соль этой кислоты получила название животного индикана, который выводится с мочой (см. главу 18). По количеству индикана в моче человека можно судить не только о скорости процесса гниения белков в кишечнике, но и о функциональном состоянии печени. О функции печени и ее роли в обезвреживании токсичных продуктов часто также судят по скорости образования и выделения гип-пуровой кислоты с мочой после приема бензойной кислоты
