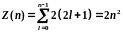- •1. Поступательное движение материальной точки. Скорость, ускорение (среднее, мгновенное). Уравнения движения при равноускоренном прямолинейном движении.
- •2. Вращательное движение (равномерное, неравномерное) материальной точки. Угловая скорость и ускорение. Связь между линейными и угловыми характеристиками движения
- •3. Классические законы динамики поступательного движения Основной закон динамики материальной точки
- •5. Момент силы, момент импульса материальной точки и системы материальных точек.
- •6. Осевой момент инерции материальной точки и системы материальных точек. Теорема Штейнера
- •8. Законы изменения и сохранения момента импульса
- •9. Работа силы. Мощность
- •2. Мо́щность — физическая величина, равная отношению работы, выполняемой за некоторый промежуток времени, к этому промежутку времени. – средняя мощность. – мгновенная мощность.
- •10. Кинетическая и потенциальная энергия. Закон сохранения механической энергии
- •11. Гармонические колебания и их характеристики. Смещение, скорость и ускорение при гармоническом колебательном движении
- •1) Колебания, которые встречаются в природе и технике, часто имеют близкий к гармоническому характер;
- •2) Различные периодические процессы (процессы, которые повторяются через равные промежутки времени) можно представить как суперпозицию (наложение) гармонических колебаний.
- •12. Дифференциальное уравнение гармонических колебаний. Пружинный, математический и физический маятники
- •13. Энергия гармонических колебаний
- •14. Давление в неподвижной жидкости. Уравнение Бернулли
- •15. Идеальный газ. Основное уравнение молекулярно-кинетической теории газов
- •17. Круговые процессы. Кпд тепловой машины. Кпд теплового двигателя, работающего по обратимому циклу Карно
- •18. Второе начало термодинамики. Энтропия и II начало термодинамики
- •19. Взаимодействие электрических зарядов. Закон Кулона
- •20. Напряженность электрического поля. Принцип суперпозиции полей
- •21. Электрический потенциал. Разность потенциалов. Работа по перемещению зарядов в электростатическом поле
- •84.1 Откуда следует, что потенциальная энергия заряда qq0 в поле заряда q равна
- •84.8 Где интегрирование можно производить вдоль любой линии, соединяющей начальную и конечную точки, так как работа сил электростатического поля не зависит от траектории перемещения.
- •22. Электрический диполь. Потенциал и напряженность поля диполя
- •1. Напряженность поля на продолжении оси диполя в точке а. Как видно из рисунка, напряженность поля диполя в точке а направлена по оси диполя и по модулю равна
- •2. Напряженность поля на перпендикуляре, восставленном к оси из его середины, в точке в (рис. 123). Точка в равноудалена от зарядов, поэтому
- •23. Диэлектрики. Явление поляризации диэлектриков
- •24. Проводники в электростатическом иоле. Явление электростатической индукции
- •25. Электроемкость проводника. Конденсатор, его электроемкость
- •26. Ток проводимости в металлах, его характеристики
- •1) Положительно заряженных ионов, колеблющихся около положения равновесия, и
- •2) Свободных электронов, способных перемещаться по всему объему проводника.
- •27. Обобщенный закон Ома в интегральной форме для участка цени и полной цепи
- •3 ) Если замкнутый участок цепи, содержит э.Д.С., тогда , и получаем: – закон Ома для замкнутого участка цепи, содержащего э.Д.С.
- •28. Правила Кирхгофа, их применение для решения задач с разветвленными цепями
- •29. Магнитное поле электрического тока. Индукция и напряженность магнитного поля. Правило Ампера для расчета силы, действующей на проводник с током в магнитном поле
- •30. Закон Био-Савара-Лапласа и его применение для расчета магнитных полей
- •31. Действие магнитного поля на движущийся заряд. Сила Лоренца
- •32. Магнитное взаимодействие проводников с током. Определение силы тока в 1 Ампер
- •33. Явление электромагнитной индукции. Основной закон (Фарадея) электромагнитной индукции. Правило Ленца. Явления самоиндукции, взаимной индукции. Индуктивность
- •34. Трансформатор. Коэффициент трансформации
- •35. Генерация электромагнитных волн в пространстве
- •36. Электромагнитные колебания. Колебательный контур. Свободные электромагнитные колебания
- •37. Свободные затухающие колебания. Вынужденные электромагнитные колебания. Переменный ток
- •38. Уравнение световой волны. Когерентность и монохроматичность световых волн
- •39. Интерференция света. Интерференционная картина от двух когерентных источников
- •40. Явление дифракции света. Положения принципа Гюйгенса-Френеля. Дифракция Фраунгофера на щели и дифракционной решетке. Рентгеноструктурный анализ
- •41. Естественный и поляризованный свет. Виды поляризации. Двойное лучепреломление. Поляризация при отражении и преломлении света. Закон Брюстера
- •42. Тепловое излучение и люминесценция. Абсолютно черное тело. Законы Кирхгофа, Стефана-Больцмана. Законы Вина. Квантовая гипотеза. Формула Планка
- •43. Единство волновых и корпускулярных свойств электромагнитного излучения. Гипотеза де-Бройля. Опытное обоснование корпускулярно-волнового дуализма веществ. Опыты Дэвиссона и Джермера
- •44. Волновая функция, ее статистический смысл. Соотношение неопределенностей Гейзенберга
- •45. Общее и стационарное уравнения Шредингера, их применение для решения физических задач
- •46. Резерфордовская модель строения атома. Модель Бора
- •47. Квантовомеханическое строение атома водорода. Энергетические уровни свободных атомов. Квантовые числа. Спин электрона. Принцип Паули
- •48. Энергетические зоны в кристаллах. Металлы, диэлектрики, полупроводники
- •49. Строение и основные характеристики атомных ядер. Ядерное взаимодействие. Дефект массы
- •50. Ядерные реакции. Деление ядер. Использование ядерной энергии
- •1) По роду участвующих в них частиц — реакции под действием нейтронов; реакции под действием заряженных частиц (например, протонов, дейтронов, α-частиц); реакции под действием ᵞ-квантов;
- •51. Реакции синтеза ядер. Использование ядерной энергии
- •52. Фундаментальные взаимодействия. Элементарные частицы, их свойства
47. Квантовомеханическое строение атома водорода. Энергетические уровни свободных атомов. Квантовые числа. Спин электрона. Принцип Паули
Состояние
электрона в атоме водорода.
Потенциальная энергия взаимодействия
электрона с ядром, обладающим зарядом
Ze (для
атома водорода Z
— 1),
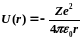 где г
— расстояние
между электроном и ядром.
где г
— расстояние
между электроном и ядром.
Стационарное
уравнение Шредингера для электрона в
атоме водорода
 где m
— масса
электрона; Е
— полная
энергия электрона в атоме.
где m
— масса
электрона; Е
— полная
энергия электрона в атоме.
Энергия
электрона в атоме водорода
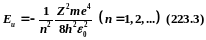
Решения уравнения Шредингера непрерывны, однозначны, и конечны в случаях:
при любых положительных значениях энергии (соответствует свободному электрону)
при дискретных отрицательных значениях энергии (соответствует получаемых из уравнения Шредингера собственным значениям энергии)
2.
Квантовые
числа.
В квантовой механике доказывается, что
уравнению Шредингера (223.2) удовлетворяют
собственные функции
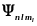 ,
определяемые тремя квантовыми числами:
главным
,
определяемые тремя квантовыми числами:
главным
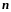 ,
орбитальным
,
орбитальным
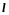 и
магнитным
и
магнитным
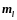 .
Главное
квантовое число n,
согласно
(223.3), определяет энергетические
уровни электрона в
атоме и может принимать любые целочисленные
значения: n=1,2,3
.
Главное
квантовое число n,
согласно
(223.3), определяет энергетические
уровни электрона в
атоме и может принимать любые целочисленные
значения: n=1,2,3
Орбитальное
квантовое число определяет,
согласно решению уравнения Шредингера,
момент
импульса электрона в
атоме.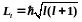 (223.4)
(223.4)
где — орбитальное квантовое число, которое при заданном п принимает значения =0,1, . . . , ( n – 1), т.е. всего n значений.
Магнитное
квантовое число n,
определяет,
согласно решению уравнения Шредингера,
проекцию
момента импульса электрона на заданное
направление, причем
вектор момента импульса электрона в
атоме может иметь в пространстве
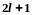 ориентации.
ориентации.
Спин
электрона. О.Штерн
и В.Герлах, проводя прямые измерения
магнитных моментов, обнаружили в 1922 г.,
что узкий пучок атомов водорода, заведомо
находящихся в s-состоянии,
в неоднородном магнитном поле расщепляется
на два пучка. В этом состоянии момент
импульса электрона равен нулю. Магнитный
момент атома, связанный с орбитальным
движением электрона, пропорционален
механическому моменту, поэтому он равен
нулю и магнитное поле не должно оказывать
влияния на движение атомов водорода в
основном состоянии, т.е. расщепления
быть не должно. Однако в дальнейшем при
применении спектральных приборов с
большой разрешающей способностью было
доказано, что спектральные линии атома
водорода обнаруживают тонкую структуру
(являются дублетами) даже
в отсутствие
магнитного поля. Для объяснения тонкой
структуры спектральных линий, а также
ряда других трудностей в атомной физике
американские физики Д. Уленбек (1900 —1974)
и С. Гаудсмит (1902 - 1979) предположили, что
электрон обладает собственным
неуничтожимым механическим моментом
импульса, не
связанным с движением электрона в
пространстве, — спином.
Спин электрона (и всех других микрочастиц)
— квантовая величина, у нее нет
классического аналога; это внутреннее
неотъемлемое свойство электрона,
подобное его заряду и массе. Если
электрону приписывается собственный
механический момент им пульса (спин)
Ls,
то ему
соответствует собственный
магнитный момент pms.
Согласно
общим выводам квантовой механики, спин
квантуется по закону
 ,
где s
— спиновое
квантовое число. По
аналогии с орбитальным моментом импульса,
проекция Lsz
спина
квантуется так, что вектор Ls
может
принимать 2s + 1 ориентации.
,
где s
— спиновое
квантовое число. По
аналогии с орбитальным моментом импульса,
проекция Lsz
спина
квантуется так, что вектор Ls
может
принимать 2s + 1 ориентации.
Принцип Паули. Распределение электронов в атоме по состояниям
Если
тождественные частицы имеют одинаковые
квантовые числа, то их волновая функция
симметрична относительно перестановки
частиц. Отсюда следует, что два одинаковых
фермиона, входящих в одну систему, не
могут находиться в одинаковых состояниях,
так как для фермионов волновая функция
должна быть антисимметричной. Обобщая
опытные данные, В. Паули сформулировал
принцип, согласно которому системы
фермионов встречаются в природе только
в состояниях, описываемых антисимметричными
волновыми функциями (квантово-механическая
формулировка принципа
Паули). Из
этого положения вытекает более простая
формулировка принципа Паули, которая
и была введена им в квантовую теорию
(1925) еще до утверждения квантовой
механики: в
системе одинаковых фермиоиов любые два
из них не могут одновременно находиться
в одном и том же состоянии. Таким
образом, принцип Паули утверждает, что
два электрона, связанные в одном и том
же атоме, различаются значениями по
крайней мере одного квантового числа.
Квантовое число ms
может
принимать лишь два значения (±1/2).
Поэтому максимальное число электронов,
находящихся в состояниях, определяемых
данным главным квантовым числом, равно