
- •Програма державного екзамену з хімії
- •2.1. Програма навчальної дисципліни «Неорганічна хімія»
- •2.1.1. Методичне забезпечення
- •2.1.2. Рекомендована література: Основна:
- •Додаткова:
- •2.2. Програма навчальної дисципліни «Органічна хімія»
- •Змістовний модуль 3. Функціональні похідні аліфатичних вуглеводнів.
- •Змістовний модуль 5. Основи біоорганічної хімії.
- •2.2.1. Методичнее забезпечення:
- •2.2.2. Рекомендована література Основна:
- •Додаткова:
- •2.3. Програма навчальної дисципліни «Аналітична хімія»
- •2.3.1. Методичне забезпечення
- •2.3.2. Рекомендована література: Основна
- •Додаткова
- •2.4. Програма навчальної дисципліни «Фізична і колоїдна хімія»
- •2.4.1. Методичне забезпечення
- •2.4.2. Рекомендована література: Основна:
- •Додаткова:
- •2.5. Програма навчальної дисципліни «Загальна хімічна технологія»
- •2.5.1. Методичне забезпечення
- •2.5.2. Рекомендована література: Основна
- •Додаткова
- •2.6. Програма навчальної дисципліни «Хімія високомолекулярних сполук»
- •2.6.1. Методичне забезпечення
- •2.6.2. Рекомендована література: Основна
- •Додаткова
- •2.7. Програма навчальної дисципліни «Біологічна хімія»
- •2.7.1. Методичне забезпечення
- •2.7.2. Рекомендована література: Основна
- •Додаткова
- •3. Критерії оцінювання
- •4. Зразки комплексних кваліфікаційних завдань.
- •5. Зразки відповідей на комплексні кваліфікаційні завдання.
- •1. Кислоти. Класифікація та номенклатура кислот. Одержання і хімічні властивості кислот.
- •2. Алкени. Номенклатура алкенів. Промислові та лабораторні методи одержання алкенів.
- •3. Загальні властивості каталізаторів. Механізм гомогенного каталізу
- •4. Задача
2. Алкени. Номенклатура алкенів. Промислові та лабораторні методи одержання алкенів.
Алкенами називають вуглеводні, в молекулах яких міститься один подвійний зв’язок між атомами карбону. Їх називають ще ненасиченими вуглеводнями, або олефінами. Загальна формула CnH2n. Атоми Карбону, які утворюють подвійні зв’язки знаходяться в стані sp2–гібридизації і за рахунок перекриття трьох гібридизованх орбіталей утворюють три σ–зв'язки. Негібридні р–орбіталі, взаємно перекриваючись, утворюють π–зв’язок, який характеризується меншою міцністю (менша взаємодія π–електронів з ядрами атомів карбону) і більшою поляризованістю (легкістю зміщення електронної густини π–зв’язку під дією зовнішніх факторів). Така електронна будова подвійного зв’язку зумовлює хімічні властивості алкенів, реакційна здатність яких є вищою ніж реакційна здатність алканів. Алкени здатні, перш за все, до реакцій приєднання по місцю розриву π–зв’язку. Це реакції приєднання водню (гідрування), галогенів (галогенування), галогеноводнів (гідрогалогенування), води (гідратація), алкільних радикалів (алкілювання) і реакції полімеризації. Реакції приєднання у алкенів можуть проходити як за іонним так, і за радикальним механізмом. Більшість реакцій приєднання відбувається за правилом Марковнікова – Гідроген приєднується до більш гідрогенізованого атому Карбону. У присутності пероксидних сполук реакції приєднання відбуваються всупереч правилу Марковнікова (ефект Караша).
Номенклатура і фізичні властивості алкенів.
За номенклатурою IUPAC назви алкенів утворюють від назв відповідних алканів заміною закінчення –ан на –ен. Головний ланцюг обов’язково повинен включати подвійний зв'язок, і його нумерацію починають з того кінця, ближче до якого розташований подвійний зв'язок. Положення останього в ланцюгу молекули позначають цифрою – положенням атома Карбону, біля якого він знаходиться. Цю цифру прийнято ставити перед суфіксом –ен.
Назва |
Структурна формула |
Етилен |
|
Пропілен |
|
Бут-1-ен |
|
Бут-2-ен |
|
Ізобутен
|
|
Методи одержання алкенів:
Промислові:
1. Виділення з продуктів крекінгу нафти та природного газу.
2. Дегідрування алканів

3. Синтез 1-алкенів за допомогою алюміній органічних сполук


Лабораторні:
1.Дегідратація спиртів

2. Відщеплення галогеноводнів або галогенів від галогеналканів
![]()
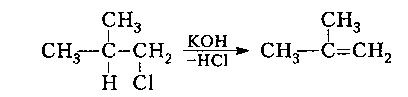

3. Гідрування алкінів та алкадієнів

3. Загальні властивості каталізаторів. Механізм гомогенного каталізу
Каталізом називається зміщення швидкості хімічної реакції під впливом речовини, що реагує на проміжних стадіях процесу і регенерується в кінці реакції. Така речовина називається каталізатором. Розрізняють гомогенний та гетерогенний каталіз. Якщо взаємодія каталізатора і реагентів відбувається в одній фазі, то такий каталіз називається гомогенним. При гетерогенному каталізі реагуючі речовини і каталізатор перебувають у різних фазах. Каталізатори мають певні загальні закономірності:
Каталізатори не впливають на загальну стехіометрію реакції, він бере участь у процесі, витрачається на одній стадії і регенерується на інщій.
Каталізатор зменшує енергію активації реакції, завдяки чому збільшує її швидкість.
Каталізатор характеризується селективністю, тобто прискорює лише одну з кількох термодинамічно можливих реакцій. Наприклад: СО і Н2 залежно від каталізатора можуть утворювати різні продукти реакції:
 .
.Каталізатор не впливає на константу рівноваги, він лише скорочує час досягнення рівноваги, однаково збільшуючи швидкість прямої та зворотної реакцій.
Для помітної каталітичної дії достатньо незначної кількості каталізатора. Дія каталізатора залежить від його фізичного стану і присутності домішок;
Суміш каталізаторів діє значно сильніше, ніж окремі каталізатори;
При гомогенному каталізі реагуючі речовини і каталізатор утворюють проміжні сполуки, які реагують з іншою речовиною в результаті чого отримуються продукти. Схематично даний процес можна відобразити так:
процес без каталізатора
![]()
процес з каталізатором
![]()
Каталізатор утворює з одним з реагентів нестійку сполуку, яка при взаємодії з іншою речовиною утворить кінцевий продукт. Як видно з даного процесу каталізатор залишається незмінним на початку і в кінці процесу. Швидкість реакції за схемою 2 значно перевищує швидкість реакції за схемою 1. Тому сумарний процес з участю каталізатора відбувається швидше, ніж без нього. Це пов’язано з меншою висотою енергетичного бар’єру. Прикладами гомогенного каталізу в газовій фазі може бути реакція розкладу ацетальдегіду при Т = 800 К відбувається наступним чином
![]() .
.
Швидкість цієї реакції в присутності парів йоду протікає приблизно в 10 тис. раз швидше ніж без нього. Це пов’язано із зменшенням висоти енергетичного бар’єру. Без каталізатора енергія активації даної реакції – 190 кДж/моль, а з каталізатором – 130 кДж/моль.
В цьому випадку процес протікає в 2 стадії:
1.![]() .
В ході реакції утворилось 2 проміжні
сполуки CH3I
і HI, які
реагують між собою і утворюють кінцеві
продукти.
.
В ході реакції утворилось 2 проміжні
сполуки CH3I
і HI, які
реагують між собою і утворюють кінцеві
продукти.
2.
![]()
Швидкість хімічних реакцій в гомогенних процесах пропорційна концентрації каталізатора.
Існують такі типи гомогенного каталізу: кислотно-основний, окисно-відновний, координаційний, гомогенний газофазний, ферментативний.


