
- •Содержание
- •§1 Сущность объемного анализа………………………………….……….……………………..2
- •§2 Общее уравнение реакции титрования и выводы из него………………………….………12
- •§3 Титрование по методу нейтрализации………………………………………………………16
- •§4 Окислительно-восстановительное титрование…………………………………...………...30
- •Введение
- •§1 Сущность объемного анализа
- •Определяемое вещество
- •Реагент (реактив)
- •Титрование
- •1.5 Стандартный, или титрованный, раствор (титрант)
- •1.6 Нормальность раствора (или n)
- •1.7 Правило (закон) эквивалентности
- •1.8 Точка эквивалентности и конечная точка титрования
- •1.9 Навеска анализируемого вещества
- •1.10 Требования, предъявляемые к реакциям.
- •1.11 Реагенты, применяемые при титровании
- •1.12 Условия титрования
- •§2. Общее уравнение реакции титрования и выводы из него
- •2.1 Общие приемы титрования.
- •2.2. Обратное титрование
- •§3.Титрование по методу «нейтрализации»
- •3.1. Сущность метода
- •3.2. Классификация метода
- •3.3. Приготовление рабочих растворов
- •3.5 Построение кривой титрования
- •3.6 Подборка индикатора. Расчет индикаторных ошибок титрования
- •4.2. Условия проведения реакций окислительно-восстановительного титрования
- •4.3. Виды окислительно-восстановительного титрования
- •4.4. Индикаторы метода
- •4.5. Йодометрия
- •4.5.1. Достоинства и недостатки йодометрии
- •4.5.2. Индикаторы йодометрии
- •4.5.3. Условия титрования
- •4.5.4. Приготовление рабочих растворов
- •4.7 Построение кривой
- •Список литературы
3.5 Построение кривой титрования
-
% титрования
рН
0
11,6
10
11,2
20
10,8
30
10,6
40
10,4
50
10,2
60
10
70
9,8
80
9,6
90
9,2
99,9
8,9
100
8,35
100,1
7,6
110
7,45
120
7,1
130
6,9
140
6,7
150
6,5
160
6,3
170
6,1
180
5,9
190
5,5
200
3,8
210
2,3
220
2
230
1,9
240
1,8
250
1,7
260
1,6
270
1,5
3.6 Подборка индикатора. Расчет индикаторных ошибок титрования
Таблица 1. Типы индикаторных погрешностей
Тип погрешности |
Причина погрешности |
Расчетная формула погрешности, % |
Водородная |
Избыток ионов Н+ вследствие недотитрования сильной кислоты или перетитрования основания (сильного или слабого) сильной кислотой |
∆H+ = (10-pT*V2*100)/(c*V1) |
Гидроксильная |
Избыток ионов ОН - вследствие недотитрования сильного основания или перетитрования кислоты (слабой или сильной) сильным основанием |
∆ОН- = (10-(14-pT)*V2*100)/(c*V1) |
Кислотная |
Избыток молекул слабой кислоты НА при её недотитровании |
∆НА = (10pK-pT*100)/(1+10pK-pT) |
Щелочная |
Избыток молекул слабого основания MOH при его недотитровании |
∆МОН = = 10pK+pT-14*100 |
где V1 и V2 - объемы анализируемого раствора до и после титрования; с - молярная концентрация эквивалента вещества анализируемого раствора; рК - показатель константы диссоциации слабого электролита; рТ - показатель титрования индикатора.
1
) рН(в точка эк-ти ) = 8,35 <рТ=3 к-ты
перетитрована щелочью следовательно
возникает
 ошибка
ошибка
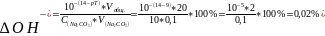
2)
pH
(в точка эк-ти)=8,35>pT=3,4

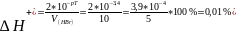
Вывод
С помощью расчетов точек кривой титрования по методу «нейтрализации» кривой 0,2 н Na2CO3 - 0,1 M HBr , вычислили скачок титрования. Скачок небольшой, это обуславливается тем, что слабая кислота титруется сильным основанием.
С помощью расчета индикаторных ошибок, подобрали оптимальные индикаторы. С индикатором _________________ индикаторная ошибка составила _____________ С индикатором ___________ ошибка составила _____________ . Ошибка со вторым индикатором меньше, следовательно, титровать раствор Na2CO3 раствором HBr лучше со вторым индикатором.
§4. Окислительно-восстановительное титрование
4.1. Классификация редокс-методов
Известно несколько десятков различных методов ОВ титрования. Обычно их классифицируют следующим образом:
Классификация по характеру титранта. В этом случае методы ОВ титрования подразделяют на две группы:
оксидиметрия — методы определения восстановителей с применением титранта-окислителя;
редуктометрия — методы определения окислителей с применением титранта-восстановителя.
2. Классификация по природе реагента, взаимодействующего с определяемым веществом. Ниже после названия соответствующего метода в скобках указано основное действующее вещество этого метода: броматометрия (KBrO3), бромометрия (Br2), дихроматометрия (K2Cr2O7), иодатометрия (KIO3), иодометрия (I2), нитритометрия (NaNO2), пермангонатометрия (KMnO4), цериметрия (Ce(SO4)2), титанометрия (Ti3+), ванадатометрия (NH4VO3) и др. Реже применяются некоторые другие методы ОВ титрования, такие, аскорбинометрия (аскорбиновая кислота).
