
- •2Реакции ионного обмена в водных растворах.Гидролиз.Среда водных растворов.
- •3 Тепловой эффект химической реакции Экзотермические и Эндотермические реакции.
- •4.Оксиды.Классификации и типичные реакции.
- •7Классификация неорганических соединений.
- •8.Металлы физические и химические свойства.
- •9.Кислоты.Химические и физические свойства.Классификация кислот.
- •13.Неметаллы химические и физические свойства
- •14.Строение атома углерода.Валентное состояние атома углерода.
- •15Теория строения органических соединений а. Н. Бутлерова.
9.Кислоты.Химические и физические свойства.Классификация кислот.
Кисло́ты — химические соединения, способные отдавать катион водорода (кислоты Бренстеда) либо соединения, способные принимать электронную пару с образованием ковалентной связи (кислоты Льюиса)
Кроме подразделения на кислоты Льюиса и кислоты Брёнстеда, последние принято классифицировать по различным формальным признакам:
По содержанию кислорода:
бескислородные (HCl, H2S);
кислородосодержащие (HNO3, H2SO4).
По количеству кислых атомов водорода[10]:
одноосновные (HNO3);
двухосновные (H2SeO4);
трёхосновные (H3PO4, H3BO3);
многоосновные.
По силе
Сильные — диссоциируют практически полностью, константы диссоциации больше 1·10−3 (HNO3);
Слабые — константа диссоциации меньше 1·10−3 (уксусная кислота Kд= 1,7·10−5).
По устойчивости
Устойчивые (H2SO4);
Неустойчивые (H2CO3).
По принадлежности к классам химических соединений
Неорганические (HBr);
Органические (HCOOH,CH3COOH);
По летучести
Летучие (HNO3,H2S, HCl);
Нелетучие (H2SO4) ;
По растворимости в воде
Растворимые (H2SO4);
Нерастворимые (H2SiO3);
Классификация. По
наличию (отсутствию) кислорода в составе
кислот они подразделяются
накислородсодержащие (например, H3PO4 и H2SO4)
и бескислородные (например, HCl и HBr).
По основности (числу ионов H+,
образующихся при полной диссоциации,
или количеству ступеней диссоциации)
кислоты делятся наодноосновные (если
образуется один ион H+: HCl![]() H+ +
Cl–;
одна ступень диссоциации)
и многоосновные –двухосновные (если
образуются два иона H+: H2SO4
2H+ +
SO42–;
две ступени диссоциации), трехосновные(если
образуются три иона H+: H3PO4
3H+ +
PO43–;
три ступени диссоциации) и т.д.
H+ +
Cl–;
одна ступень диссоциации)
и многоосновные –двухосновные (если
образуются два иона H+: H2SO4
2H+ +
SO42–;
две ступени диссоциации), трехосновные(если
образуются три иона H+: H3PO4
3H+ +
PO43–;
три ступени диссоциации) и т.д.
Физические свойства. Кислоты бывают газообразные, жидкие и твердые. Некоторые имеют запах и цвет. Кислоты отличаются различной растворимостью в воде.
Химические свойства кислот
1) Диссоциация: HCl + nH2O H+kH2O + Cl–mH2O (сокращенно: HCl H+ + Cl– ).
Многоосновные кислоты диссоциируют по ступеням (в основном по первой):
H2SO4 H+ + НSO4– (1 ступень) и HSO4– H+ + SO42– (2 ступень).
2) Взаимодействие с индикаторами:
индикатор + Н+ (кислота) окрашенное соединение.
Фиолетовый лакмус и оранжевый метилоранж окрашиваются в кислых средах в розовый цвет, бесцветный раствор фенолфталеина не меняет своей окраски.
3) Разложение. При разложении кислородсодержащих кислот получаются кислотный оксид и вода.
H2SiO3 ![]() SiO2 +
H2O.
SiO2 +
H2O.
Бескислородные кислоты распадаются на простые вещества:
2HCl Cl2 + H2
Кислоты-окислители разлагаются сложнее:
4НNO3 4NO2 + 2H2O + O2.
4) Взаимодействие с основаниями и амфотерными гидроксидами:
H2SO4 + Ca(OH)2 CaSO4 + 2H2O 2H+ + SO42– + Ca2+ +2OH– CaSO4 + 2H2O
H2SO4 + Zn(OH)2 ZnSO4 + 2H2O 2H+ + Zn(OH)2 Zn2+ + 2H2O.
5) Взаимодействие с основными и амфотерными оксидами:
H2SO4 + CaO CaSO4 + H2O 2H+ + SO42– + CaO CaSO4 + H2O
H2SO4 + ZnO ZnSO4 + H2O 2H+ + ZnO Zn2+ + H2O.
6) Взаимодействие с металлами: а) кислоты-окислители по Н+ (HCl, HBr, HI, HClO4, H2SO4, H3PO4 и др.).
В реакцию вступают металлы, расположенные в ряду активности до водорода:
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
2HCl + Fe FeCl2 + H2 2H+ + Fe Fe2+ + H2
б) кислоты-окислители по аниону (концентрированная серная, азотная любой концентрации):
2Fe + 6H2SO4 (конц.) Fe2(SO4)3 + 3SO2 + 6H2O
2Fe + 12H+ + 3SO42– 2Fe3+ + 3SO2 + 6H2O.
7) Взаимодействие с солями. Реакция происходит, если соль образована более слабой или летучей кислотой, или если образуется осадок:
2HCl + Na2CO3 2NaCl + CO2 + H2O 2H+ + CO32– CO2 + H2O
СaCl2 + H2SO4 CaSO4 + 2HCl Сa2+ + SO4 CaSO4
Получение. Бескислородные кислоты получают:
1) Из неметаллов и водорода с последующим растворением образовавшегося газа в воде:
Cl2 + H2 2HCl
2) При действии сильных кислот на соли более слабых или летучих бескислородных кислот:
2HCl + Na2S 2NaCl + Н2S 2H+ + S2– Н2S.
Кислородсодержащие кислоты получают:
1) Взаимодействием кислотного оксида и воды. Оксид кремния(IV) SiO2 с водой не реагирует!
SO2 + H2O H2SO3.
2) При действии сильных кислот на соли более слабых или летучих кислородсодержащих кислот:
2HCl + Na2CO3 2NaCl + Н2СО3 2H+ + CO32– Н2СО3.
10.Основание химические и физические свойства.
Основания – сложные вещества, состоящие из атома металла и одной или нескольких гидроксильных групп.Общая формула оснований Ме(ОН)n. Основания (с точки зрения теории электролитической диссоциации) – это электролиты, диссоциирующие при растворении в воде с образованием катионов металла и гидроксид-ионов ОН–.
Классификация. По растворимости в воде основания делят на щелочи (растворимые в воде основания) инерастворимые в воде основания. Щелочи образуют щелочные и щелочно-земельные металлы, а также некоторые другие элементы-металлы. По кислотности (числу ионов ОН–, образующихся при полной диссоциации, или количеству ступеней диссоциации) основания подразделяют на однокислотные (при полной диссоциации получается один ион ОН–; одна ступень диссоциации) и многокислотные (при полной диссоциации получается больше одного иона ОН–; более одной ступени диссоциации). Среди многокислотных оснований различают двухкислотные (например, Sn(OH)2), трехкислотные (Fe(OH)3) и четырехкислотные (Th(OH)4). Однокислотным является, например, основание КОН.
Выделяют группу гидроксидов, которые проявляют химическую двойственность. Они взаимодействую как с основаниями, так и с кислотами. Это амфотерные гидроксиды (см. таблицу 1).
Таблица 1 - Амфотерные гидроксиды
Амфотерный гидроксид (основная и кислотная форма) |
Кислотный остаток и его валентность |
Комплексный ион |
Zn(OH)2 / H2ZnO2 |
ZnO2 (II) |
[Zn(OH)4]2– |
Al(OH)3 / HAlO2 |
AlO2 (I) |
[Al(OH)4]–, [Al(OH)6]3– |
Be(OH)2 / H2BeO2 |
BeO2 (II) |
[Be(OH)4]2– |
Sn(OH)2 / H2SnO2 |
SnO2 (II) |
[Sn(OH)4]2– |
Pb(OH)2 / H2PbO2 |
PbO2 (II) |
[Pb(OH)4]2– |
Fe(OH)3 / HFeO2 |
FeO2 (I) |
[Fe(OH)4]–, [Fe(OH)6]3– |
Cr(OH)3 / HCrO2 |
CrO2 (I) |
[Cr(OH)4]–, [Cr(OH)6]3– |
Физические свойства. Основания - твердые вещества различных цветов и различной растворимости в воде.
Химические свойства оснований
1) Диссоциация: КОН + nН2О К+mН2О + ОН–dН2О или сокращенно: КОН К+ + ОН–.
Многокислотные основания диссоциируют по нескольким ступеням (в основном диссоциация протекает по первой ступени). Например, двухкислотное основание Fe(OH)2 диссоциирует по двум ступеням:
Fe(OH)2 FeOH+ + OH– (1 ступень);
FeOH+ Fe2+ + OH– (2 ступень).
2) Взаимодействие с индикаторами (щелочи окрашивают фиолетовый лакмус в синий цвет, метилоранж – в желтый, а фенолфталеин – в малиновый):
индикатор + ОН– (щелочь) окрашенное соединение.
3) Разложение с образованием оксида и воды (см. таблицу 2). Гидроксиды щелочных металлов устойчивы к нагреванию (плавятся без разложения). Гидроксиды щелочно-земельных и тяжелых металлов обычно легко разлагаются. Исключение составляет Ba(OH)2, у которого tразл достаточно высока (примерно 1000 °C).
Zn(OH)2 ZnO + H2O.
4) Взаимодействие щелочей с некоторыми металлами (например, Al и Zn):
В растворе: 2Al + 2NaOH + 6H2O 2Na[Al(OH)4] + 3H2
2Al + 2OH– + 6H2О 2[Al(OH)4]– + 3H2.
При сплавлении: 2Al + 2NaOH + 2H2O 2NaAlО2 + 3H2
5) Взаимодействие щелочей с неметаллами:
6NaOH + 3Cl2 5NaCl + NaClO3 + 3H2O.
6) Взаимодействие щелочей с кислотными и амфотерными оксидами:
2NaOH + СО2 Na2CO3 + H2O 2OH– + CO2 CO32– + H2O.
В растворе: 2NaOH + ZnO + H2O Na2[Zn(OH)4] 2OH– + ZnO + H2О [Zn(OH)4]2–.
При сплавлении с амфотерным оксидом: 2NaOH + ZnO Na2ZnO2 + H2O.
7) Взаимодействие оснований с кислотами:
H2SO4 + Ca(OH)2 CaSO4 + 2H2O 2H+ + SO42– + Ca2+ +2OH– CaSO4 + 2H2O
H2SO4 + Zn(OH)2 ZnSO4 + 2H2O 2H+ + Zn(OH)2 Zn2+ + 2H2O.
8) Взаимодействие щелочей с амфотерными гидроксидами (см. таблицу 1):
В растворе: 2NaOH + Zn(OH)2 Na2[Zn(OH)4] 2OH– + Zn(OH)2 [Zn(OH)4]2–
При сплавлении: 2NaOH + Zn(OH)2 Na2ZnO2 + 2H2O.
9) Взаимодействие щелочей с солями. В реакцию вступают соли, которым соответствует нерастворимое в воде основание:
CuSО4 + 2NaOH Na2SO4 + Cu(OH)2 Cu2+ + 2OH– Cu(OH)2.
Получение. Нерастворимые в воде основания получают путем взаимодействия соответствующей соли со щелочью:
2NaOH + ZnSО4 Na2SO4 + Zn(OH)2 Zn2+ + 2OH– Zn(OH)2.
Щелочи получают:
1) Взаимодействием оксида металла с водой:
Na2O + H2O 2NaOH CaO + H2O Ca(OH)2.
2) Взаимодействием щелочных и щелочно-земельных металлов с водой:
2Na + H2O 2NaOH + H2 Ca + 2H2O Ca(OH)2 + H2.
3) Электролизом растворов солей:
2NaCl
+ 2H2O ![]() H2+
2NaOH
+ Cl2
H2+
2NaOH
+ Cl2
4) Обменным взаимодействием гидроксидов щелочно-земельных металлов с некоторыми солями. В ходе реакции должна обязательно получаться нерастворимая соль.
Ba(OH)2 + Na2CO3 2NaOH + BaCO3 Ba2+ + CO32– BaCO3.
11.Соли физические и химические свойства.
Соли - это кристаллические вещества разных цветов и разной растворимости в воде. Растворимость соли можно определить по таблице «Растворимость солей, кислот, оснований в воде»
Химические свойства
1) Разложение при нагревании. При нагревании некоторых солей они разлагаются на оксид металла и кислотный оксид:
СаСO3 → СаO + СО2.
соли бескислородных кислот при нагревании могут распадаться на простые вещества:
2AgCl→Ag + Cl2.
Исключение. Соли щелочных металлов:
2KClO3 = 2 KCl + 3 O2
2КNO3 →2КNO2 + O2
Разложение малахита при нагревании:
(CuOH)2CO3 = 2CuO+CO2+H2O
Разложение дихромата аммония при нагревании "Вулкан":
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O
2) Взаимодействие с кислотами: Реакция происходит, если соль образована более слабой или летучей кислотой, или если образуется осадок.
2HCl + Na2CO3 → 2NaCl + CO2↑+ H2O
СaCl2 + H2SO4→ CaSO4 ↓ + 2HCl
Видео "Взаимодействие с кислотами"
3) Взаимодействие со щелочами. Со щелочами реагируют соли, если при этом образуется нерастворимое основание.
CuSO4 + 2NaOH→ Cu(OH)2↓ + Na2SO4
Видео "Взаимодействие щелочей с солями"
4) Взаимодействие друг с другом. Реакция происходит, если взаимодействуют растворимые соли и при этом образуется осадок.
AgNO3 + NaCl → AgCl↓ + NaNO3
5) Взаимодействие с металлами. Каждый предыдущий металл в ряду напряжений вытесняет последующий за ним из раствора его соли:
Fe + CuSO4 → Cu + FeSO4
Видео "Взаимодействие металлов с солями"
6) Взаимодействие с кислотными оксидами.
Na2CO3 + SiO2 → СО2 ↑+ Na2SiO3
Физические свойства:
1.являются электролитами(электролиты это в-ва,растворы или сплавы которых проводят электрический ток)

12.Химические реакции замещения и обмена
Реакции замещения – химические реакции, в которых атомы или группы атомов одного из исходных веществ замещают атомы или группы атомов в другом исходном веществе. |
Примеры реакций замещения:
CuSO4 + Fe = FeSO4 + Cu ; (7) 2NaI + Cl2 = 2NaCl + I2; (8) CaCO3 + SiO2 = CaSiO3 + CO2 . (9)
Реакции обмена – химические реакции, в которых исходные вещества как бы обмениваются своими составными частями. |
Примеры реакций обмена:
Ba(OH)2 + H2SO4 = BaSO4 + 2H2O; (10) HCl + KNO2 = KCl + HNO2; (11) AgNO3 + NaCl = AgCl + NaNO3. (12)
Реакции замещения (англ. substitution reaction) — химические реакции, в которых одни функциональные группы, входящие в состав химического соединения, меняются на другие группы. Реакции замещения обозначают английской буквой «S».
Общий вид реакций замещения:
![]()
Обычно, один из реагентов, в котором происходит замещение («R-X»), называют субстратом, а другой («Y-Z») — атакующим реагентом. Группа «X» называетсяуходящей, а группа «Y» — вступающей
Примером реакции замещения может служить фотолитическое хлорирование метана:
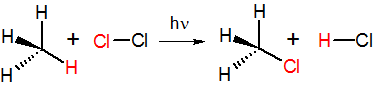
В зависимости от способа расщепления связи, реакции замещения делятся на гомолитические (радикальные) и гетеролитические. Последние, в свою очередь, из-за типа атакующего реагента относят к нуклеофильным или электрофильным реакциям[2].
В органической химии реакции замещения имеют важнейшее значение. Детальное изучение типового механизма реакции позволяет не просто предсказать её результат для конкретных реагентов, но и получить представление о выборе оптимальных температурных условий её протекания, подборе растворителя или возможного катализатора.
Реакции обмена - это химические реакции, при которых молекулы двух сложных веществ обмениваются своими составными частями (атомами или целыми составными частями своих молекул). Реакции всегда происходят без изменения валентного состояния атомов (без изменения степени окисления атомов, входящих в состав реагирующих веществ). Реакции обмена - наиболее распространенная группа реакций между сложными веществами (оксидами, основаниями, кислотами и солями). Обычно эти реакции подчиняются законам химического равновесия и протекают в том направлении, где хотя бы одно из веществ удаляется из сферы реакции в виде газообразного, летучего вещества, осадка или малодиссоциирующего (для растворов) соединения. Например: ___NаНСO3 + НСl = NаСl + H2O + СO2^ ___Са(НСO3)2 + Са(OH)2 = 2СаСO3V + 2H2O ___СH3СООNа + H3РО4 = СH3СООН + NаH2РО4 ___Na2SO4 + BaCl2 = 2NaCl + BaSO4 ___CuO + H2SO4 = CuSO4 + H2O (Н и Cu) ___Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O (Н и Fe) ___NaOH + HCl = NaCl + H2O (Н и Na) ___ZnO + H2SО4 = ZnSО4 + H2O ___AgNO3 + КВr = АgВr + КNO3 ___СrСl3 + ЗNаОН = Сr(ОН)3 + ЗNаСl ___H+1N+5O3-2 + Na+1O-2H+1 = Na+1N+5O3-2 + H2+1O-2 Частный случай реакций обмена - реакция нейтрализации: ___НСl + КОН = КСl + H2O Реакции гидролиза (разложение водой)- любое взаимодействие вещества с водой обменного характера, при котором составные части вещества соединяются с составными частями H2O. Реакции гидролиза записывают в виде: - молекулярного уравнения: KNO2 + H2O < = > KOH + HNO2 - ионного уравнения: ___NO2- + H2O < = > HNO2 + OH- ___NH4+ + H2O = NH4ОН + Н+ (образующийся ион Н обусловливает кислотную среду раствора, т. е. рН меньше 7). Реакции ионного обмена - это реакции взаимодействия между ионами в водных растворах электролитов (являются разновидностью химических реакций обмена). Простые ионные реакции без переноса электронов происходят, когда один из продуктов нерастворим (газ или твердое вещество) или является ковалентно связанным веществом, остающимся в растворе. Если смешать растворы двух диссоциирующих веществ, то (+) заряженные ионы(катионы) взаимодействуют с ионами, заряженными (-)(анионами). Отличительной особенностью реакции ионного обмена от окислительно-восстановительных реакций является то, что они протекают без изменения степеней окисления, участвующих в реакции частиц. Уравнения этих реакций называются ионными уравнениями. Пример сокращенного ионного уравнения реакции: ___Fe3+ + 3ОН- = Fe(OH)3v Сущность реакции сводится к взаимодействию ионов Fe3+ и ОН-, в результате чего образуется осадок Fе(ОН)3. При этом не имеет значения, в состав каких электролитов входили эти ионы до их взаимодействия Реакции нейтрализации - разновидность (частный случай) химических реакций обмена (протекают между кислотой и основанием с образованием соли и воды), например, ___НСl + КОН = КСl + H2O ___NaOH + HCl = NaCl + H2O ___2NaOH + H2SO4 = Na2SO4 + 2H2O Реакции нейтрализации широко используются при ликвидации последствий бытовых отравлений. Природа образующихся продуктов реакции нейтрализации и среда получающегося раствора зависят от сочетания силы кислоты и силы основания, образующих соль. Возможны 4 варианта взаимодействия ионов соли в зависимости от ее природы (примеры): * сильная кислота-сильное основание, например: HCl(p-p) + NaOH(p-p) = NaCl(p-p) + Н2О * сильная кислота-слабое основание, например: (Cu(OH)2 +2HCL = CuCl2 + 2H2O) * слабая кислота-сильное основание, например: 2NaOH + H2CO3 = Na2CO3 + H2O * слабая кислота-слабое основание, например: 2NH4OH + H2S = (NH4)2S + 2H2O Pеакции осаждения - обменное взаимодействие между веществами в растворе с выделением осадка (труднорастворимого вещества).
