
- •1. Микробиология, ее роль и значение. Краткий исторический очерк развития мб. Место прокариот в эволюции. Отличительные признаки эукариот и прокариот.
- •2. Морфологические и тинкториальные свойства бактерий. Методы окраски. Методы микроскопии.
- •3. Ультраструктура и химический состав бактериальной клетки. Особенности строения грамположительных и грамотрицательных бактерий.
- •4. Подвижность бактерий. Методы определения подвижности. Споры и процесс спорообразования.
- •5. Размножение и рост бактерий. Кривая роста, основные фазы.
- •6. Морфология грибов. Классификация. Распространение и роль в природе.
- •7. Цианобактерии. Классификация. Распространение и роль в природе.
- •8. М/о и окружающая среда. Влажность, температура, кислотность среды, влияние кислорода, гидростатическое давление, хим. Факторы, радиация (излучение).
- •Влажность
- •Химические факторы
- •Биологические факторы
- •9. Потребности прокариот в пит.Веществах. Факторы роста микроорганизмов. Способы и типы питания. Поступление пит.Веществ в клетку. Обмен веществ между клеткой и средой.
- •10. Основные понятия культивирования бактерий. Искусственные питательные среды, их классификация. Требования, предъявляемые к питательным средам.
- •11. Принципы и методы выделения чистых культур бактерий. Идентификация бактерий, основные этапы.
- •12.Действие физических и химических факторов на микроорганизмы. Понятие о стерилизации, дезинфекции, асептике и антисептике. Способы стерилизации, аппаратура.
- •14. Универсальные формы энергии бактериальной клетки. Субстратное и мембранозависимое фосфорилирование.
- •15. Способы получения энергии бактериями (дыхание, брожение). Методы культивирования анаэробов.
- •16. Культивирование аэробов. Периодическое и непрерывное культивирование.
- •17. Энергетический и конструктивный метаболизм. Понятие о катаболизме и биосинтезе. Общая характеристика.
- •19. Фототрофные прокариотные и эукариотные микроорганизмы. Биосинтетические процессы, ассимиляция углекислоты. Значение цикла трикарбоновых кислот и глиоксилатного шунта.
- •20. Типы брожений: молочнокислое и спиртовое брожение. Роль в природе и значение в промышленности.
- •21. Маслянокислое брожение.
- •22. Пропионовокислое и муравьинокислое брожение.
- •23. Бактериологическое исследование различных объектов.
- •24. Генотип и фенотип микроорганизмов. Изменчивость микроорганизмов. Модификации, мутации, диссоциации бактерий.
- •25. Антибиотики: классификация по источнику получения, способу получения. Классификация по химической структуре, по механизму и спектру действий.
- •27. Методы культивирования вирусов.
- •28. Типы взаимодействия вируса с клеткой. Фазы репродукции вирусов.
- •29. Бактериофаги. Взаимодействие фага с бактериальной клеткой. Умеренные и вирулентные бактериофаги. Лизогения, применение фагов в медицине и биотехнологии.
- •30. Строение генома бактерий. Особенности репликации бактериальной хромосомы. Механизмы передачи генетического материала у бактерий.
- •31. Плазмиды бактерий, их функции и свойства. Использование плазмид в генной инженерии.
- •33. Роль микроорганизмов в круговороте углерода.
- •34. Роль микроорганизмов в круговороте азота.
- •35. Взаимоотношение микроорганизмов. Антагонизм, нейтрализм, симбиоз.
- •36. Симбиотическая и не симбиотическая азотфиксация.
- •37. Процессы нитрификации и денитрификации.
- •38. Роль микроорганизмов в циклах серы и железа.
- •39. Микрофлора воздуха.
- •40. Микрофлора воды.
- •41. Микрофлора почвы.
- •42. Систематика м/о. Группа 1. Спирохеты. Группа 2. Аэробные, вибриоидные, грамотрицательные бактерии.
- •43. Группа 3. Неподвижные грамотрицательные изогнутые бактерии.
- •44.Группа 4. Грамотрицательные аэробные палочки и кокки.
- •46.Группа 6. Анаэробные грамотрицательные прямые, изогнутые или спиралевидные палочки.
- •47.Группа 8. Анаэробные грамотрицательные кокки.
- •48. Группа 9. Риккетсии и хламидии.
- •49. Группа 10. Аноксигенные фототрофные бактерии.
- •50. Группа 12 Аэробные хемолитотрофные бактерии и близкие организмы
- •51. Группа 13. Почкующиеся и/или образующие выросты бактерии
- •52. Группа 14. Бактерии, имеющие чехлы
- •53. Группа 15. Нефотосинтезирующие скользящие бактерии, не образующие плодовых тел.
- •54. Группа 16. Скользящие бактерии, образующие плодовые тела
- •55. Группа 17. Грамположительные кокки
- •56. Группа 18. Образующие эндоспоры грамположительные палочки и кокки
- •57. Группа 19. Не образующие спор грамположительные палочки правильной формы.
- •58. Группа 20. Не образующие спор грамположительные палочки неправильной формы.
- •59. Группа 21. Почкующиеся и/или стебельковые бактерии.
- •60. Группы 22-29. Актиномицеты.
- •61. Группа 30. Микоплазмы.
12.Действие физических и химических факторов на микроорганизмы. Понятие о стерилизации, дезинфекции, асептике и антисептике. Способы стерилизации, аппаратура.
Влияние физических факторов. Влияние температуры. Различные группы микроорганизмов развиваются при определенных диапазонах температур. Бактерии, растущие при низкой температуре, называют психрофилами, при средней (около 37 °С) — мезофилами, при высокой — термофилами. К психрофильным микроорганизмам относится большая группа сапрофитов — обитателей почвы, морей, пресных водоемов и сточных вод (железобактерии, псевдомонады, светящиеся бактерии, бациллы). Некоторые из них могут вызывать порчу продуктов питания на холоде. Способностью расти при низких температурах обладают и некоторые патогенные бактерии (возбудитель псевдотуберкулеза размножается при температуре 4 °С). В зависимости от температуры культивирования свойства бактерий меняются. Интервал температур, при котором возможен рост психрофильных бактерий, колеблется от -10 до 40 °С, а температурный оптимум — от 15 до 40 °С, приближаясь к температурному оптимуму мезофильных бактерий. Мезофилы включают основную группу патогенных и условно-патогенных бактерий. Они растут в диапазоне температур 10— 47 °С; оптимум роста для большинства из них 37 °С. При более высоких температурах (от 40 до 90 °С) развиваются термофильные бактерии. На дне океана в горячих сульфидных водах живут бактерии, развивающиеся при температуре 250—300 °С и давлении 262 атм. Термофилы обитают в горячих источниках, участвуют в процессах самонагревания навоза, зерна, сена. Наличие большого количества термофилов в почве свидетельствует о ее загрязненности навозом и компостом. Поскольку навоз наиболее богат термофилами, их рассматривают как показатель загрязненности почвы. Хорошо выдерживают микроорганизмы действие низких температур. Поэтому их можно долго хранить в замороженном состоянии, в том числе при температуре жидкого газа (—173 °С). Высушивание. Обезвоживание вызывает нарушение функций большинства микроорганизмов. Наиболее чувствительны к высушиванию патогенные микроорганизмы (возбудители гонореи, менингита, холеры, брюшного тифа, дизентерии и др.). Более устойчивыми являются микроорганизмы, защищенные слизью мокроты. Высушивание под вакуумом из замороженного состояния — лиофилизацию — используют для продления жизнеспособности, консервирования микроорганизмов. Лиофилизированные культуры микроорганизмов и иммунобиологические препараты длительно (в течение нескольких лет) сохраняются, не изменяя своих первоначальных свойств. Действие излучения. Неионизирующее излучение — ультрафиолетовые и инфракрасные лучи солнечного света, а также ионизирующее излучение — гамма-излучение радиоактивных веществ и электроны высоких энергий губительно действуют на микроорганизмы через короткий промежуток времени. УФ-лучи применяют для обеззараживания воздуха и различных предметов в больницах, родильных домах, микробиологических лабораториях. С этой целью используют бактерицидные лампы УФ-излучения с длиной волны 200—450 нм. Ионизирующее излучение применяют для стерилизации одноразовой пластиковой микробиологической посуды, питательных сред, перевязочных материалов, лекарственных препаратов и др. Однако имеются бактерии, устойчивые к действию ионизирующих излучений, например Micrococcusradiodurans была выделена из ядерного реактора. Действие химических веществ. Химические вещества могут оказывать различное действие на микроорганизмы: служить источниками питания; не оказывать какого-либо влияния; стимулировать или подавлять рост. Химические вещества, уничтожающие микроорганизмы в окружающей среде, называются дезинфицирующими. Антимикробные химические вещества могут обладать бактерицидным, вирулицидным, фунгицидным действием и т.д. Химические вещества, используемые для дезинфекции, относятся к различным группам, среди которых наиболее широко представлены вещества, относящиеся к хлор-, йод- и бромсодержащим соединениям и окислителям. Антимикробным действием обладают также кислоты и их соли (оксолиновая, салициловая, борная); щелочи (аммиак и его соли). Стерилизация – предполагает полную инактивацию микробов в объектах, подвергшихся обработке. Дезинфекция — процедура, предусматривающая обработку загрязненного микробами предмета с целью их уничтожения до такой степени, чтобы они не смогли вызвать инфекцию при использовании данного предмета. Как правило, при дезинфекции погибает большая часть микробов (в том числе все патогенные), однако споры и некоторые резистентные вирусы могут остаться в жизнеспособном состоянии. Асептика – комплекс мер, направленных на предупреждение попадания возбудителя инфекции в рану, органы больного при операциях, лечебных и диагностических процедурах. Методы асептики применяют для борьбы с экзогенной инфекцией, источниками которой являются больные и бактерионосители. Антисептика – совокупность мер, направленных на уничтожение микробов в ране, патологическом очаге или организме в целом, на предупреждение или ликвидацию воспалительного процесса.
Стерилизация предполагает полную инактивацию микробов в объектах, подвергающихся обработке. Существует три основных метода стерилизации: тепловой, лучевой, химической. Тепловая стерилизацияоснована на чувствительности микробов к высокой температуре. При 60оС и наличии воды происходит денатурация белка, деградация нуклеиновых кислот, липидов, вследствие чего вегетативные формы микробов погибают. Споры, содержащие очень большое количество воды в связанном состоянии и обладающие плотными оболочками, инактивируются при 160—170 °С. Для тепловой стерилизации применяют, в основном, сухой жар и пар под давлением. Стерилизацию сухим жаром осуществляют в воздушных стерилизаторах (прежнее название — «сухожаровые шкафы» или «печи Пастера»). Воздушный стерилизатор представляет собой металлический плотно закрывающийся шкаф, нагревающийся с помощью электричества и снабженный термометром. Обеззараживание материала в нем производят, как правило, при 160°С в течение 120 мин. Однако возможны и другие режимы: 200 °С - 30 мин, 180 °С - 40 мин. Стерилизуют сухим жаром лабораторную посуду и другие изделия из стекла, инструменты, силиконовую резину, т. е. объекты, которые не теряют своих качеств при высокой температуре. Большая часть стерилизуемых предметов не выдерживает подобной обработки, и поэтому их обеззараживают в паровых стерилизаторах. Обработка паром под давлением в паровых стерилизаторах (старое название — «автоклавы») является наиболее универсальным методом стерилизации. Паровой стерилизатор (существует множество его модификаций) — металлический цилиндр с прочными стенками, герметически закрывающийся, состоящий из водопаровой и стерилизующей камер. Аппарат снабжен манометром, термометром и другими контрольно-измерительными приборами. В автоклаве создается повышенное давление, что приводит к увеличению температуры кипения. Поскольку кроме высокой температуры на микробы оказывает воздействие и пар, споры погибают уже при 120 °С. Наиболее распространенный режим работы парового стерилизатора: 2 атм. — 121 °С — 15—20 мин. Время стерилизации уменьшается при повышении атмосферного давления, а следовательно, и температуры кипения (136 °С — 5 мин). Микробы погибают за несколько секунд, но обработку материала производят в течение большего времени, так как, во-первых, высокая температура должна быть и внутри стерилизуемого материала и, во-вторых, существует так называемое поле безопасности (рассчитанное на небольшую неисправность автоклава). Стерилизуют в автоклаве большую часть предметов: перевязочный материал, белье, коррозионно-устойчивые металлические инструменты, питательные среды, растворы, инфекционный материал и т. д. Одной из разновидностей тепловой стерилизации является дробная стерилизация, которую применяют для обработки материалов, не выдерживающих температуру выше 100 °С, например, для стерилизации питательных сред с углеводами, желатина. Их нагревают в водяной бане при 80 °С в течение 30—60 мин. В настоящее время применяют еще один метод тепловой стерилизации, предназначенный специально для молока — ультравысокотемпературный (УВТ): молоко обрабатывают в течение нескольких секунд при 130—150 °С. Химическая стерилизацияпредполагает использование токсичных газов: оксида этилена, смеси ОБ (смеси оксида этилена и бромистого метила в весовом соотношении 1:2,5) и формальдегида. Эти вещества являются алкилирующими агентами, их способность в присутствии воды инактивировать активные группы в ферментах, других белках, ДНК и РНК приводит к гибели микроорганизмов. Стерилизация газами осуществляется в присутствии пара при температуре от 18 до 80 °С в специальных камерах. В больницах используют формальдегид, в промышленных условиях — оксид этилена и смесь ОБ. Перед химической стерилизацией все изделия, подлежащие обработке, должны быть высушены. Этот вид стерилизации небезопасен для персонала, для окружающей среды и для пациентов, пользующихся простерилизованными предметами (большинство стерилизующих агентов остается на предметах). Однако существуют объекты, которые могут быть повреждены нагреванием, например, оптические приборы, радио- и электронная аппаратура, предметы из нетермостойких полимеров, питательные среды с белком и т. п., для которых пригодна только химическая стерилизация. Например, космические корабли и спутники, укомплектованные точной аппаратурой, для их деконтаминации обезвреживают газовой смесью (оксид этилена и бромистого метила). В последнее время в связи с широким распространением в медицинской практике изделий из термолабильных материалов, снабженных оптическими устройствами, например эндоскопов, стали применять обезвреживание с помощью химических растворов. После очистки и дезинфекции прибор помещают на определенное время (от 45 до 60 мин) в стерилизующий раствор, затем прибор должен быть отмыт стерильной водой. Для стерилизации и отмывки используют стерильные емкости с крышками. Простерилизованное и отмытое от стерилизующего раствора изделие высушивают стерильными салфетками и помещают в стерильную емкость. Все манипуляции проводят в асептических условиях и в стерильных перчатках. Хранят эти изделия не более 3 суток. Лучевая стерилизацияосуществляется либо с помощью гамма-излучения, либо с помощью ускоренных электронов. Лучевая стерилизация является альтернативой газовой стерилизации в промышленных условиях, и применяют ее также в тех случаях, когда стерилизуемые предметы не выдерживают высокой температуры. Лучевая стерилизация позволяет обрабатывать сразу большое количество предметов (например, одноразовых шприцев, систем для переливания крови). Благодаря возможности широкомасштабной стерилизации, применение этого метода вполне оправданно, несмотря на его экологическую опасность и неэкономичность. Еще одним способом стерилизации является фильтрование. Фильтрование с помощью различных фильтров (керамических, асбестовых, стеклянных), а в особенности мембранных ультрафильтров из коллоидных растворов нитроцеллюлозы или других веществ позволяет освободить жидкости (сыворотку крови, лекарства) от бактерий, грибов, простейших и даже вирусов. Для ускорения процесса фильтрации обычно создают повышенное давление в емкости с фильтруемой жидкостью или пониженное давление в емкости с фильтратом. В настоящее время все более широкое применение находят современные методы стерилизации, созданные на основе новых технологий, с использованием плазмы, озона.
13. Рост микроорганизмов в зависимости от температуры, активности воды, кислотности среды. Устойчивость микроорганизмов к высушиванию. Отношение микроорганизмов к молекулярному кислороду: аэробы и анаэробы.
Треугольник зависимости скорости роста от температуры неравнобедренный (рис. 26): скорость снижается медленно при понижении температуры, а при повышении вскоре после достижения наивысшей скорости роста резко срывается, и наступает гибель клеток при температуре, обозначаемой как максимальная. Диапазон между максимальной и минимальной температурами обычно составляет 20-30 °С. Оптимум зависимости от температуры располагается ближе к максимуму.
Однако различают стенотермные и эвритермные организмы; первые имеют узкий температурный диапазон, а вторые — широкий, причем способны приспосабливаться к изменению температуры. Возрастание скорости роста от температуры обозначается как Ql0 — возрастание скорости реакции при увеличении температуры на 10 °С. Обычно эта величина близка значению 2. Определяющими для скорости роста могут служить разные реакции, среди которых можно выделить лимитирующие. Для ферментов и ферментных систем максимальные скорости наблюдаются обычно несколько выше оптимума роста. Ограничивающими служат сложные процессы: при максимальной температуре происходит денатурация белков, минимум приписывается сгущению мембранных липидов и зависит от содержания в них ненасыщенных кислот. Очевидно, что действию температуры подвергаются все системы клетки и решающей оказывается наиболее чувствительная.
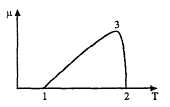
Рис. 26. Зависимость роста микроорганизмов от температуры. Кардинальные точки
1 — минимум; 2 — максимум; 3 — оптимум; ц — скорость роста
Активность воды (aw) — это отношение давления паров воды над данным
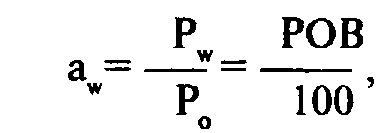
где Pw — давление водяного пара в системе пищевого продукта; Ро — давление пара чистой воды; РОВ — относительная влажность в состоянии равновесия, при которой продукт не впитывает влагу и не теряет ее в атмосферу, %.
Активность воды может быть измерена и использована для оценки состояния воды в пищевых продуктах и ее причастности к химическим и биохимическим изменениям По величине активности воды выделяют: продукты с высокой влажностью (aw= 1,0—0,9); продукты с промежуточной влажностью (aw = 0,9—0,6); продукты с низкой влажностью (aw = 0,6—0,0).
Стабильность пищевых продуктов и активность воды тесно связаны.
В продуктах с низкой влажностью могут происходить окисление жиров, неферментативное потемнение, потеря водорастворимых веществ (витаминов), порча, вызванная ферментами. Активность микроорганизмов здесь подавлена. При хранении пищевых продуктов активность воды оказывает влияние на жизнеспособность микроорганизмов. Поэтому активность воды в продукте имеет значение для предотвращения его микробиологической порчи.
Для большинства химических реакций большая или максимальная скорость имеет место, как правило, в области aw, характерной для продуктов с промежуточной влажностью (0,7-0,9).
Ферментативные реакции могут протекать при более высоком содержании влаги, чем влага монослоя, т.е. тогда, когда есть свободная вода. Она необходима для переноса субстрата.
Продукты с содержанием aw=1,0 – 0,9 –это продукты с высокой влажностью, они доступны жизнедеятельности всех групп микроорганизмов, не стойки при хранении, к ним относится большинтво пищевых продуктов.
Для большинства бактерий предельное значения aw=0,9, но, например, для St. aureus aw= 0,86. Дрожжи и плесени могут расти при более низких значениях активности воды.
Продукты с промежуточной влажностью (aw = 0,9—0,6). В основном порчу продуктов с промежуточной влажностью вызывают дрожжи и плесени, меньше — бактерии. Дрожжи вызывают порчу сиропов, кондитерских изделий, джемов, паст, сгущенных продуктов; плесени — мяса, джемов, пирожных, печенья, сушеных фруктов.
Продукты с низкой влажностью (aw = 0,6—0,0) – как правило, сухие, не доступны для микроорганизмов, но в них могут проходить реакции не ферментативного потемнения. Снижает аw такие технологические операции как сушка, замораживание, вяление, добавление таких веществ, как соль, сахар и специальные увлажнители (крахмал, глицерин, молочная кислота), которые увеличивают влажность, не изменяя aw.
Помимо влияния на химические реакции и рост микроорганизмов, активность воды имеет значение и для текстуры продуктов. Например, максимальная активность воды, допустимая в сухих продуктах без потери желаемых свойств, может изменяться в пределах 0,35—0,5 в зависимости от вида продукта (сухое молоко, крекеры, и т.п.).
Жизнедеятельность микроорганизмов зависит от концентрации водородных (Н+) или гидроксильных (ОН-) ионов в субстрате, на котором они развиваются. Для большинства бактерий наиболее благоприятна нейтральная (рН около 7) или слабощелочная среда. Плесневые грибы и дрожжи хорошо растут при слабокислой реакции среды. Высокая кислотность среды (рН ниже 4,0) препятствует развитию бактерий, однако плесени могут продолжать расти и в более кислой среде. Подавление роста гнилостных микроорганизмов при подкислении среды имеет практическое применение. Добавление уксусной кислоты используется при мариновании продуктов, что препятствует процессам гниения и позволяет сохранить продукты. Образующаяся при квашении молочная кислота также подавляет рост гнилостных бактерий.
Вся жизнедеятельность микробной клетки связана с наличием в среде влаги. Высушивание, приводящее к обезвоживанию клетки, действует губительно на микробы. Скорость отмирания под влиянием высушивания различная у различных видов микробов: так, у холерного вибриона - до двух суток, у дифтерийной палочки - до тридцати дней брюшнотифозной палочки - до семидесяти дней, у туберкулезной палочки и стафилококка - до девяноста дней. К весьма чувствительным к высушиванию относятся нитрифицирующие, клубеньковые бактерии, азотобактер. Оптимальной для них является влажность почвы 40-80% полной влагоемкости. Более устойчивы к высушиванию сапрофиты. Хорошо переносят высушивание молочнокислые бактерии, дрожжи (годами). Очень устойчивы к высушиванию споры бактерий, ибо вода в них находится в связанном состоянии. Они могут сохраняться высушенными до сотни лет. Споры разных грибов также очень устойчивы. В высушенном состоянии микробы не проявляют жизнедеятельности заметным образом, но биологические их свойства сохраняются.
Такое действие высушивания на микробы широко использовано для консервирования различных продуктов. Сушке подвергают рыбу, мясо, фрукты, овощи, грибы, траву на сено, лекарственные травы. При малом содержании воды в субстрате микробная клетка не может поглощать из него воду и не развивается. При влажности пищевого продукта ниже 30% от полной влагоемкости развитие бактерий приостанавливается, а ниже 15% приостанавливается развитие грибов. Но в этих условиях жизнь многих микробов все же сохраняется долгое время, и при достаточном увлажнении активность их восстанавливается, что может привести к порче продукта.
Устойчивость к высушиванию в настоящее время искусственно повышают. Для этого высушивание производят при низкой температуре путем замораживания в безвоздушном пространстве. Высушенные таким образом микробы остаются жизнеспособными в течение ряда месяцев, лет без изменения их биологических свойств. Так сохраняются культуры микробов, живые ослабленные вакцины, фаги.
Кислород широко распространен в природе, находясь как в связанном, так и свободном состоянии. В первом случае он входит в состав молекул воды, органических и неорганических соединений. Во втором - присутствует в современной атмосфере в виде молекулярного кислорода (О2), объемная доля которого составляет 21%.
Кислород является обязательным химическим компонентом любой клетки. Подавляющее большинство организмов удовлетворяет свои потребности в этом элементе, используя обе формы кислорода. При выращивании Pseudomonas в присутствии 18О2 и Н218О источником приблизительно 10% кислорода, входящего в состав клеточного материала, служил газообразный кислород, 50-60% клеточного кислорода происходило из воды. Остальной кислород в клетку поставляли органические и неорганические компоненты питательной среды (глюкоза, фосфаты, нитраты, сульфаты и др.).
Среди прокариот существуют значительные различия в отношении к молекулярному кислороду. По этому признаку они могут быть разделены на несколько групп ( рис. 34 ). Прокариоты, для роста которых О2 необходим, называют облигатными (обязательными) аэробами. К ним относится большинство прокариотных организмов. Среди облигатных аэробов обнаружены существенные различия в отношении к уровню молекулярного кислорода в среде. Некоторые представители этой группы не способны к росту при концентрации О2, равной атмосферной, но могут расти, если содержание О2 в окружающей среде будет значительно ниже (порядка 2%). Такие облигатно аэробные прокариоты получили название микроаэрофилов .
Потребность прокариот в низкой концентрации О2 в окружающей среде связана с их метаболическими особенностями. Многие аэробные азотфиксирующие бактерии могут расти в среде с молекулярным азотом только при концентрации О2 ниже 2%, т.е. как микроаэрофилы, а в присутствии связанного азота, например аммонийного, - на воздухе. Это объясняется ингибирующим действием молекулярного кислорода на активность нитрогеназы - ферментного комплекса, ответственного за фиксацию N2.
Аналогичная картина обнаружена у многих водородокисляющих бактерий. На среде с органическими соединениями в качестве источника энергии они хорошо растут при атмосферном содержании О2. Если источником энергии является окисление молекулярного водорода, эти же бактерии для роста требуют низкой концентрации О2. Последнее связывают с инактивацией молекулярным кислородом гидрогеназы - фермента, катализирующего использование Н2.
Наконец, среди облигатных аэробов существуют значительные различия в устойчивости к высоким уровням О2 в среде. 100%-й молекулярный кислород подавляет рост всех облигатных аэробов. Многие аэробные бактерии могут формировать колонии на поверхности твердой питательной среды в атмосфере, содержащей 40% О2, но рост их прекращается, когда содержание О2 в атмосфере повышается до 50%.
Известны прокариоты, для метаболизма которых О2 не нужен, т. е. энергетические и конструктивные процессы у них происходят без участия молекулярного кислорода. Такие организмы получили название облигатных анаэробов . К ним относятся метанобразующиеархебактерии , сульфатвосстанавливающие, маслянокислые и некоторые другие эубактерии . До сравнительно недавнего времени считали, что облигатные анаэробы могут получать энергию только в процессе брожения. В настоящее время известно много облигатно анаэробных прокариот, которые произошли от аэробов в результате вторичного приспособления к анаэробным условиям, приведшего к потере способности использовать О2 в качестве конечного акцептора электронов в процессе дыхания. Такие облигатные анаэробы получают энергию в процессах анаэробного дыхания, т.е. переноса электронов по цепи переносчиков на СО2, SO4--, фумарат и другие акцепторы.
В ряду облигатно анаэробных прокариот, не включающих O2 в метаболические реакции, существует широкий спектр степени устойчивости к молекулярному кислороду, находящемуся во внешней среде. Многие из облигатных анаэробов не выносят присутствия даже незначительных количеств молекулярного кислорода в среде и быстро погибают. Такие организмы называютстрогими анаэробами . К числу строгих анаэробов относятся представители родов Bacteroides , Fusobacterium , Butyrivibrio ,Methanobacterium и др.
Маслянокислые бактерии относятся также к группе облигатных анаэробов, но среди них есть виды, умеренно ( Clostridium tetani ,Сlostridium carnis , Сlostridium tertium , Сlostridium sporogenes ) или достаточно высоко ( Сlostridium perfringens , Сlostridium acetobutylicum ) толерантные к О2.
Наконец, молочнокислые бактерии, обладающие метаболизмом только анаэробного типа, могут расти в присутствии воздуха и выделены в отдельную группу аэротолерантных анаэробов . (Некоторые авторы относят молочнокислые бактерии рода Lactobacillus к микроаэрофилам на том основании, что в их клетках содержатся флавопротеины , катализирующие перенос электронов с НАД*Н2 на О2. Однако этот процесс не связан с получением клеткой энергии).
Хотя облигатно анаэробные бактерии в целом очень чувствительны к О2, они могут в природе находиться в аэробных зонах. Широкое распространение представителей рода Clostridium в местах с высоким парциальным давлением О2 объясняется наличием у них эндоспор, не чувствительных к молекулярному кислороду. Однако и многие не образующие спор строго анаэробные прокариотыобнаружены в природе в местах, где наблюдается активное развитие облигатных аэробов. Вероятно, совместное развитие с облигатными аэробами, активно потребляющими молекулярный кислород, приводящее к образованию зон с низкой концентрацией 02, создает возможности и для развития строго анаэробных видов.
Описаны прокариотные организмы, которые могут расти как в аэробных, так и в анаэробных условиях. Изучение этого явления показало, что природа его различна. Бактерии, не нуждающиеся в О2 (последний не участвует в осуществляемых ими метаболических реакциях), но способные расти в его присутствии, являются по типу осуществляемого ими метаболизмаоблигатными анаэробами , устойчивыми к О2 внешней среды. Примером таких организмов служат молочнокислые бактерии. Многие прокариоты, относящиеся к этой же группе, приспособились в зависимости от наличия или отсутствия О2 в среде переключаться с одного метаболического пути на другой, например с дыхания на брожение, и наоборот. Такие организмы получили название факультативных анаэробов, или факультативных аэробов . Представителями этой физиологической группы прокариот являются энтеробактерии . В аэробных условиях они получают энергию в процессе дыхания. (Среди факультативных анаэробов в условиях осуществления ими метаболизма аэробного типа также могут быть микроаэрофилы ). В анаэробных условиях источником энергии для них служат процессы брожения или анаэробного дыхания.
Потребность в О2 у аэробов определяется его участием в энергетических и конструктивных процессах. В первом случае О2 служит обязательным конечным акцептором электронов, во втором - участвует в реакциях (или единственной реакции) на пути многоступенчатого преобразования клеточных метаболитов или экзогенных субстратов. У облигатных аэробов большая часть О2 используется в качестве конечного акцептора электронов в реакциях, катализируемых цитохромоксидазами. Меньшая часть включается в молекулы с помощью ферментов, получивших общее название оксигеназ. В клетках факультативных анаэробов также содержатся цитохромоксидазы. У облигатных анаэробов нет ферментов, катализирующих взаимодействие с О2.
