
- •Введение
- •1. Физическая природа свойств твёрдых тел
- •1.1. Основные материалы микроэлектроники
- •2. Фазовые диаграммы и твердые растворы
- •2.1. Типы фазовых диаграмм
- •2.2. Системы, имеющие важное значение в микроэлектронике
- •2.3. Твердая растворимость
- •2.4. Задачи
- •2.5. Фазовые переходы
- •2.6. Термодинамические диаграммы
- •2.6.1. Диаграмма состояния (диаграмма равновесия, фазовая диаграмма)
- •2.6.2. Растворимость
- •2.6.3. Международная система единиц си (метр, килограмм, секунда, градус, Кельвин, моль)
- •2.6.4. Метод построения диаграмм состояния
- •2.6.5. Системы с ограниченной взаимной растворимостью компонентов в твердом состоянии
- •3. Структура твердотельных интегральных микросхем
- •3.1. Введение
- •3.1.1. Основные понятия и определения
- •3.2. Технология полупроводниковых интегральных микросхем
- •3.2.1. Общая характеристика технологического процесса
- •4. Диффузионные процессы в твердых телах
- •4.1. Введение
- •4.2. Законы диффузии
- •4.3. Основы кинетической теории газов
- •4.4. Диффузия как двухстадийный процесс
- •4.5. Диффузия в гетерогенном твердом теле
- •4.6. Техника проведения процессов диффузии
- •4.6.1. Диффузия из газовой фазы
- •4.6.2. Диффузия из жидкой фазы
- •4.6.3. Диффузия из твердой фазы
- •4.7. Способы проведения диффузии
- •5. Основы ионного легирования
- •5.1. Понятие о технологии ионного легирования
- •5.2. Оборудование для ионного легирования
- •5.3. Длина пробега ионов
- •5.4. Монокристалл
- •5.6. Синтез веществ с помощью ионного легирования
- •5.7. Отжиг легированных слоев
- •6. Технологические основы микроэлектроники
- •6.1. Введение
- •6.2. Подготовительные операции
- •6.3. Эпитаксия
- •6.4. Термическое окисление
- •6.5. Легирование
- •6.5.1. Способы диффузии
- •6.5.2. Теоретические основы диффузии
- •6.5.3. Ионная имплантация
- •6.6. Травление
- •6.7. Техника масок
- •6.7.1. Фотолитография
- •6.7.2. Фотошаблоны
- •8.7.3. Новые решения и тенденции
- •6.8. Нанесение тонких пленок
- •6.8.1. Термическое (вакуумное) напыление
- •6.8.2. Катодное напыление
- •6.8.3. Ионно–плазменное напыление
- •6.8.4. Анодирование
- •6.8.5. Электрохимическое осаждение
- •6.9. Металлизация
- •6.10. Сборочные операции
- •6.11. Технология тонкопленочных гибридных ис
- •6.11.1. Изготовление пассивных элементов
- •6.11.2. Монтаж навесных компонентов
- •6.12. Технология толстопленочных гибридных ис
- •Литература
4.3. Основы кинетической теории газов
В кинетической теории газов коэффициент диффузии определяется следующим выражением:
![]() ,
,
где
![]() –
длина свободного пробега, а
–
время между двумя столкновениями.
–
длина свободного пробега, а
–
время между двумя столкновениями.
Выражение для коэффициента диффузии в кристалле приобретает вид:
![]() ,
(4)
,
(4)
где
![]() –
множитель, учитывающий геометрию решетки
и механизм диффузии.
–
множитель, учитывающий геометрию решетки
и механизм диффузии.
На основании (3) и (4) получим выражение коэффициента диффузии в кристалле:
![]() ,
,
где
![]() .
.
В этой формуле – называют энергией активации (энергию, которую необходимо сообщить атому для единичного скачка в кристаллической решетке, называют энергией активации диффузии).
Примесные атомы, перемещаются по вакансионному механизму – называются примесями замещения, а перемещающиеся по междуузельному механизму – примесями внедрения.
Практически все диффузанты в полупроводниковых кристаллах имеют предельную растворимость. Под предельной растворимостью примеси подразумевается максимальная концентрация примесных атомов при данной температуре, которая может быть введена в полупроводник:
![]() ,
,
где
![]() – теплота растворения.
– теплота растворения.
В ряде случаев введение инородных атомов приводит к возникновению в диффузионной области новой фазы (химического соединения). Такой процесс получил название – реактивная диффузия (окисление кремния).
4.4. Диффузия как двухстадийный процесс
С помощью процесса диффузии осуществляют изменение свойств, а именно, электропроводности, диффузионной длины и времени жизни не основных носителей заряда в локальных областях полупроводникового материала.
Для формирования локальных областей в полупроводнике, как правило, используют двухстадийные диффузионные процессы. Первую стадию, соответствующую диффузии из неограниченного источника называют загонкой. Вторую стадию, соответствующую диффузии из ограниченного источника, созданного на первой стадии называют разгонкой.
Процессы диффузии осуществляются при повышенных температурах. В этом случае сопутствующим процессом является процесс окисления полупроводника. В частности, на поверхности кремния образуется пленка диоксида кремния (SiO2). Диоксид кремния обладает высокими маскирующими свойствами. При наличии на поверхности кремния слоя диоксида кремния при выполнении второй стадии диффузионного процесса – разгонки, поток диффузионных частиц через поверхность кремни будет отсутствовать. Если приписать поверхности кремния координату х=0, то для всех значений времени t можно записать:
![]()

 (1)
(1)
где
![]() –
концентрация примесных атомов.
–
концентрация примесных атомов.
Рассмотрим вторую стадию диффузионного процесса – разгонку. На первой стадии процесса – загонке получен диффузионный слой толщиной h. В первом приближении можно считать распределение примеси по толщине h постоянной. Тогда начальное условие для второй стадии процесса будет иметь вид:
|
при
|
|
при
|
(2) |
Второй закон Фика для диффузии имеет вид:
![]() .
(3)
.
(3)
Решив (3), для граничного (1) и начального (2) условий получим:
![]() .
(4)
.
(4)
Это уравнение описывает диффузию из бесконечно тонкого слоя h в полубесконечное тело. Бесконечно тонкий слой обычно характеризуют отнесенным к единице поверхности полным количеством атомов примеси Q, находящимся в слое в начальный момент времени.
Условие (1) говорит о
том, что количество примеси Q
в течении всего диффузионного процесса
сохраняется постоянным, т. е. в слое
толщиной h
оно уменьшается, а в остальном объеме
полупроводника увеличивается. Диффузионное
распределение в бесконечно тонком слое
h
определяется с использованием уравнения
(4). Подставим в него Ns=Q/h
и перейдем к пределу в правой части при
![]() ,
т. е.
,
т. е.
 .
(5)
.
(5)
Поверхностную концентрацию атомов при х=0 для такого распределения получим в виде:
![]() .
(6)
.
(6)
В общем случае Q не является постоянной величиной. Однако можно считать, что в течении второй стадии диффузии у поверхности кремниевой пластины образуется существенно планарный источник и распределение атомов примеси подчиняется закону Гаусса:
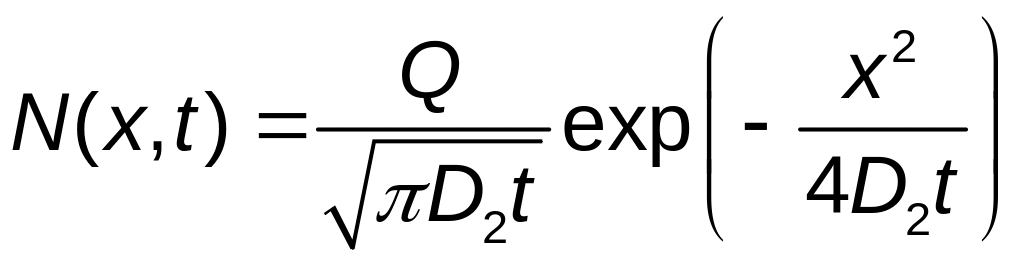 ,
(7)
,
(7)
где D2 – коэффициент диффузии на второй стадии диффузионного процесса – загонке;
Q – количество введенных на стадии загонки атомов примеси, отнесенное к единице поверхности;
t – длительность разгонки.
Определим Q из первого закона Фика. На первой стадии диффузионного процесса – загонке атомы примеси распределены по закону:
![]() .
(8)
.
(8)
Поток диффундирующих атомов через единицу поверхности на первой стадии имеет вид:
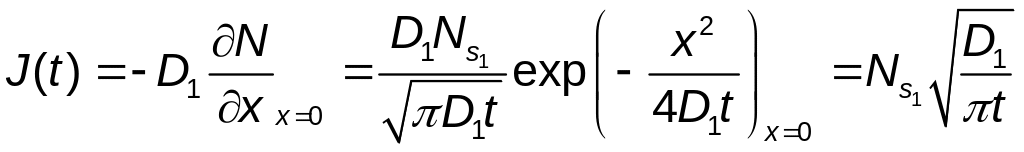

 ,
(9)
,
(9)
где D1 – коэффициент диффузии атомов примеси на первой стадии;
Ns1 – поверхностная концентрация атомов, диффудирующих на этой стадии.
Проинтегрировав (9) по времени в пределах от 0 до t1 получим:
![]() ,
(10)
,
(10)
где t1 – длительность стадии загонки.
В результате закон распределения атомов примет на второй стадии диффузионного процесса примет вид:
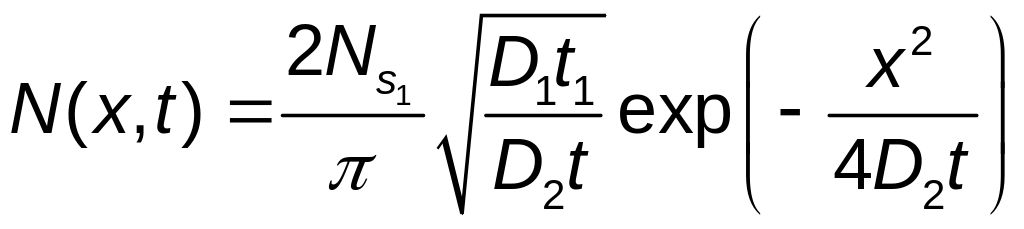 .
(11)
.
(11)
На основании (11) определим поверхностную концентрацию примеси на стадии разгонки:
 .
(12)
.
(12)
При
![]() поверхностная
концентрация атомов неограниченно
возрастает, в то время как она не может
превысить поверхностную концентрацию
атомов из стадии загонки Ns1,
т.е. это выражение справедливо при
больших временах второй стадии процесса.
поверхностная
концентрация атомов неограниченно
возрастает, в то время как она не может
превысить поверхностную концентрацию
атомов из стадии загонки Ns1,
т.е. это выражение справедливо при
больших временах второй стадии процесса.
Для процессов разгонки малой длительности необходимо исходить из приумножения, что диффузия осуществляется из ограниченного источника конечной толщины h с однородной концентрацией слоя Ns1 на стадии загонки. В этом случае полное количество атомов примеси на единицу поверхности примет вид:
![]() .
(13)
.
(13)
Сравнивая (13) и (10), определим эффективную ширину диффузионного слоя на стадии разгонки:
![]() .
(14)
.
(14)
С использованием (14) на основании (4) получим:
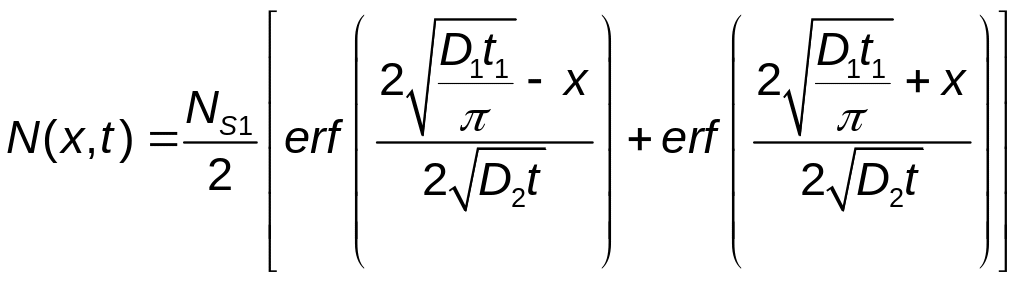 .
(15)
.
(15)
Откуда определим поверхностную концентрацию диффузирующих атомов на стадии разгонки:
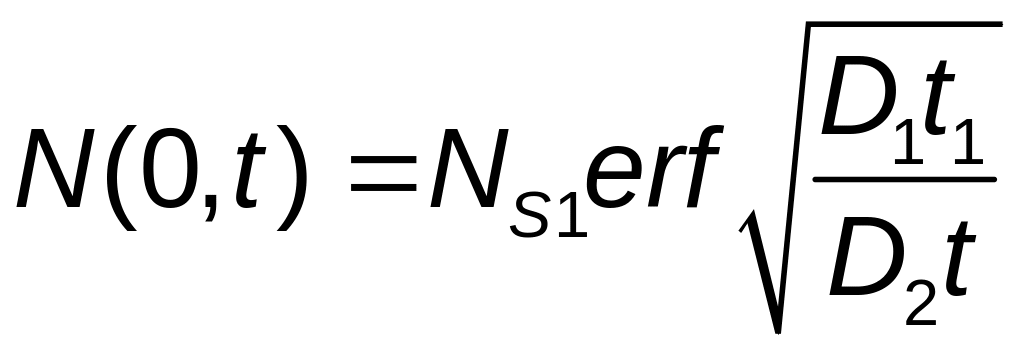 .
(16)
.
(16)
N(0, t) при t→0 показывает, что поверхностная концентрация в начале стадии разгонки равна поверхностной концентрации на стадии загонки:
![]() .
(17)
.
(17)
Значение этой величины равно поверхностной концентрации в начале диффузионного процесса и не устремляется в бесконечность, как это наблюдалось в случае планарного источника (6).


