
- •1. Методика изучения основных понятий молекулярной теории строения вещества в 6 классе.
- •2. Методика изучения кинематики в теме «Механическое движение и взаимодействие тел» курса физики 7 класса.
- •3. Методика изучения инерции и понятия массы тела в курсе физики 7 класса.
- •4. Методика формирования понятия силы. Изучение силы тяжести, упругости, трения в курсе физики 7 класса.
- •5. Методика формирования понятия давления. Изучение закона Паскаля и гидростатического давления.
- •6. Методика изучения атмосферного давления в курсе физики 7 класса.
- •7. Методика изучения архимедовой силы и условия плавания тел в курсе физики 7 класса.
- •10. Методика изучения электростатики и строения атома в теме «Электромагнитные явления» курса физики 8 класса.
- •9. Методика изучения фазовых переходов в курсе физики 8 класса.
- •11. Методика изучения электрического тока в курсе физики 8 класса.
- •12. Методика изучения магнитных явлений в курсе физики 8 класса.
- •13.Методика изучения световых явлений в курсе физики 8 класса.
- •14. Анализ структуры и содержания раздела «Механика». Методика введения понятий о системе отсчета, векторе перемещения, скорости и ускорении.
- •21. Научно-методический анализ понятия энергии, изучение кинетической энергии и закона сохранения полной механической энергии в 9 классе.
- •19. Научно-методический анализ и методика формирования понятия работы в 9 классе.
- •16. Методика изучения законов Ньютона.
- •18. Изучение понятия импульса и закона сохранения импульса.
9. Методика изучения фазовых переходов в курсе физики 8 класса.
Этапы урока по теме «Фазовые переходы»
I этап. На данном этапе учитель знакомит учащихся с понятием «фаза» как областью пространства, физические свойства которого одинаковы во всем объеме. Здесь и далее для эффективного включения механизмов воображения уместно «поэксплуатировать» воду.
II
этап. Учитель
предлагает учащимся начертить три
прямоугольника с названиями фаз
вещества, как это сделано на рисунке
1, предупредив их о необходимости
оставить над прямоугольниками место
в 4—5 строк (сам учитель делает данную
заготовку перед началом урока)![]()
Рис. 1
Далее учитель задает учащимся вопрос: «Из какой фазы в какую может переходить вещество, например вода?»
Характеристика |
Электрон |
Протон |
Нейтрон |
Год открытия |
1897 |
1919 |
1932 |
Первооткрыватель |
Джозеф Джон Томсон |
Эрнест Резерфорд |
Джеймс Чедвик |
Символ |
е– |
p+ |
no |
Масса:обозначение значение |
m (e–) 9,108. 10–31 кг |
m(p+) 1,673. 10–27 кг |
m(no) 1,675. 10–27 кг |
Электрический заряд |
–1,6. 10–19 Кл = –1е |
+1,6. 10–19 Кл = +1е |
0 |
Радиус |
? |
≈10–15 м |
≈10–15 м |
Не исключено, что кто-либо из учащихся добавит и еще два перехода: из твердой фазы — в газообразную; из газообразной фазы — в жидкую.
В таком случае следует обратиться к классу с вопросом: «Все ли согласны с возможностью осуществления двух последних переходов?»
Чаще всего в результате возникающей дискуссии учащиеся сами приходят к мнению о том, что, прежде чем превратиться в газ, твердое вещество, пусть на самое короткое время, должно перейти в жидкую фазу и т. д.
Если учащиеся все же не придут к такому мнению, учитель должен их подтолкнуть к нему посредством наводящих вопросов.
Далее учитель предлагает все «узаконенные» переходы обозначить на схеме стрелками (рис. 2).
![]()
Рис. 2
Теперь учащимся предлагается дать названия обозначенным фазовым переходам, начав с перехода вещества из твердой фазы в жидкую.
Зачастую учащиеся называют данный переход таянием (поскольку в качестве примера мы договорились использовать воду). Здесь следует напомнить учащимся, что на примере процессов, происходящих с водой, мы исследуем явления, которые могут происходить с самыми разными веществами. После такого напоминания учащиеся быстро дают данному переходу правильное название — «плавление».
Не вызывает затруднений и название перехода вещества из жидкой фазы в твердую — «испарение».
С оставшимися переходами может произойти заминка. Тем не менее следует дать возможность учащимся высказать свои версии, ни в коем случае не подвергая их резкой критике. В случаях, когда учащиеся предлагают названия, имеющие право на существование, но отличающиеся от общепринятых (например, можно услышать вместо «кристаллизация» — «отвердение»), следует заметить им, что мы все же не первооткрыватели и будем называть соответствующие переходы так, как это было принято до нас — «конденсация» и «кристаллизация».
Далее учащимся предлагается над стрелками, обозначающими фазовые переходы, написать соответствующие названия, после чего наша схема принимает вид, показанный на рисунке 3.
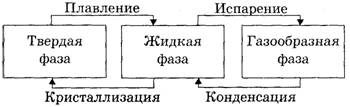
Рис. 3
III этап. Учитель предлагает учащимся с помощью имеющейся схемы сформулировать определения четырех фазовых переходов. Опыт показывает, что они легко справляются с данной задачей:
Плавлением называют переход вещества из твердой фазы в жидкую.
Испарением называют переход вещества из жидкой фазы в газообразную.
Конденсацией называют переход вещества из газообразной фазы в жидкую.
Кристаллизацией называют переход вещества из жидкой фазы в твердую.
IV этап. Учитель предлагает учащимся ответить на вопросы:
1) Отличаются ли чем-либо молекулы льда, воды и водяного пара, взятые в количестве 1 шт.?
2) Чем отличаются по молекулярному строению лёд, вода и водяной пар?
3) Чем определяется внутренняя энергия тела?
4) Чем определяется температура тела?
5) Может ли вещество в разных фазах иметь одну и ту же температуру?
Обычно на первые четыре вопроса учащиеся легко дают ответы:
1) Не отличаются.
2) Взаимным расположением молекул.
3) Внутренняя энергия тела определяется движением и взаимодействием частиц, из которых состоит тело.
4) Температура определяется средней кинетической энергией молекул тела.
Если учащиеся затрудняются ответить на пятый вопрос, следует предложить им проделать следующий мысленный эксперимент.
В помещение, в котором поддерживается постоянная температура 0°С, вносят лед, температура которого меньше нуля, и воду, температура которой выше нуля.
Вопрос. Какой физический процесс происходит в ходе эксперимента? (Теплопередача.)
Вопрос. Каков механизм теплопередачи? (Теплопроводность.)
Вопрос. До какого момента будет происходить теплопередача?
Ответ. Теплопередача будет происходить до тех пор, пока температуры льда, воды и воздуха в помещении не сравняются. Поскольку в условии эксперимента оговорено, что температура воздуха постоянна и равна 0°С, теплопередача прекратится, как только лёд и вода достигнут температуры 0°С.
Вывод. Вещество в разных фазах может иметь одну и ту же температуру.
Вопрос. Что больше — внутренняя энергия одного килограмма льда, взятого при температуре 0°С, или внутренняя энергия одного килограмма воды, взятой при той же температуре?
Ответ. Внутренняя энергия воды больше.
Вывод. Для перехода вещества из твердой фазы в жидкую веществу следует передать некоторое количество теплоты.
Аналогично приходим к выводам о том, что при испарении тело также поглощает, а при конденсации и кристаллизации — выделяет некоторое количество теплоты.
Теперь учащимся предлагается усовершенствовать схему так, как это сделано на рис. 4.
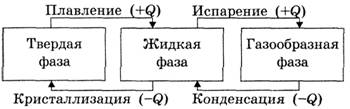
Рис. 4
Логика вводимых дополнений понятна учащимся: фазовые переходы, при которых количество теплоты поглощается телом, дополняются символом «+Q», переходы же, при которых количество теплоты выделяется, дополняются символом «–Q».
V этап. Учитель задает учащимся вопрос: «Одинаковое ли количество теплоты потребуется для плавления 1 кг льда и 1 кг железа? »
Как правило, учащиеся интуитивно приходят к правильному ответу — разное, но тут же ошибаются, уточняя, что для плавления килограмма железа потребуется большее количество теплоты.
Здесь стоит пояснить учащимся, что под «плавлением» мы подразумеваем не некий технологический процесс, а непосредственно фазовый переход, которому предшествовало нагревание тела до температуры, при которой тело начинает плавиться. Температура эта называется точкой плавления. После этого пояснения учащимся предлагается рассмотреть таблицу 3 учебника.
В ходе рассмотрения учащимися таблицы 3 учитель определяет удельную теплоту плавления вещества л как количество теплоты, которое поглощает твердое тело массой 1 кг при температуре плавления для перехода в жидкую фазу.
Вопрос. От чего, кроме удельной теплоты плавления, зависит количество теплоты, необходимой для перехода тела из твердой фазы в жидкую?
Ответ. От массы тела.
Вывод. Количество теплоты, необходимой для перехода тела из твердой фазы в жидкую, рассчитывается по формуле Q = λ·m. По аналогии вводятся понятие удельной теплоты парообразования L и формула Q = L·m.
Примечание. При выводе последней формулы следует заострить внимание учащихся на том, что испарение может происходить при различных температурах и подробный разговор об этом будет на следующем уроке.
Учитель задает учащимся вопрос: «Какое количество теплоты выделяется при конденсации?»
Обычно учащиеся дают правильный ответ: «Такое же, как и при испарении».
Если учащиеся затрудняются с ответом, им следует попробовать применить закон сохранения энергии.
После этого учащимся предлагается дополнить схему формулами для расчета соответствующих количеств теплоты (рис.5).
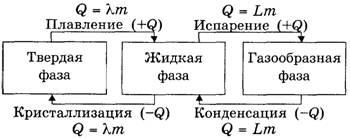
Рис. 5
VI этап. Учитель предлагает учащимся, используя имеющуюся у них схему, ответить на вопросы физического диктанта.
VII этап (заключительный). Учащиеся, используя имеющуюся у них в тетрадях схему (см. рис. 5), проверяют написанные ими физические диктанты.
