
- •З дисципліни ““медична хімія (фізична та колоїдна хімія)”
- •Практичне заняття № 5
- •Конкретні цілі:
- •Зміст заняття
- •Завдання для самостійної роботи
- •Визначення величини адсорбції
- •1. Знайдемо константу к для капіляра:
- •2. Обчислимо поверхневий натяг (σ) для розчину жовчі:
- •Питання для самоконтролю
- •Задачі для самостійного розв'язання
- •Практичне заняття № 6
- •Конкретні цілі:
- •Зміст заняття
- •Газова хроматографія
- •Рідинна хроматографія
- •Паперова та тонкошарова хроматографія
- •Завдання для самостійної роботи
- •Приготування розчинів оцтової кислоти
- •Визначення адсорбції оцтової кислоти активованим вугіллям
- •Завдання 3. Розв’язати типові задачі.
- •1. Обчислюємо масу вугілля, що має поверхню 10 м2
- •3. Обчислюємо масу фосгену об'ємом 4,4 ·10-3 л
- •4. Обчислюємо адсорбцію на 1 г вугілля:
- •Логарифмуючи ліву і праву частину рівняння, одержимо вираз:
- •Питання для самоконтролю
- •Задачі для самостійного розв'язання
- •Вибрати нерухомі межі поділу:
- •Вибрати правильну відповідь. Поглинання, що призводить до утворення нових хімічних сполук, називається:
- •Дописати пропущені слова. Речовина, що поглинає своєю поверхнею молекули інших речовин, називається а........., а речовина, яка поглинається – в.......
- •Вибрати правильну відповідь. Процеси, які відбуваються на межі поділу фаз у гетерогенних системах – це:
- •Заповнити таблицю класифікації поверхневих явищ:
- •Практичне заняття № 7 тема: одержання ліофобних золів та їх властивості
- •Зміст заняття
- •Завдання для самостійної роботи
- •Хід виконання практичного заняття
- •1) Одержати золь металічного срібла за реакцією відновлення:
- •2) Одержати золь мангану діоксиду за допомогою окисно-відновної реакції.
- •Питання для самоконтролю
- •Тести і задачі для самостійного розв'язування
- •Практичне заняття № 8
- •Зміст заняття
- •Завдання для самостійної роботи
- •Хід виконання практичного заняття
- •Питання для самоконтролю
- •Задачі для самостійного розв'язування
- •Практичне заняття № 9 тема: властивості розчинів високомолекулярних сполук
- •Конкретні цілі:
- •Біополі мери
- •Завдання для самостійної роботи
- •Питання для самоконтролю
- •Однофазні структуровані системи вмс і розчинника – драглі утворюються із розчину полімеру при:
- •Вибрати вірну відповідь. З одного боку, розчини вмс виявляють усі ознаки, властиві істинним розчинам:
- •Вибрати вірну відповідь. Тиксотропія – це:
- •6.Вибрати вірну відповідь. Біополімери – це:
- •Задачі для самостійного розв'язання
Вищий навчальний комунальний заклад Львівської обласної ради
«Львівський медичний коледж імені Андрея Крупинського»
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ
до практичних занять
З дисципліни ““медична хімія (фізична та колоїдна хімія)”
для студентів спеціальності „Сестринська справа”
освітньо – кваліфікаційного рівня медична сестра
ІІ частина
Львів 2013
Методичні рекомендації
Складені викладачем медичної хімії Вищого навчального комунального закладу Львівської обласної ради «Львівського медичного коледжу імені Андрея Крупинського» Т. Б. Кожиною
Розглянуто і затверджено на засіданні циклової комісії спецлаборантських дисциплін
Протокол № 8 від 6 березня 2013 р.
Рецензенти:
О. В. Грибальська, викладач біоорганічної хімії Вищого навчального комунального закладу Львівської обласної ради «Львівського медичного коледжу імені Андрея Крупинського»
Л. Д. Сойка, кандидат хімічних наук, викладач клінічної біохімії Вищого навчального комунального закладу Львівської обласної ради «Львівського медичного коледжу імені Андрея Крупинського»
М. Л. Барська, кандидат біологічних наук, старший науковий співробітник Інституту біології клітини НАН України
Практичне заняття № 5
ТЕМА: ПОВЕРХНЕВИЙ НАТЯГ І ПОВЕРХНЕВО-АКТИВНІ РЕЧОВИНИ. АДСОРБЦІЯ НА РУХОМІЙ МЕЖІ ПОДІЛУ ФАЗ
МЕТА заняття: ознайомитись з визначенням поверхневого натягу на межі рідина – газ за методом Ребіндера. Навчитись обчислювати величини адсорбції за рівнянням Гіббса. Побудовати ізотерми поверхневого натягу й адсорбції поверхнево – активних речовин (ПАР).
МАТЕРІАЛЬНЕ ЗАБЕЗПЕЧЕННЯ ЗАНЯТТЯ:` прилад П. А. Ребіндера, розчини поверхнево-активної речовини різної концентрації, піпетки, колби.
Конкретні цілі:
пояснювати поверхневі явища та їх значення в біології та медицині;
пояснювати поверхневий натяг; ізотерми поверхневого натягу;
знати поверхнево-активні та поверхнево-неактивні речовини;
знати правило Дюкло-Траубе;
трактувати поверхневу енергію Гіббса і поверхневий натяг ПАР і П-ін-АР;
пояснювати поверхневу активність;
пояснювати адсорбцію на межі поділу фаз, рівняння Гіббса;
пояснювати орієнтацію молекул поверхнево-активних речовин у поверхневому шарі;
мати уявлення про структуру біологічних мембран;
вміти застосовувати теоретичні положення вчення про адсорбцію;
вміти досліджувати адсорбцію на межі рідина-газ, рідина-рідина;
вміти визначати поверхневий натяг на межі рідина – газ за методом Ребіндера;
вміти обчислювати величини адсорбції за рівнянням Гіббса;
вміти будувати ізотерми поверхневого натягу й адсорбції поверхнево–активних речовин (ПАР).
вміти дотримуватися правил техніки безпеки та охорони праці при визначенні поверхневого натягу на межі рідина – газ за методом Ребіндера;
навчитись розв’язувати типові задачі.
Зміст заняття
На великій поверхні розділу фаз у живому організмі (15 000 м2) відбуваються процеси обміну, синтезу, адсорбції, десорбції, ферментативні реакції та інші процеси, пов’язані з життєдіяльністю організму.
Величина поверхневого натягу належить до фізико-хімічних констант, а її зміна має діагностичне значення.
Адсорбційні процеси відіграють важливу роль в життєдіяльності організмів. Адсорбція різних речовин елементами крові та протоплазмою клітин впливає на обмін речовин, тому при лікуванні гострих отруєнь важливе місце займає адсорбційна терапія і гемосорбція. Використання імуносорбентів, ентеросорбентів дає змогу виводити з організму антитіла, бактеріальні токсини та інші антигени, зменшувати мікробну інтоксикацію. Іонообмінна адсорбція - це основа дії ферментів біологічних мембран. За допомогою іонообмінників одержують іонітне молоко для дитячого харчування, знесолену воду тощо.
Адсорбційна хроматографія - це важливий метод розділення, очищення і виділення багатьох лікарських речовин (антибіотиків, вітамінів, білків, гормонів); очищення і регенерації стічних вод; кількісного визначення забруднювачів зовнішнього середовища (шкідливих газів і парів, токсичних речовин, пестицидів).
Поверхневі явища. Адсорбція |
Поверхня твердих тіл і рідин має адсорбційні властивості, тобто вона здатна поглинати гази, пари. Характер поглинання залежить від природи поглинаючої речовини, її структури, попередньої обробки. Речовина, що поглинає своєю поверхнею молекули інших речовин, називається адсорбентом, а речовина, яка поглинається, — адсорбтивом.
Особливості властивостей поверхневого шару рідини на межі з повітрям:
- молекули у внутрішніх шарах речовини зазнають у середньому однакове у всіх напрямках притягання з боку молекул, що їх оточують;
- молекули поверхневого шару піддаються неоднаковому притяганню (з боку внутрішніх шарів рідини вони зазнають сильнішого притягання, ніж з боку повітря).
Тому властивості поверхневих шарів рідини завжди відрізняються від властивостей її внутрішніх шарів.
Оскільки сили притягання між частинками в поверхневому шарі повітря не скомпенсовані, то на поверхні розділу фаз з'являється деякий запас так званої вільної енергії. У системах, що мають надлишок вільної енергії, вільно протікають процеси, які призводять до зниження запасу енергії. Одним з таких процесів є адсорбція.
Адсорбція - це вільний процес концентрування одного з компонентів гетерогенної системи на поверхні розділу фаз.
Адсорбція спостерігається на межі розділу рідина - газ, рідина - рідина (рідини, що не змішуються), тверде тіло - газ, тверде тіло - рідина. Найширше використовується адсорбція твердими поверхнями. Серед речовин з найбільш розвинутими поверхнями є активоване вугілля, силікагель, оксид алюмінію, глина та ін. Наприклад, питома поверхня активованого деревного вугілля становить 900-1000 м2/г.
Якщо речовина поглинається всередину адсорбента, то процес називається абсорбцією. Поглинання, що призводить до утворення нових хімічних сполук, називається хемосорбцією. Адсорбція супроводжується зворотнім процесом - десорбцією. В стані адсорбційної рівноваги середнє число частинок, що адсорбуються, рівне середньому числу частинок, що десорбують за одиницю часу. Адсорбція газів, парів, рідин - процес екзотермічний, тобто вона зростає з пониженням температури. Адсорбція, як правило, протікає вибірково. Наприклад, активоване вугілля добре поглинає хлор, але не поглинає оксид вуглецю.
Адсорбція на межі рідина - газ, рідина — рідина |
Вільна енергія поверхні рідини визначається рівнянням:
![]()
де σ - вільна енергія одиниці поверхні (поверхневий натяг),
S - величина поверхні, м2.
Згідно із законами термодинаміки вільна енергія завжди прагне до мінімуму. У розчинах F може зменшуватись за рахунок зменшення поверхневого натягу. Речовини, які, адсорбуючись, понижують поверхневий натяг на межі розділу фаз, називаються поверхнево-активними речовинами (ПАР).
До них належать мила, вищі жирні кислоти, спирти, тобто речовини, які складаються з дифільних молекул, а тому містять неполярні частинки (вуглеводневі радикали) і полярні групи (-СООН, -ОН, -NО2). Схематично їх можна зобразити так:


полярна група неполярний радикал
Речовини, які зменшують поверхневий натяг, накопичуються на поверхні розділу фаз (позитивна адсорбція), тобто їх концентрація на поверхні більша, ніж в об'ємі розчину.
У поверхневих шарах молекули ПАР орієнтовані. Полярні групи їх спрямовані до полярної рідини, а неполярні частинки виштовхуються в неполярне середовище.
Залежність між величиною адсорбції на межі розділу рідина - газ і рідина - рідина, концентрацією розчину та поверхневим натягом за даної температури виведена Гіббсом:
![]()
де Г - надлишок речовини у поверхневому шарі (величина адсорбції), кмоль/м2;
С - концентрація, кмоль/м3;
R - газова стала, Дж/кмоль· К (8,313-103);
Т - абсолютна температура, К;
![]() - зміна поверхневого
натягу з концентрацією.
- зміна поверхневого
натягу з концентрацією.
З рівняння Гіббса випливає, що коли > 0, то Г<0 (від'ємна адсорбція); якщо ж < 0, то Г>0 (позитивна адсорбція).
Інтегруючи рівняння Гіббса, одержимо рівняння, за допомогою якого величину адсорбції можна обчислити за зміною поверхневого натягу на межі розділу фаз:
![]()
де σо - поверхневий натяг чистого розчинника;
σп - поверхневий натяг розчину ПАР.
Графічну залежність величини адсорбції від концентрації ПАР за сталої температури називають ізотермою адсорбції Гіббса, а залежність σ від концентрації ПАР - ізотермою поверхневого натягу.
 С
С
Ізотерма адсорбції та поверхневого натягу ПАР на межі розділу рідина-повітря.
Аналіз ізотерми адсорбції Гіббса для ПАР свідчить, що за малих концентрацій адсорбція пропорційна концентрації, за високих – досягає свого граничного значення Г∞ і потім не змінюється (за певної концентрації ПАР у розчині ізотерма виходить на насичення, тобто Г = Г∞, і величина адсорбції вже не залежить від подальшого збільшення концентрації ПАР). При цьому вся поверхня розділу буде заповнена молекулами ПАР, утворюється так званий частокіл Ленгмюра. Полярні групи молекул знаходяться в полярному середовищі, а неполярні - в неполярному.
Поверхнева активність дифільних молекул залежить від довжини вуглеводневої групи. Вчені П.Дюкло та І.Траубе сформулювали таке правило: поверхнева активність жирних кислот, спиртів та інших дифільних сполук у водних розчинах однакової концентрації зі збільшенням довжини вуглеводневої групи на одну групу - СН2- збільшується у 3-3,5 рази, тобто
gn+1 / gn = β = 3-3,5,
де g – поверхнева активність, n – число груп - СН2-, β – коефіцієнт Траубе.
Правило Дюкло-Траубе найбільш точно виконується за низьких концентрацій розчинених речовин. Із нього випливає важливий висновок:
Площа, яка припадає на одну молекулу максимально насиченого ПАР адсорбційного шару, залишається сталою в межах гомологічного ряду.
|
Структура біологічних мембран |
|
Одним із складників клітин є зовнішні (плазматичні) мембрани, які відокремлюють внутрішній вміст клітин від зовнішнього середовища. Для молекул та йонів мембрана діє як фільтр – пропускає одні частинки та затримує інші.
Структурну основу мембрани складають дифільні (амфіфільні) молекули ліпідів. Мембранні ліпіди містять довгі вуглеводневі групи, холестерин та його естери. Найчастіше амфіфільними сполуками у складі мембран є фосфоліпіди. Амфіфільні молекули поділяють на одно- та дволанцюгові.
Важливою властивістю дволанцюгових амфіфільних молекул є їх здатність до утворення подвійних шарів у водних середовищах. Дифільні молекули об’єднуються так, що їх полярні групи контактують з водою, а вуглеводневі групи збираються разом і утворюють вуглеводневу фазу. Одноланцюгові амфіфільні молекули прагнуть до утворення у водному середовищі глобулярних міцел (від лат. тіса - крихта, частинка), а не бімолекулярних шарів. Подвійний шар фосфоліпідів – основа замкнених структур (ліпосом) різних типів.
Усередині подвійного шару фосфоліпідів знаходяться молекули білків. Вони відіграють роль каталізаторів хімічних реакцій, що відбуваються на мембранах, та рецепторів сигналів, за допомогою яких клітина взаємодіє з навколишнім середовищем та іншими клітинами.
Молекули фосфоліпідів, на відміну від великих молекул білків, порівняно вільно переміщуються вздовж поверхні мембрани, залишаючись у межах свого шару. Мембрана має будову рідкого кристалу, що дуже важливо для її функціонування. При переході мембрани з рідкокристалічного стану в упорядкований її робота гальмується. У таких випадках спостерігається розвиток патологічних процесів в організмі – атеросклероз, утворення жовчних каменів тощо.
Сили, які діють всередині однієї фази, називаються силами когезії, а сили, які діють між молекулами, що знаходяться в різних фазах, називають силами адгезії.
Сили міжмолекулярної взаємодії (адгезійні) намагаються розтягнути краплю, а сили когезії стягують краплю, перешкоджаючи розтіканню.

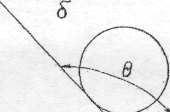 Мірою
змочування поверхні є крайовий кут θ .
Чим менше значення θ , тим більше
змочування. Різні види змочування
наведені на рисунку:
Мірою
змочування поверхні є крайовий кут θ .
Чим менше значення θ , тим більше
змочування. Різні види змочування
наведені на рисунку:
Рис. а) θ < 90 °; Рис. б) θ > 90 °.
Основною частиною приладу П.А. Ребіндера є трубка 2 з капілярним кінчиком, опущена в пробірку 5 з патрубком. При роботі приладу в пробірці над поверхнею рідини за допомогою аспіратора 8 утворюється вакуум (аспіратор наповнюється водою, закривається, вода витікає з нього у стакан 7). Над трубкою 2 тиск атмосферний, в пробірці 5 повітря постійно розріджується. При певній різниці тиску забезпечується відрив утвореної бульбашки. Цей тиск пропорційний поверхневому натягу рідини:
σ = К р,
де σ - поверхневий натяг; р - тиск;
К- постійна приладу, яка залежить від радіуса капіляра.
Тиск вимірюють за допомогою манометра 6, у якого один кінець з'єднаний з атмосферою, а другий через трійник 1 - з вакуумною системою (умови такі ж, як і в пробірці 5). Для визначення константи приладу беруть рідину, поверхневий натяг якої відомий (звичайно дистильовану воду). Тоді
К= σо /ро
де σо- поверхневий натяг води при температурі досліду, дн/см;
ро - тиск у момент відриву бульбашки.
Знайшовши постійну приладу К, можна визначити поверхневий натяг різних рідин, заміряючи для кожної з них тиск р.
