
- •З дисципліни ““медична хімія (фізична та колоїдна хімія)”
- •Практичне заняття № 1 тема: енергетика хімічних реакцій та процесів
- •Зміст заняття
- •Завдання для самостійної роботи
- •Визначити теплові ефекти хімічних реакцій та процесів.
- •Питання для самоконтролю
- •2. Вибрати інтенсивні властивості термодинамічної системи:
- •5. Ентальпія, як і внутрішня енергія є функціями стану системи і її зміна залежить від а……… і в……. Стану і не залежить від с…..
- •6. Вибрати вірну відповідь. Закрита термодинамічна система – це ….
- •8. Скільки теплоти (в кДж) виділиться при вибуху 8,4 л гримучого газу, виміряного за н.У. (гримучий газ — суміш н2 і о2 у співвідношенні 2:1).
- •Специфічність.
- •Оборотність (зворотність).
- •Завдання для самостійної роботи
- •Завдання 2. Розв’язати типові задачі.
- •Питання для самоконтролю
- •Яким реакціям відповідає перший порядок:
- •Вибрати послідовні хімічні реакції:
- •10. Дописати схему ферментативного каталізу - перетворення субстрату на продукти реакції:
- •Задачі для самостійного розв'язування
- •Практичне заняття № 3
- •Зміст заняття
- •Завдання для самостійної роботи
- •Питання для самоконтролю
- •Задачі та тести для самостійного розв’язування:
- •Рекомендована література
- •Практичне заняття № 4 тема: потенціометричне визначення рН
- •Зміст заняття
- •Завдання для самостійної роботи
- •1. Потенціометрично визначити рН розчину за допомогою індикаторного хінгідронного електрода.
- •2. Потенціометрично визначити рН розчину за допомогою складного індикаторного електрода на іономірі ев-74.
- •3. Розв'язати типові задачі. Хід виконання практичного заняття
- •3. Розв'язати типові задачі.
- •Питання для самоконтролю
- •Задачі для самостійного розв'язування
Зміст заняття
Одним з важливих сучасних електрохімічних методів дослідження є потенціометрія – метод, оснований на вимірюванні ЕРС гальванічних елементів, в яких за рахунок зміни внутрішньої енергії генерується електричний струм. Хімічні джерела електроенергії широко використовується в космічних апаратах, вимірних приладах, в радіозв’язку, побуті, на транспорті і т.д. Тому глибоке розуміння механізму перетворення енергії хімічних реакцій в електричну, практичне застосування методів потенціометрії необхідно знати спеціалістові будь-якого профілю.
В дослідних лабораторіях та клінічних умовах вимірювання ЕРС і електродних потенціалів застосовують для визначення концентрації іонів в розчинах, коефіцієнтів активності, добутку розчинності важкорозчинних солей, полярографії, при потенціометричному титруванні. Ґрунтовне вивчення природи біопотенціалів дало можливість розробити електрофізичні методи діагностики – електрокардіографію.
Завдання для самостійної роботи
Визначити ЕРС акумулятора за допомогою елемента Вестона.
Визначити ЕРС гальванічного елемента, складеного з двох електродів.
Визначити потенціал окремого електрода.
Розв'язувати типові задачі.
ХІД ВИКОНАННЯ ПРАКТИЧНОГО ЗАНЯТТЯ
Завдання 1. Визначити ЕРС акумулятора за допомогою елемента Вестона.
Визначити ЕРС акумулятора за допомогою елемента Вестона. Зібрати установку згідно наведеної схеми, звертаючи увагу на правильність включення полюсів акумулятора і елемента Вестона, ЕРС якого відома і становить 1,018 В (включати (+) акумулятора до (+) елемента Вестона). На короткий час потиснути ключ К і, пересуваючи повзунок по реохордній лінійці, знайти точку компенсації, коли стрілка гальванометра зупиниться на нулю шкали. Записати в журнал хід роботи, зарисувавши схему установки та вирахування ЕРС акумулятора зі співвідношення:
ЕАК АВ 1,018 · 1000
—— = ——; ЕАК = —————,
ЕВ АС АС
Де АВ = 1000 мм – довжина лінійки реохорда.
Відключити елемент Вестона.
 Е1
Е1
А
В
Е₂
К
Г
С


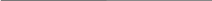

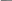


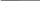











Рис.
1.
Схема
установки для визначення ЕРС методом
компенсації.
Завдання 2. Визначити ЕРС гальванічного елемента, складеного з двох електродів.
Включити в електричну схему (див. рис. 1) на місце елемента Вестона (Е2) елемент, складений з двох електродів, наприклад: мідно – цинковий (елемент Якобі- Даніеля).
(‾)Zn | ZnSO4 | KCI | CuSO4 | Cu(+)
Користуючись таблицею ряду напруг правильно включити полюси електродів в компенсаційну схему ( + ) до ( +).
З’єднати посудинки обох електродів електролітним KCI-агаровим містком, що знаходиться в посудині з розчином KCI на робочому місці. Пояснити чому використовують KCI – агаровий місток?
Перевірити надійність контактів в системі (наявність електролітів в електродах та відсутність бульбашок повітря в KCI- агаровім містку).
Знову, як в завданні № 1, знайти точку компенсації і, знаючи ЕРС акумулятора, вирахувати ЕРС елемента Ех:
Еак · АС′
Ех = ———
1000
У випадку взятого елемента з двох електродів, що мають однакові за знаком потенціали позитивним (негативним) електродом буде той електрод, потенціал якого більший по відношенню до другого, наприклад:
ЕZn / Zn2+ = - 0,76 В; еСd/ Cd2+ = -0,40 В, значить
(‾)Zn | ZnSO4 | KCI | CdSO4 | Cd (+)
Завдання 3. Визначити потенціал окремого електрода.
Скласти гальванічний елемент з електрода з невідомим потенціалом ех і стандартного електрода з відомим потенціалом ест.. = + 0,22 В.
Записати його схему , наприклад :
(‾)Zn | ZnSO4 | KCl | КCl, АgCl | АgCu(+)
Включити його в схему, пам’ятаючи полярність електродів і, знайшовши точку компенсації АС, вирахувати ЕРС елемента Ех:
Еак · АС′
Ех = ———
1000
Враховуючи, що ЕРС = Ех = е+ - ех-, вирахувати шуканий потенціал електрода ех, якщо потенціал хлор срібного електрода відомий:
Ех = - Ех + ест.
Завдання 4. Розв'язати типові задачі
Задача 1.
Вирахувати електродний потенціал мідного електрода, зануреного в розчин CuSO4 з концентрацією солі 0,0845 моль/л, якщо її ступінь іонізації 0,4.
Алгоритм розв'язування
Знаходимо концентрацію іонів міді в розчині.
CСu²+ = α · C = 0,4 · 0,0845 = 0,0338 г-іон/л
Електродний потенціал вираховуємо за рівнянням:
0,059
еCu = ео + ——— lg ССu2+
n
де n = 2, а ео = + 0,34 В (взято з таблиць)
0,059
еСu = 0,34 + —— lg 0,0338 = 0,34 + 0,029 (-1,47) = 0,34 – 0,04 = 0,30 В
2
Задача 2.
Вирахувати при 18˚С ЕРС концентраційного срібного елемента з концентрацією AgNO3 в електродів C1 = 0,1 н, C2 = 0,01 н, якщо ступінь іонізації відповідно дорівнює для 0,1 н розчину 0,814, а для 0,01 н ― 0,931.
Алгоритм розв'язування
ЕРС концентраційного гальванічного елемента виражається рівнянням:
0,058 C1 · α1
Е = ——— lg———;
n С2 · α2
для срібла n = 1.
С0,1 · 0,1 0,1 · 0,814
Тоді Е = 0,058 lg————— = 0,059 lg ————— = 0,055 В ;
С0,01 · 0,01 0,01 · 0,931
