
- •Т.Б. Кожина Лекція № 3 з дисципліни “медична хімія (фізична та колоїдна хімія)”
- •На тему:
- •Специфічна адсорбція електролітів
- •Правило панета-фаянса
- •Йонообмінна адсорбція електролітів
- •Практичне застосування іонітів
- •Класифікація хроматографічних методів
- •Газова хроматографія
- •Рідинна хроматографія
- •Паперова та тонкошарова хроматографія
Вищий навчальний комунальний заклад Львівської обласної ради
«Львівський медичний коледж імені Андрея Крупинського»
Т.Б. Кожина Лекція № 3 з дисципліни “медична хімія (фізична та колоїдна хімія)”
для студентів спеціальності “Сестринська справа ”
кваліфікація молодшого спеціаліста: медична сестра
На тему:
ПОВЕРХНЕВІ ЯВИЩА.
АДСОРБЦІЯ НА МЕЖІ ПОДІЛУ ФАЗ

ПЛАН
1. Поверхневі явища та їх значення в біології та медицині.
2. Адсорбція.
3. Адсорбція на межі поділу фаз.
4. Правило Дюкло-Траубе.
5. Структура біологічних мембран.
6. Адсорбція на поверхні твердих адсорбентів.
7. Застосування хроматографії в медицині.
1. Поверхневі явища та їх значення в біології та медицині. |
На великій поверхні розділу фаз у живому організмі (15 000 м2) відбуваються процеси обміну, синтезу, адсорбції, десорбції, ферментативні реакції та інші процеси, пов’язані з життєдіяльністю організму.
Величина поверхневого натягу належить до фізико-хімічних констант, а її зміна має діагностичне значення.
Адсорбційні процеси відіграють важливу роль в життєдіяльності організмів. Адсорбція різних речовин елементами крові та протоплазмою клітин впливає на обмін речовин, тому при лікуванні гострих отруєнь важливе місце займає адсорбційна терапія і гемосорбція. Використання імуносорбентів, ентеросорбентів дає змогу виводити з організму антитіла, бактеріальні токсини та інші антигени, зменшувати мікробну інтоксикацію. Іонообмінна адсорбція - це основа дії ферментів біологічних мембран. За допомогою іонообмінників одержують іонітне молоко для дитячого харчування, знесолену воду тощо.
Адсорбційна хроматографія - це важливий метод розділення, очищення і виділення багатьох лікарських речовин (антибіотиків, вітамінів, білків, гормонів); очищення і регенерації стічних вод; кількісного визначення забруднювачів зовнішнього середовища (шкідливих газів і парів, токсичних речовин, пестицидів).
2. Адсорбція. |
Поверхня твердих тіл і рідин має адсорбційні властивості, тобто вона здатна поглинати гази, пари. Характер поглинання залежить від природи поглинаючої речовини, її структури, попередньої обробки. Речовина, що поглинає своєю поверхнею молекули інших речовин, називається адсорбентом, а речовина, яка поглинається, — адсорбтивом.
Особливості властивостей поверхневого шару рідини на межі з повітрям:
- молекули у внутрішніх шарах речовини зазнають у середньому однакове у всіх напрямках притягання з боку молекул, що їх оточують;
- молекули поверхневого шару піддаються неоднаковому притяганню (з боку внутрішніх шарів рідини вони зазнають сильнішого притягання, ніж з боку повітря).
Тому властивості поверхневих шарів рідини завжди відрізняються від властивостей її внутрішніх шарів.
Оскільки сили притягання між частинками в поверхневому шарі повітря не скомпенсовані, то на поверхні розділу фаз з'являється деякий запас так званої вільної енергії. У системах, що мають надлишок вільної енергії, вільно протікають процеси, які призводять до зниження запасу енергії. Одним з таких процесів є адсорбція.
Адсорбція - це вільний процес концентрування одного з компонентів гетерогенної системи на поверхні розділу фаз.
Адсорбція спостерігається на межі розділу рідина - газ, рідина - рідина (рідини, що не змішуються), тверде тіло - газ, тверде тіло - рідина. Найширше використовується адсорбція твердими поверхнями. Серед речовин з найбільш розвинутими поверхнями є активоване вугілля, силікагель, оксид алюмінію, глина та ін. Наприклад, питома поверхня активованого деревного вугілля становить 900-1000 м2/г.
Якщо речовина поглинається всередину адсорбента, то процес називається абсорбцією. Поглинання, що призводить до утворення нових хімічних сполук, називається хемосорбцією. Адсорбція супроводжується зворотнім процесом - десорбцією. В стані адсорбційної рівноваги середнє число частинок, що адсорбуються, рівне середньому числу частинок, що десорбують за одиницю часу. Адсорбція газів, парів, рідин - процес екзотермічний, тобто вона зростає з пониженням температури. Адсорбція, як правило, протікає вибірково. Наприклад, активоване вугілля добре поглинає хлор, але не поглинає оксид вуглецю.
-
3. Адсорбція на межі поділу фаз
Вільна енергія поверхні рідини визначається рівнянням:
![]()
де σ - вільна енергія одиниці поверхні (поверхневий натяг),
S - величина поверхні, м2.
Згідно із законами термодинаміки вільна енергія завжди прагне до мінімуму. У розчинах F може зменшуватись за рахунок зменшення поверхневого натягу. Речовини, які, адсорбуючись, понижують поверхневий натяг на межі розділу фаз, називаються поверхнево-активними речовинами (ПАР).
До них належать мила, вищі жирні кислоти, спирти, тобто речовини, які складаються з дифільних молекул, а тому містять неполярні частинки (вуглеводневі радикали) і полярні групи (-СООН, -ОН, -NО2). Схематично їх можна зобразити так:


полярна група неполярний радикал
Речовини, які зменшують поверхневий натяг, накопичуються на поверхні розділу фаз (позитивна адсорбція), тобто їх концентрація на поверхні більша, ніж в об'ємі розчину.
У поверхневих шарах молекули ПАР орієнтовані. Полярні групи їх спрямовані до полярної рідини, а неполярні частинки виштовхуються в неполярне середовище.
Залежність між величиною адсорбції на межі розділу рідина - газ і рідина - рідина, концентрацією розчину та поверхневим натягом за даної температури виведена Гіббсом:
![]()
де Г - надлишок речовини у поверхневому шарі (величина адсорбції), кмоль/м2;
С - концентрація, кмоль/м3;
R - газова стала, Дж/кмоль· К (8,313-103);
Т - абсолютна температура, К;
![]() - зміна поверхневого
натягу з концентрацією.
- зміна поверхневого
натягу з концентрацією.
З рівняння Гіббса випливає, що коли > 0, то Г<0 (від'ємна адсорбція); якщо ж < 0, то Г>0 (позитивна адсорбція).
Інтегруючи рівняння Гіббса, одержимо рівняння, за допомогою якого величину адсорбції можна обчислити за зміною поверхневого натягу на межі розділу фаз:
![]()
де σо - поверхневий натяг чистого розчинника;
σп - поверхневий натяг розчину ПАР.
Графічну залежність величини адсорбції від концентрації ПАР за сталої температури називають ізотермою адсорбції Гіббса, а залежність σ від концентрації ПАР - ізотермою поверхневого натягу.
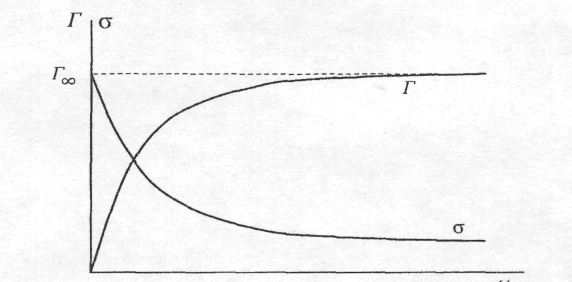 С
С
Ізотерма адсорбції та поверхневого натягу ПАР на межі розділу рідина-повітря.
Аналіз ізотерми адсорбції Гіббса для ПАР свідчить, що за малих концентрацій адсорбція пропорційна концентрації, за високих – досягає свого граничного значення Г∞ і потім не змінюється (за певної концентрації ПАР у розчині ізотерма виходить на насичення, тобто Г = Г∞, і величина адсорбції вже не залежить від подальшого збільшення концентрації ПАР). При цьому вся поверхня розділу буде заповнена молекулами ПАР, утворюється так званий частокіл Ленгмюра. Полярні групи молекул знаходяться в полярному середовищі, а неполярні - в неполярному.
-
4. Правило Дюкло-Траубе.
Поверхнева активність дифільних молекул залежить від довжини вуглеводневої групи. Вчені П.Дюкло та І.Траубе сформулювали таке правило: поверхнева активність жирних кислот, спиртів та інших дифільних сполук у водних розчинах однакової концентрації зі збільшенням довжини вуглеводневої групи на одну групу - СН2- збільшується у 3-3,5 рази, тобто
gn+1 / gn = β = 3-3,5,
де g – поверхнева активність, n – число груп - СН2-, β – коефіцієнт Траубе.
Правило Дюкло-Траубе найбільш точно виконується за низьких концентрацій розчинених речовин. Із нього випливає важливий висновок:
Площа, яка припадає на одну молекулу максимально насиченого ПАР адсорбційного шару, залишається сталою в межах гомологічного ряду.
5. Структура біологічних мембран. |
Одним із складників клітин є зовнішні (плазматичні) мембрани, які відокремлюють внутрішній вміст клітин від зовнішнього середовища. Для молекул та йонів мембрана діє як фільтр – пропускає одні частинки та затримує інші.
Структурну основу мембрани складають дифільні (амфіфільні) молекули ліпідів. Мембранні ліпіди містять довгі вуглеводневі групи, холестерин та його естери. Найчастіше амфіфільними сполуками у складі мембран є фосфоліпіди. Амфіфільні молекули поділяють на одно- та дволанцюгові.
Важливою властивістю дволанцюгових амфіфільних молекул є їх здатність до утворення подвійних шарів у водних середовищах. Дифільні молекули об’єднуються так, що їх полярні групи контактують з водою, а вуглеводневі групи збираються разом і утворюють вуглеводневу фазу. Одноланцюгові амфіфільні молекули прагнуть до утворення у водному середовищі глобулярних міцел (від лат. тіса - крихта, частинка), а не бімолекулярних шарів. Подвійний шар фосфоліпідів – основа замкнених структур (ліпосом) різних типів.
Усередині подвійного шару фосфоліпідів знаходяться молекули білків. Вони відіграють роль каталізаторів хімічних реакцій, що відбуваються на мембранах, та рецепторів сигналів, за допомогою яких клітина взаємодіє з навколишнім середовищем та іншими клітинами.
Молекули фосфоліпідів, на відміну від великих молекул білків, порівняно вільно переміщуються вздовж поверхні мембрани, залишаючись у межах свого шару. Мембрана має будову рідкого кристалу, що дуже важливо для її функціонування. При переході мембрани з рідкокристалічного стану в упорядкований її робота гальмується. У таких випадках спостерігається розвиток патологічних процесів в організмі – атеросклероз, утворення жовчних каменів тощо.
Сили, які діють всередині однієї фази, називаються силами когезії, а сили, які діють між молекулами, що знаходяться в різних фазах, називають силами адгезії.
Сили міжмолекулярної взаємодії (адгезійні) намагаються розтягнути краплю, а сили когезії стягують краплю, перешкоджаючи розтіканню.
Мірою змочування поверхні є крайовий кут θ . Чим менше значення θ , тим більше змочування. Різні види змочування наведені на рисунку:
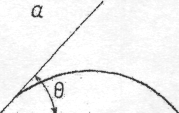
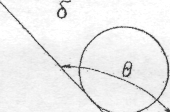 Рис.
а) θ < 90 °; Рис. б) θ > 90 °.
Рис.
а) θ < 90 °; Рис. б) θ > 90 °.
-
6. Адсорбція на поверхні твердих адсорбентів.
Найширше використовується адсорбція твердими поверхнями. Серед речовин з найбільш розвинутими поверхнями є активоване вугілля, силікагель, оксид алюмінію, глина та ін. Наприклад, питома поверхня активованого деревного вугілля становить 900-1000 м2 /г.
Поверхня твердого тіла також має надлишок вільної енергії. Причиною є неврівноваженість молекул, атомів, іонів у поверхневому шарі, а також нерівність поверхні. Прикладом поверхні з активними адсорбційними центрами є поверхня відновленого нікелю. Внаслідок надлишку поверхневої енергії тверді тіла мають адсорбційну здатність. На їх поверхні адсорбуються гази, пари. Внаслідок того, що вимірювати σ для твердої поверхні досить важко, застосовувати рівняння Гіббса для розрахунку величини адсорбції практично неможливо.
Адсорбція на твердій поверхні значною мірою залежить від величини поверхні адсорбенту. Чим краще подрібнений адсорбент, тобто чим більша його поверхня, тим сильніше протікатиме адсорбція.
Кількість речовини, поглинутої 1 см2 поверхні за досягнення адсорбційної рівноваги, називається питомою адсорбцією:
![]()
де х - число молів адсорбованої речовини;
S - площа поверхні адсорбенту, см2.
Оскільки виміряти поверхню твердого адсорбенту важко, адсорбцію встановлюють не на 1 см2, а на 1 г адсорбенту:
![]() моль/г,
моль/г,
де т- маса адсорбенту в грамах.
Кількість адсорбованого газу на твердому адсорбенті залежить від тиску, температури, природи газу. Залежність величини адсорбції від рівноважного тиску газу за сталої температури виражається ізотермою адсорбції (ізотерма адсорбції Фрейндліха).
До явища адсорбції близькі явища змочування, які теж визначаються інтенсивністю взаємодії між молекулами різних речовин. Розглянемо явище змочування на прикладі краплі рідини, нанесеної на поверхню твердого тіла. Якщо молекули рідини взаємодіють з молекулами твердого тіла сильніше, ніж між собою, то рідина розтікається по поверхні (вода на поверхні чистого скла). Якщо молекули рідини взаємодіють одна з одною значно сильніше, ніж з молекулами твердого тіла, то розтікання не відбувається. Рідина збирається на поверхні в краплю майже сферичної форми (ртуть на металічній поверхні).
