
- •Биофизика
- •Глава 1. Введение
- •§1.1. Предмет биофизики
- •Глава 2. Термодинамика биологических систем
- •§2.1. Основные понятия термодинамики
- •§2.2. I закон термодинамики и живые организмы.
- •§2.3. Виды работ, совершаемых организмом, источники их энергии
- •§2.4. Тепловой баланс организма. Химическая и физическая терморегуляция
- •§2.5. Понятие энтропии
- •§2.6. Формулировка II-го закона термодинамики для изолированных и замкнутых систем
- •§2.7. II закон термодинамики и живой организм (для открытой системы)
- •§2.8. Стационарное состояние. Теорема Пригожина
- •Глава 3. Кинетика биохимических процессов
- •§3.1. Основные определения и законы кинетики химических реакций
- •§3.2. Действие ферментов биохимических реакций
- •Глава 4. Биологические мембраны
- •§4.1. Строение и функции биологических мембран
- •§4.2. Искусственные мембраны
- •Глава 5. Пассивный транспорт веществ через биологические мембраны.
- •§5.1. Диффузия
- •§5.2. Миграция
- •§5.3. Перенос под действием градиента электрохимического потенциала
- •§5.4. Простая и облегченная диффузия
- •§5.5. Осмос
- •§5.6. Фильтрация
- •§5.7. Явления фильтрации и осмоса в процессе обмена водой между кровью и тканью
- •Глава 6. Активный транспорт веществ
- •Глава 7. Биоэлектрические потенциалы
- •§7.1. Потенциал покоя
- •§7.2. Потенциал действия
- •§7.3. Кинетика ионных токов через биологическую мембрану
- •§7.4. Распространение потенциала действия
- •§7.5. Передача возбуждения в синапсах
- •Глава 8. Электрокинетические явления
- •§8.1. Возникновение разности потенциалов между фазами гетерогенной системы
- •§8.2. Электрофорез
- •§8.3. Электроосмос
- •§8.4. Потенциал течения и оседания
- •§8.5. Применение электрокинетического потенциала. Агглютинация (слипание) частиц
- •Глава 9. Электропроводность клеток и тканей
- •§ 9.1. Эластичность биологических тканей и жидкостей для постоянного тока
- •§9.2. Электропроводимость биологических тканей для переменного тока
- •Глава 10. Действие электрического тока и э/м полей на биологические объекты
- •§10.1. Действие электрического тока на биологические ткани
- •§10.2. Действие переменного магнитного поля
- •§10.3. Действие переменного электрического поля между обкладками конденсатора
- •§10.4. Воздействие электромагнитными волнами
- •Глава 11. Действие ионизирующих излучений на биологические объекты
- •§11.1. Виды ионизирующего излучения. Основы дозиметрии
- •§11.2. Биологическое действие ионизирующих излучений.
- •Глава 12. Действие ультразвука на биологические ткани. Его применение в медицине
- •§12.1. Характеристики и получение ультразвука
- •§ 12.2. Действие ультразвука. Применение в биологии и медицине
- •Глава 13. Биомеханика опорно-двигательного аппарата человека
- •§ 13.1. Механические свойства биологических тканей
- •Костная ткань.
- •§ 13.2. Моделирование механических свойств биологических объектов
- •§ 13.3. Механические процессы в опорно-двигательном аппарате. Уравнение Хилла
- •§ 13.4. Структура мышцы и биофизика мышечного сокращения
- •§ 13.5. Кинетическая теория мышечного сокращения.
- •Глава 14. Биофизика кровообращения
- •§ 14.1. Работа сердца
- •Кинетический компонент работы
- •§ 14.2. Основные понятия гемодинамики
- •§ 14.3. Уравнение деформации кровеносных сосудов
- •§ 14.4. Уравнения движения и изменения давления во времени крови в сосуде
- •§ 14.5. Эластичная цепь как аналоговая модель кровеносной системы
- •§ 14.6. Пульсовая волна
- •§ 14.7. Резестивная модель периферического кровообращения
- •§ 14.8. Гидродинамическая модель кровообращения с сосредоточенными параметрами
- •Глава 15. Биофизика внешнего дыхания
- •§ 15.1. Основные термины и определения
- •§ 15.2. Механические процессы в легких. Механическая стабильность альвеол
- •§ 15.3. Газообмен в легких
- •§15.4. Транспорт газа в крови.
- •Глава 16. Элементы физики слуха.
- •§16.1. Характеристики звука.
- •§16.2. Строение и физические основы работы уха.
§2.6. Формулировка II-го закона термодинамики для изолированных и замкнутых систем
II-й закон термодинамики для изолированных систем:
В изолированных системах общее изменение энтропии всегда неотрицательно (оно переходит в наиболее вероятное состояние):
ΔS≥0 (знак «>» относится к необратимым процессам, а «=» – к обратимым)
изолированная
система 
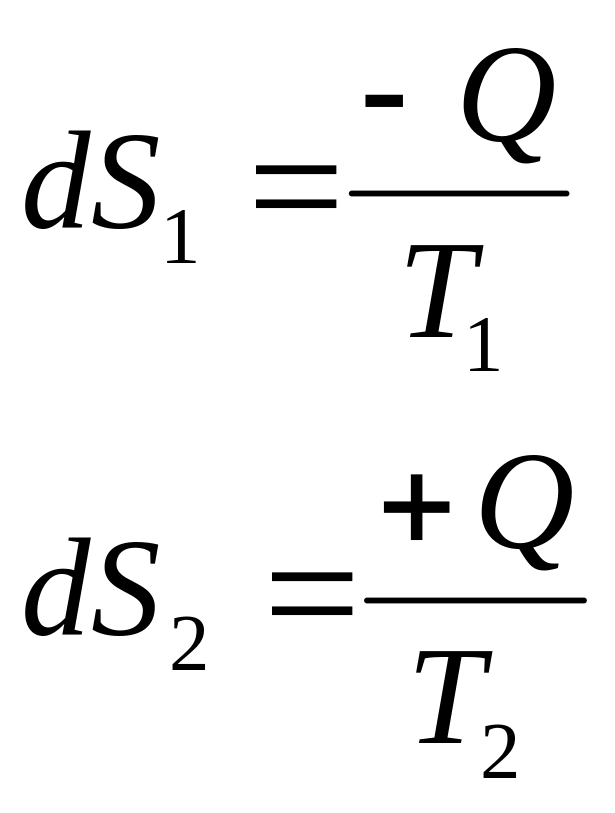
![]()
Для замкнутой системы, которая может переходить из состояния 1 в состояние 2, II-й закон термодинамики:
![]() , здесь
dQ – подводимое
из вне тепло.
, здесь
dQ – подводимое
из вне тепло.
Следствие из II-го закона термодинамики:
![]()
§2.7. II закон термодинамики и живой организм (для открытой системы)
Согласно Пригожину, полное изменение энтропии открытой системы можно представить в виде двух частей:
ΔS=ΔSi+ΔSe
Причина 1-й части (ΔSi) – внутренние процессы; а ΔSe – обмен веществом и энергией с окружающей средой (внешние процессы).
ΔG=ΔGi+ΔGe ΔG - изменение свободной энергии по Гиббсу
Всегда в реальных системах: ΔSi>0, ΔGi<0;
ΔSe и ΔGe могут быть и «+» и «–».
Если организм отдает тепло в окружающую среду:
![]() (ΔQ<0,
то есть отводится)
(ΔQ<0,
то есть отводится)
В термодинамике вводят при непрерывном изменении энтропии во времени скорость изменения энтропии:
![]()
![]() - продукция энтропии,
- продукция энтропии,
![]() - поток энтропии.
- поток энтропии.
⇒ II-й закон термодинамики в открытых системах:
В открытых системах
продукция энтропии всегда положительна,
а внутреннее изменение свободной энергии
всегда отрицательно, то есть
![]() ,
,
![]() .
.
В изолированной
системе:
![]() ⇒
⇒
![]()
§2.8. Стационарное состояние. Теорема Пригожина
Особую роль стационарное состояние.
Стационарное состояние является более выгодным.
Термодинамическое
условие стационарного состояния:
![]() или
или
![]() (изменение продукции энтропии
компенсируется отводом в окружающую
среду).
(изменение продукции энтропии
компенсируется отводом в окружающую
среду).
Теорема Пригожина:
В стационарном состоянии продукция энтропии имеет постоянное и минимальное значение, то есть:
КПД системы в стационарном состоянии является максимальным.
Теорема Пригожина справедлива для линейных систем, для систем которые близки к стационарному состоянию.
Глава 3. Кинетика биохимических процессов
Кинетика биохимических процессов с позиции физической химии изучает механизмы физических превращений в зависимости от различных факторов (температура, давление, ph, катализаторы).
§3.1. Основные определения и законы кинетики химических реакций
Пусть в замкнутых системах протекает химическая реакция:
ν1A1+ ν2A2+… +νmAm ⇄ ν'1B1+ ν'2B2+…+ ν'eBe, (1)
где νi – стехиометрические коэффициенты,
Ai – исходные вещества,
Bi – продукты.
Скорость образования или расходования компонента:
![]() ,
(2)
,
(2)
![]() ,
(3)
,
(3)
Скорость химической реакции – это величина
![]() (4)
(4)
i - любой компонент реакции.
Скорость химической реакции зависит от:
концентрации реагирующих веществ,
температуры,
катализаторов.
Согласно каталитической, скорость химической реакции определяется числом столкновений молекул друг с другом в единицу времени.
В соответствии с теоремой о произведении вероятностей (вероятность любого события, состоящего из нескольких событий, равно произведению вероятностей этих событий), ⇒ скорость химической реакции прямо пропорциональна произведению концентраций в степени их стехиометрических коэффициентов:
![]() –
закон действующих
масс
(5)
–
закон действующих
масс
(5)
k – константа скорости.
Чтобы преодолеть барьер при отталкивании, молекулы должны обладать определенным потенциалом:

EA – энергия активации.
Доля молекул, обладающих энергией, большей, чем EA, определяется уравнением Больцмана:
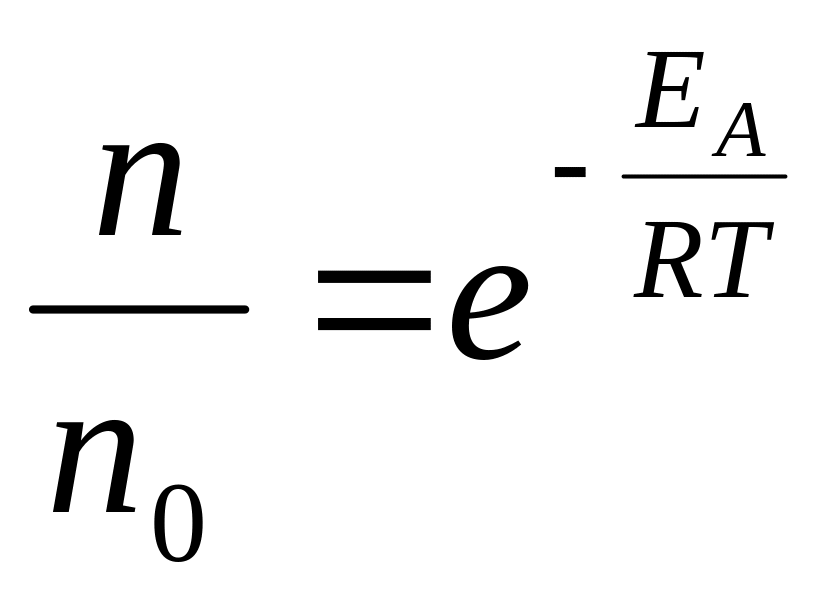
n0 – количество всех молекул
n – количество тех, которые обладают энергией > EA.
Если концентрации всех веществ в уравнении (5) были равны 1, то k пропорциональна числу ударений молекул.
![]() ,
(уравнение Аррениуса)
,
(уравнение Аррениуса)
A – количество соударений между молекулами в единицу времени.
Согласно кинетической теории:
![]() ,
,
![]() ,
,
![]() .
.
NA – число Авогадро,
k – постоянная Больцмана.
Вводят поправочный множитель:
![]() , p
– стерический множитель.
, p
– стерический множитель.
Существует теория, согласно которой, молекула ударяется не при каждом соударении, поэтому вводят p, который должен быть p≤1.
Другая теория, которая может объяснить возникновение p, называется теорией активированного комплекса: между исходным и конечным состоянием существует промежуточное состояние, которое называется активированным комплексом, p определяется энтропией образования активированного комплекса.
![]() , SA
может быть и «+» и «–».
, SA
может быть и «+» и «–».
Если SA>>0, то p>1 (быстрые реакции – быстрее, чем по уравнению Аррениуса)
Если SA≈0, то p≈1 («нормальные» реакция)
Если SA<<0, то p<1 («медленные» реакции)
![]()
![]()
Из уравнения Аррениуса , что скорость химической реакции зависит от температуры.
Влияние температуры на скорость химических реакций определяется уравнением Вант-Гоффа.
![]() , Q10
– коэффициент Вант-Гоффа (равен отношению
температур, отличающихся на 10º).
, Q10
– коэффициент Вант-Гоффа (равен отношению
температур, отличающихся на 10º).
⇒ Если ЕА достаточно высока, то влияние температуры будет заметно, Q10=1,4÷2,5. Если ЕА мало, то Q10 близок к 1.
