
- •Введение
- •1.Основные понятия химической кинетики
- •2. Влияние концентрации реагирующих веществ на скорость реакции
- •2.1. Гомогенные реакции
- •2.2. Гетерогенные реакции
- •3. Влияние температуры на скорость химической реакции
- •4. Механизм протекания химических реакций
- •5. Влияние катализатора на скорость химических реакций
- •Заключение
4. Механизм протекания химических реакций
Как было показано ранее, скорость химических реакций в значительной мере зависит от энергии активации. Что такое энергия активации и почему она влияет на скорость реакции? Для ответа на этот вопрос необходимо хотя бы в общем виде рассмотреть механизм реакции.
В ходе химической реакции разрушаются одни и возникают другие молекулы и соединения, происходит изменение химических связей, то есть перераспределение электронной плотности. Если бы старые химические связи в ходе реакции сразу полностью разрушались, то на это потребовалось бы большое количество энергии, и реакция протекала бы крайне медленно. Как показали исследования, в ходе реакции система проходит через переходное состояние, которое заключается в образовании так называемого переходного комплекса. Например, ход реакции
А2 + В2 = 2АВ
можно представить схемой
А
– А А
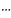 А А А
А А А
+
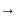
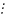

В – В В В В В
Продукты реакции (конечное
состояние)
Активированный комплекс
(переходное состояние)
Исходные реагенты (начальное
состояние)
состояние



В активированном комплексе старые связи еще не разорваны, но уже ослаблены, новые связи наметились, но еще не образовались. Активированный комплекс характеризуется большим запасом энергии. Неустойчивый активированный комплекс существует очень короткое время. Он распадается с образованием исходных веществ или продуктов реакции; при этом энергия выделяется.
Именно
для образования активированного
комплекса и необходима энергия
активации. Система в переходном состоянии
имеет более высокую энергию, чем в
исходном и конечном состояниях
Квантово-химические расчеты показывают, что изменение потенциальной энергии при этом в ходе реакции происходит так, как показано на
рис 2.


Ход реакции
Рис.2. Энергетическая диаграмма хода реакции с образованием активированного комплекса.
По мере сближения реагирующих молекул потенциальная энергия системы Е растет и достигает в некоторой точке максимума.
В состоянии, соответствующем точке максимума потенциальной энергии система из 4-х атомов представляет нечто целое, по своим свойствам похожее на нестойкую четырехатомную молекулу (активированный комплекс или переходное состояние).
При дальнейшем сближении молекул прочность связей А – А и В - В начинает убывать, а связь А - В усиливается. Потенциальная энергия системы начинает убывать и, наконец, система переходит в конечное состояние. Как видно из рис2, реагирующее система, прежде чем перейти в конечное состояние, дoлжна преодолеть потенциальный барьер, равный энергии активации Е.
Активированный комплекс, возникший из исходных веществ, может превратиться только в конечные вещества. Атомы, достигая конфигурации активированного комплекса, продолжают двигаться по инерции в направлении образования конечных продуктов.
В случае обратимых реакций активированный комплекс для обратной реакции имеет ту же конфигурацию, что и активированный комплекс для прямой реакции. Поэтому нельзя считать, что активированный комплекс находится в равновесии с исходными продуктами реакции.
