
- •Введение
- •1.Основные понятия химической кинетики
- •2. Влияние концентрации реагирующих веществ на скорость реакции
- •2.1. Гомогенные реакции
- •2.2. Гетерогенные реакции
- •3. Влияние температуры на скорость химической реакции
- •4. Механизм протекания химических реакций
- •5. Влияние катализатора на скорость химических реакций
- •Заключение
ПЕНЗЕНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Кафедра «Химия»
«УТВЕРЖДАЮ»
Заведующий кафедрой «Химия»
Профессор, д.х.н. Ю.Перелыгин
«____»______________ 2012 г.
ТЕКСТ ЛЕКЦИИ №
по дисциплине «Химия»
по специальности 200100 «Приборостроение»
Тема № . Основные закономерности протекания химических реакций
Занятие № . Химическая кинетика
Текст лекции обсужден на заседании ПМК №__ кафедры «Химия» «___»____________ 2012 г., протокол №_____
г. Пенза
Содержание
Введение
1. Основные понятия химической кинетики.
2. Влияние концентрации реагирующих веществ на скорость реакции.
3. Влияние температуры на скорость химической реакции.
4. Механизм протекания химических реакций.
5. Влияние катализатора на скорость химических реакций.
Заключение.
Литература:
Коровин Н.В. Общая химия. Учебник. – М.: Высшая школа, 1998. – с. 167 - 201.
Учебно – материальное обеспечение:
1. Мультимедийный проектор.
2. Установка для демонстрации гомогенного катализа.
3. Учебный фильм «Гетерогенный катализ».
4. Плакаты «Энергетическая диаграмма хода реакции с образованием активированного комплекса», «Энергетическая диаграмма каталитической реакции».
Цель занятия:
Знать: 1.Скорость химических реакций в гомогенных и гетерогенных системах. Факторы, влияющие на скорость реакции. Закон действующих масс для гомогенных и гетерогенных систем. Константа скорости и ее физический смысл.
2. Влияние температуры на скорость реакции. Правило Вант-Гоффа. Теория активации. Уравнение Аррениуса. Влияние природы реагентов на скорость реакции. Механизмы химических реакций.
3. Катализаторы и их влияние на скорость реакции. Механизм их действия.
Ознакомиться: с механизмом образования активированного комплекса.
Организационно-методические указания:
1.Проверить наличие обучаемых и их готовность к занятиям, устранить недостатки.
2.Объявить тему и цель занятия, учебные вопросы, литературу.
3.Обосновать необходимость изучения данной темы.
4.Рассмотреть учебные вопросы с применением плакатов «Энергетическая диаграмма хода реакции с образованием активированного комплекса», «Энергетическая диаграмма каталитической реакции».
5.По каждому учебному вопросу и в конце занятия подвести итоги.
6.В конце занятия выдать задание на самоподготовку.
Введение
Как было показано ранее, химическая термодинамика позволяет предсказать принципиальную возможность или невозможность самопроизвольного течения химических реакций, а также рассчитать равновесные концентрации реагирующих веществ. Однако, знание рассмотренных закономерностей еще недостаточно, чтобы предсказать реальную возможность химической реакции, определить скорость реакции и ее механизм, а также управлять процессом. Быстрота реакции зачастую не связана со значением ее энергии Гиббса. Например, термодинамическая вероятность реакции окисления водорода до воды
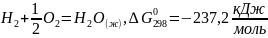
значительно выше, чем вероятность реакции нейтрализации с образованием воды
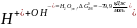
В то же время первая реакция при обычных условиях без катализатора практически не идет, а вторая реакция протекает практически мгновенно. Скорость и механизм химических реакций изучает химическая кинетика.
1.Основные понятия химической кинетики
Химическая кинетика – изучает скорость химической реакции и зависимость ее от различных факторов, а также механизм протекания химических реакций.
Скоростью химической реакции называют число элементарных актов реакции, происходящих в единицу времени.
Скорость химической реакции зависит от:
концентрации реагирующих веществ;
температуры;
присутствия катализаторов;
природы реагирующих веществ;
степени измельчения твердого вещества;
перемешивания, если вещества находятся в растворенном состоянии.
Совокупность реагирующих веществ, мысленно или реально выделенная их окружающей среды, называется химической системой.
Фаза – однородная часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства изменяются скачком.
Система, состоящая из одной фазы, называется гомогенной. Система, состоящая из двух или более фаз, называется гетерогенной.
Химическая реакция, протекающая в гомогенной системе, называется гомогенной реакцией. Химическая реакция, протекающая в гетерогенной системе, называется гетерогенной реакцией.
Гомогенными являются процессы в растворах и реакции между газами.
Гетерогенные реакции протекают в тех случаях, когда в системе имеется поверхность раздела (твердое тело - жидкость, твердое тело - газ, жидкость - газ, две несмешивающиеся между собой жидкости и т.д.)
Для определения скорости реакции можно использовать и величины, пропорциональные числу актов: изменение концентрации, давления, окраски во времени.
Средней скоростью гомогенной реакции называется количество вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени в единице объема всей системы.
В математической форме:
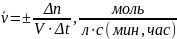 (1)
(1)
Величина
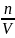 называется молярной концентрацией
вещества с. Таким образом, выражение
(1) для скорости можно переписать в
следующем виде:
называется молярной концентрацией
вещества с. Таким образом, выражение
(1) для скорости можно переписать в
следующем виде:
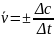 .
(2)
.
(2)
 C
учетом формулы (2) скорость химической
реакции можно определить следующим
образом:
C
учетом формулы (2) скорость химической
реакции можно определить следующим
образом:
Средней скоростью химической реакции называется изменение концентрации какого-либо вещества, вступающего в реакцию или образующегося в результате реакции в единицу времени.

Концентрация с
 Продукты
Продукты

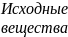
Время t
Рис.1. Изменение концентра-ции веществ в зависимости от вре-мени протекания реакции
Концентрации
исходных веществ со временем уменьшаются,
а концентрации продуктов реакции со
временем увеличиваются (рис.1). Скорость
же реакции всегда счита-ется постоянной
величиной. Поэто-му, если скорость
реакции измеряют по изменению убывающей
концентрации одного из веществ (рис.1)
то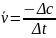
При
измерении скорости реакции с помощью
увеличивающейся концентрации одного
из продуктов реакции (рис.1)
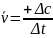 .
.
Истинная или мгновенная скорость химической реакции
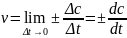 .
.
Задача.
Определить
среднюю скорость реакции
 ,
если за известное время
,
если за известное время
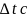 количество водорода уменьшилось на 3
моль, а количество азота – на 1 моль.
Реакция происходит в сосуде, который
занимает 1 л.
количество водорода уменьшилось на 3
моль, а количество азота – на 1 моль.
Реакция происходит в сосуде, который
занимает 1 л.
Решение:
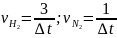 .
.
Вывод: Значения скорости химической реакции, определенные для различных веществ, участвующих в реакции, могут различаться. Поэтому при указании конкретного значения скорости следует указывать, для какого из реагирующих веществ она определялась.
Между
скоростями, определенными для различных
веществ одной и той же реакции, существует
взаимосвязь. Так, например, для реакции
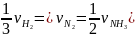 .
.
Мы рассмотрели, как определяется скорость гомогенных реакций. Гетерогенные реакции протекают не во всем объеме системы, а только на поверхности раздела фаз, поэтому для гетерогенной реакции определение скорости выглядит так:
Средней скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени на единице площади поверхности фазы (то есть поверхности, на которой протекает реакция).
 .
.
Площадь поверхности твердого тела не всегда легко измерить. Поэтому иногда скорость гетерогенной реакции относят не к единице площади поверхности, а к единице массы или объема твердой фазы.
