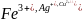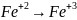- •Введение
- •1.Классификация химических реакций
- •2.Степень окисления элементов
- •2.1. Определение степени окисления
- •2.2. Элементы с постоянной степенью окисления
- •2.3. Элементы с переменной степенью окисления
- •2.4. Степень окисления с.О. Не всегда совпадает с валентностьюВ
- •2.5. Степень окисления может выражаться дробным числом:
- •3. Окислительно-восстановительные реакции
- •4. Окислительно-восстановительные свойства элемента в зависимости от степени окисления
- •5. Изменение окислительно-восстановительных свойств элементов (простых веществ) в периодической системе
- •6. Важнейшие окислители и восстановители
- •8. Классификация окислительно-восстановительных рекаций
- •8.1. Реакции межмолекулярного окисления-восстановления:
- •8.2. Реакции внутримолекулярного окисления-восстановления:
- •9. Влияние среды на направление овр
- •Заключение
5. Изменение окислительно-восстановительных свойств элементов (простых веществ) в периодической системе
Восстановители и окислители могут быть как простыми веществами, то есть состоящими из одного элемента, так и сложными. Рассмотрим, как изменяются окислительно-восстановительные свойства простых веществ, образованных элементами, в периодах и группах. Мы уже с Вами знаем, что металлы, содержащие на внешнем уровне один или два (редко – три) электрона, могут только отдавать электроны, то есть обладают только восстановительными свойствами. Неметаллы, имеющие на внешнем уровне от четырех до восьми электронов, могут не только отдавать, но и принимать электроны, то есть проявляют себя как окислители, так и восстановители.
В периодах слева направо восстановительные свойства простых веществ, образуемых элементами, понижаются, а окислительные – возрастают и становятся максимальными у галогенов. Так, например, в третьем периоде натрий – самый активный в периоде восстановитель, а хлор – самый активный в периоде окислитель.
У элементов главных подгрупп с повышением порядкового номера увеличиваются восстановительные свойства и ослабевают окислительные. Лучшие восстановители – щелочные металлы, а наиболее активные из них – франций и цезий. Лучшие окислители – галогены. Элементы главных подгрупп IV – VII групп (неметаллы) могут как отдавать, так и принимать электроны и проявлять как восстановительные, так и окислительные свойства. Исключение составляет фтор. Он проявляет только окислительные свойства, так как обладает наибольшей относительной электроотрицательностью.
Элементы побочных подгрупп имеют металлический характер, так как на внешнем уровне их атомов содержатся один или два электрона. Поэтому их простые вещества являются восстановителями.
Все сказанное можно выразить схемой:
Изменение окислительных свойств элементов в периодической системе
В периодах
с


F – самый
сильный окислитель
В главных подгруппах


Fr – самый
сильный восстановитель
В побочных подгруппах расположены только металлы, они характеризуются только восстановительными свойствами, которые изменяются немонотонно.
6. Важнейшие окислители и восстановители
Восстановители (доноры электронов) |
Окислители (акцепторы электронов) |
1. Атомы металлов и неметаллов, кроме инертных газов. Наиболее активны – s-металлы |
1. Атомы неметаллов. Самые сильные окислители
– галогены
|
2.
Простые анионы, образованные
неметаллами:
|
2. Катионы металлов, например:
|
3.
Соединения, содержащие элементы,
которые могут повышать степень
окисления, например:
|
3.
Соединения, содержащие элементы,
которые могут понижать степень
окисления, например:
|
4. Электрический ток на катоде |
4. Электрический ток на аноде |
7. Составление уравнений окислительно-восстановительных реакций методом электронного баланса основано на том, что число электронов, отдаваемых восстановителями, равно числу электронов, принимаемых окислителями.
Рассмотрим применение этого метода на примере реакции между цинком и дихроматом калия.
1.
Определяем степени окисления элементов.
Находим элементы, изменяющие степени
окисления.
 +
+
 2.Составляем
схему электронного баланса реакции;
находим коэффициенты для восстановителя
и окислителя.
2.Составляем
схему электронного баланса реакции;
находим коэффициенты для восстановителя
и окислителя.


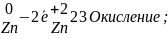

3. Уравниваем число атомов, не изменяющих степени окисления, в следующем порядке:
1) атомы металлов;
2) кислотные остатки (гидроксогруппы, если они есть);
3) атомы водорода.
4. Правильность расстановки коэффициентов проверяем по кислороду:
35 атомов О = 35 атомов О.

 ,
самые слабые - неметаллы IV
группы
,
самые слабые - неметаллы IV
группы