
Абсорбция.
В системе, состоящей из газа и соприкасающейся с ним жидкости, молекулы газа, ударяющийся о поверхность жидкости, растворяются в ней. Эти растворяемые молекулы, продолжая двигаться, частично возвращаются в газовую фазу, а частично остаются в жидкой фазе. Растворение молекул газа в жидкости будет продолжаться до достижения состояния равновесия. Концентрация газа, растворенного в жидкой фазе, зависит от парциального давления над поверхностью жидкости.
Согласно правилу фаз Гиббса система состоящая из жидкости и растворенного в ней газа, имеет две степени свободы:
С=К+2-Ф=2+2-2=2
Следовательно, состояние системы определяется температурой и давлением. При постоянной температуре растворяемость газа зависит от давления системы.
По закону Генри растворимость газа в жидкости прямо пропорциональна его парциальному давлению:
 ;
;
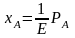
где - концентрация газа, растворенного в
жидкости;
- концентрация газа, растворенного в
жидкости;
 -
парциальное давление газа над жидкостью;
-
парциальное давление газа над жидкостью;
 -
const
Генри;
-
const
Генри;
 -
коэффициент, зависящий от свойств газа
и жидкости.
-
коэффициент, зависящий от свойств газа
и жидкости.
Основное уравнение равновесия (закон Дальтона)



 -
коэффициент распределения или const
фазового равновесия.
-
коэффициент распределения или const
фазового равновесия.

С повышением температуры константа m как правило, увеличивается, следовательно, растворимость газа снижается. (Исключение составляют растворимости азота и водорода в углеводородах, у которых растворимость увеличивается с повышением температуры)
Абсорбция – процесс разделения газовых смесей путем избирательного поглощения отдельных компонентов смеси жидким поглотителем – абсорбентом.
Поглощение газа может происходить либо за счет его растворения в абсорбенте, либо в результате его химического взаимодействия с абсорбентом. В первом случае процесс называют физической абсорбцией, а во втором – хемосорбцией. Возможно также сочетание обоих механизмов процесса. Поглощаемые компоненты газовой смеси условимся называть абсорбтивом, непоглощаемые – инертом.
В химической технологии абсорбция используется для:
1. получения целевых продуктов (абсорбция HCl водой в производстве азотной кислоты и т.д.)
2. выделение ценных компонентов газовых смесей (бутан-бутиленовой фракции из контактного газа в производстве СК, ацетилена из газов крекинга и т.д.);
3. удаление вредных примесей из газовых смесей.
Механизм процесса абсорбции состоит в следующем. На поверхности раздела фаз имеются два пограничных слоя – жидкий и газообразный. Молекула газа прежде чем проникнуть в толщу жидкости, должна пройти эти два слоя. Перемещение молекул через газовую и жидкую пленку может происходить только путем диффузии, скорость диффузии зависит от разности парциальных давлений газа в общей массе и в пленке. Эта разность является движущей силой процесса абсорбции.
Если парциальное давление или концентрация компонента в газовой фазе будет больше чем жидкости – процесс абсорбции; если концентрация компонентов в жидкой фазе больше, чем в газовой – процесс десорбции.
Сравним процессы абсорбции и ректификации.
Общее между ними:
1. Применяются для разделения смесей;
2. Относятся к массообменным процессам.
3. Движущая сила – разность парциальных давлений или концентраций.
Различия:
Ректификация – двухсторонний массообменный процесс: паровая фаза обогащается НКК, а жидкая ВКК.
1. Абсорбция – основной массообменный процесс за счет перехода каких-то компонентов из газовой фазы в жидкую. При этом считаем, что летучесть абсорбента мала, т.е. нет перехода компонентов из жидкой фазы в газовую.
2. Абсорбция является процессом избирательным. Каждый абсорбент обладает способностью в заметных количествах поглощать одни компоненты, тогда как другие компоненты поглощаются не значительно или вовсе не поглощаются. Большое влияние на процесс абсорбции оказывают также температура и давление.
3. В процессе абсорбции газов жидкостью выделяется тепло, называемое теплотой абсорбции. При отсутствии химического взаимодействия между абсорбентом и абсорбируемым газом теплота абсорбции численно равна скрытой теплоте конденсации. В случае химического взаимодействия необходимо также учитывать теплоту реакции. Теплоту абсорбции необходимо отводить, т.к повышение температуры абсорбентов резко ухудшает процесс абсорбции.
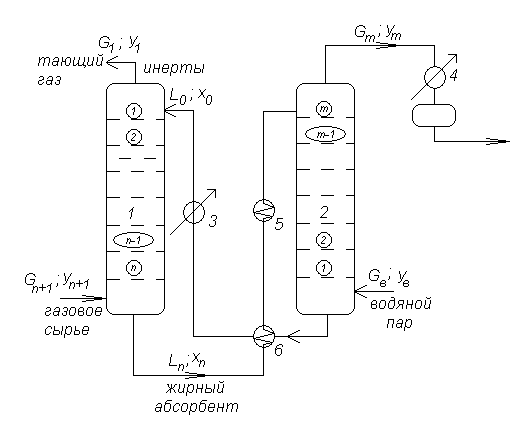
Рис. Принципиальная схема абсорбционно – десорбционной установки.
1-абсорбер; 2-десорбер; 3-холодильник; 4-конденсатор; 5-нагреватель; 6-теплообменник.
Здесь вводится понятие относительной концентрации, т.е. концентрация по отношению компонента в каком-то определенном потоке.
 -
количество жирного газа;
-
количество жирного газа;
 - относительная концентрация компонента;
- относительная концентрация компонента;
 - количество «тощего» абсорбента;
- количество «тощего» абсорбента;
 - относительная концентрация извлекаемого
компонента в тощем абсорбенте;
- относительная концентрация извлекаемого
компонента в тощем абсорбенте;
 - количество насыщенного абсорбента;
- количество насыщенного абсорбента;
 - количество сухого газа;
- количество сухого газа;
 - относительная кия извлекаемого
компонента в сухом газе;
- относительная кия извлекаемого
компонента в сухом газе;
 - количество отпаривающего агента;
- количество отпаривающего агента;
 - относительная кия извлекаемого
компонента в отпаривающем агенте;
- относительная кия извлекаемого
компонента в отпаривающем агенте;
показывает степень регенерации. Если регенерация 100%, то =0
Выразим относительную концентрацию через абсолютную.








Основные показатели абсорбции.
Основными показателями абсорбции являются коэффициент извлечения и эффективность извлечения.
Коэффициент извлечения - отношение количества поглощенного компонента к его содержанию в исходной смеси.
 .
.
При
полном извлечении
 .
Тогда
.
Тогда
 .
Во всех остальных случаях
<1.
.
Во всех остальных случаях
<1.
Эффективность
извлечения
 -
отношение количества поглощенного
компонента к теоретическому, достигаемому
в условиях равновесия между уходящим
из абсорбента газом и вводимым
абсорбентом.
-
отношение количества поглощенного
компонента к теоретическому, достигаемому
в условиях равновесия между уходящим
из абсорбента газом и вводимым
абсорбентом.
 .
.
Когда
в «тощем» абсорбенте
 ,
тогда
,
тогда

Требования к абсорбентам.
высокая абсорбционная способность;
селективность;
низкое давление паров;
некоррозионность;
нетоксичность;
огне – взрывобезопасность;
доступность, низкая стоимость.
Абсорбенты выбирают по растворимости в них поглощаемых компонентов.
Растворимость зависит от:
Физико – химических свойств газа и жидкости;
От температуры;
От давления.
Расчет простой абсорбции.
Если количество извлекаемого компонента мало, то процесс извлечения можно рассчитать графически, используя кривую равновесия.

Кривая равновесия строится на основе экспериментальных данных, либо расчетным путем.
Для нахождения оперативной линии составим уравнение материального баланса процесса абсорбции по внешним потокам:
 (1)
(1)
(конц.абсолютные)
Перепишем
 (2)
(2)
В относительных концентрациях
 (3)
(3)
 (4)
(4)
Обозначим
 -удельный
расход абсорбента
(5)
-удельный
расход абсорбента
(5)
Решая совместно уравнения (4) и (5), получим:
 (6)
(6)
Запишем уравнения материального баланса по произвольному сечению:
 (7)
(7)
 (8)
(8)
Так как уравнения типа (8) можно составить для любого сечения колонны, то в общем виде удельный расход абсорбента равен:
 ,
т.е. удельный расход определяется
разностью концентраций паровой и жидкой
фаз.
,
т.е. удельный расход определяется
разностью концентраций паровой и жидкой
фаз.
Так как потоки встречные, то это не что иное, как уравнение оперативной линии.
При абсорбции концентрация поглощаемого компонента в газе выше равновесной, поэтому на диаграмме «X-Y» рабочая линия располагается выше кривой равновесия.

Положение оперативной линии, т.е. угол её наклона, влияет на число теоретических тарелок.

Чем
больше
 ,
тем больше
,
тем больше
 ,
тем меньше тарелок.
,
тем меньше тарелок.

Расчет по методу Кремсера
Связь между числом теоретических тарелок абсорбера, коэффициентом извлечения и фактором абсорбции удобно представлять соответствующей диаграммой.
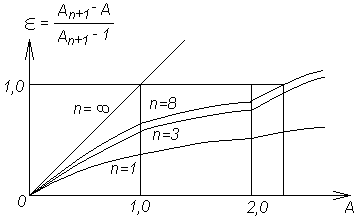
График Кремсера.
С помощью этой диаграммы и ведется расчет абсорберов, работающих на тощих газах с небольшим начальным содержанием извлекаемых компонентов. Эта же упрощенная методичка обычно используется для предварительного расчета тарелок аппарата при абсорбции жирных газов.
Поверхностные абсорберы.
К ним относятся широко распространенные в химической промышленности насадочные абсорберы. Они представляют собой колонны, снабженные колосниковыми или плоскими перфорированными решетками, которые загружаются насадкой в виде мелких тел различной формы. Решетки служат опорой для загружаемого слоя насадки и для равномерного распределения поступающего снизу газового потока. Над слоем насадки располагаются устройства для равномерного распределения абсорбента по сечению колонны. Контакт газа с абсорбентом происходит в основном по поверхности смоченной насадки.
Разнообразие применяемых насадок объясняется множеством предъявляемых к ним требований, среди которых: большая удельная поверхность и большой свободный объем, малое гидравлическое сопротивление газовому потоку, равномерное распределение абсорбента, хорошая смачиваемость, низкая стоимость и т.д. В настоящее время применяются: хордовая насадка (решетка из досок толщиной 10-15мм и высотой 100-150мм); коксовая кварцевая – куски дробленного кокса и кварца; кольца Рашига – тонкостенные керамические цилиндры высотой равной их наружному диаметру. Для увеличения удельной поверхности насадки предложены кольца с перегородкой, с крестообразной перегородкой и т.д.

Первоначальное распределение жидкости не сохраняется при дальнейшем по насадке. Как правило, восходящий поток газа занимает центральную область слоя насадки, оттесняя жидкость к периферии. Это приводит к тому, что действительная поверхность контакта взаимодействующих фаз меньше теоретической, т.е. реальная массообменная способность абсорбера меньше теоретической. Для исключения неравномерного распределения потоков прибегают к секционированию слоя насадки (устанавливают перераспределительные решетки).
Для насадок, засыпанных впавал




Для насадок из регулярно уложенных колец
а) при работе под атмосферным давлением




б) под вакуумом (остаточное давление до 41 Па)





 -
удельная поверхность насадки
-
удельная поверхность насадки

