
Простые вещества
О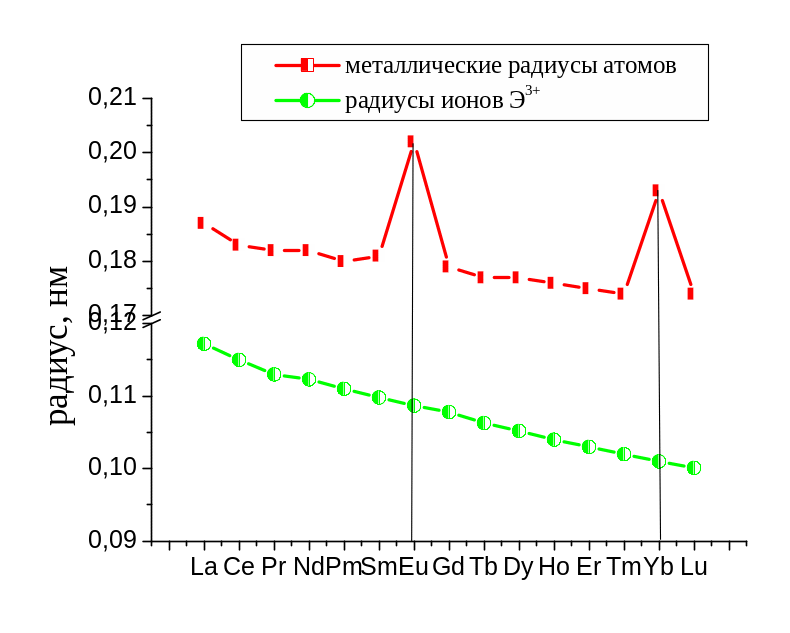
 ни
представляют собой тугоплавкие
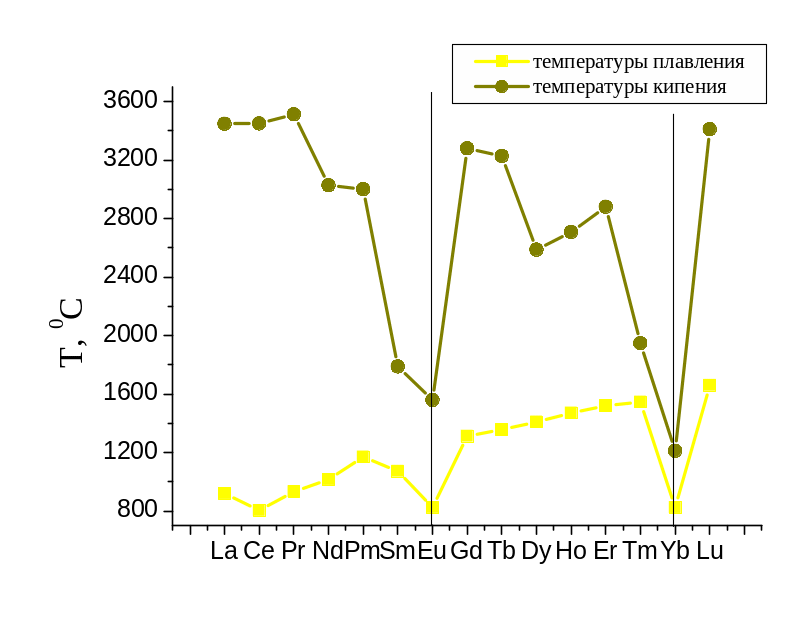
серебристо-белые металлы. Их температуры
плавления лежат в интервале 800-16000С
и изменяются немонотонно. По подсемействам
температуры плавления в целом возрастают,
но при переходе к европию и иттребию
резко (на несколько сотен градусов)
уменьшаются (слайд 15.8). Причина столь
аномально низких температур плавления
– аномально высокие радиусы атомов. В
ряду лантаноидов металлические радиусы
атомов в целом слабо уменьшаются, но
при этом у европия и иттербия они
аномально велики. Подобная аномалия
наблюдалась у марганца (электронная
конфигурация 3d54s2),
здесь тоже она наблюдается у атомов с
наполовину и полностью заполненным
f-подуровнем.
ни
представляют собой тугоплавкие
серебристо-белые металлы. Их температуры
плавления лежат в интервале 800-16000С
и изменяются немонотонно. По подсемействам
температуры плавления в целом возрастают,
но при переходе к европию и иттребию
резко (на несколько сотен градусов)
уменьшаются (слайд 15.8). Причина столь
аномально низких температур плавления
– аномально высокие радиусы атомов. В
ряду лантаноидов металлические радиусы
атомов в целом слабо уменьшаются, но
при этом у европия и иттербия они
аномально велики. Подобная аномалия
наблюдалась у марганца (электронная
конфигурация 3d54s2),
здесь тоже она наблюдается у атомов с
наполовину и полностью заполненным
f-подуровнем.
По свойствам лантаноиды весьма напоминают лантан и его аналогов, то есть являются весьма активными, уступающими лишь щелочным и щелочноземельным металлам. На воздухе при нагревании воспламеняются и сгорают, давая смесь оксидов (CeO2, Pr6O11, Tb4O7, остальные – Э2О3) и нитридов (до ЭN). С фтором, хлором реагируют без нагревания (ЭCl3), с прочими галогенами, серой (Э2S3), углеродом, водородом – при нагревании.
В водных средах эти металлы также очень активны. В ряду напряжений они стоят далеко до водорода и имеют 0 от –2,48 у церия до –2,25 у лютеция (при этом 0 неуклонно уменьшается по абсолютной величине), поэтому легко взаимодействуют не только с кислотами, но и водой (особенно горячей и в присутствии кислорода). Металлы устойчивы к воздействию HF и H3PO4 благодаря образованию на поверхности нерастворимых фторидов и фосфатов.
La |
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
-2,52 |
-2,48 |
-2,46 |
-2,43 |
-2,42 |
-2,41 |
-2,40 |
-2,40 |
|
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
|
-2,39 |
-2,35 |
-2,32 |
-2,30 |
-2,28 |
-2,27 |
-2,25 |
Отношение к простым веществам:
Дают продукты стехиометрического состава: CeO2, Pr6O11, Tb4O7, остальные – Э2О3, ЭГ3, Э2S3, ЭN. С углеродом - ЭС2, Э2С3, ЭС. С водородом - МеН3-х, х=0-1. Мелкораздробленные металлы на воздухе самовоспламеняются.
Отношение к воде:
Э + 3H2O ® Э(OH)3 + 3/2H2
Отношение к кислотам-неокислителям:
2Э + 3H2SO4® Э2(SO4)3 + 3H2
При этом образуются аквакомплексы, в которых катионы проявляют разные координационные числа: 6-9.
Отношение к кислотам-окислителям:
8Э + 30HNO3(разб.) ® 8Э(NO3)3 + 3NH4NO3 + 9H2O
Э + 6HNO3(конц.) ® Э(NO3)3 + 3NO2 + 3H2O
Получение:
Два минерала имеют промышленное значение - монацит (смешанный фосфат лантана, тория и лантанидов) и бастнезит (фторокарбонат лантана и лантанидов MCО3F).
Применяют два метода получения металлов.
1. Электролиз расплавов солей. Смесь LnCl3 с NaCl или СаСl2 расплавляют и подвергают электролизу в стальной ячейке с графитовой или огнеупорной футеровкой. Ячейка служит катодом, а графитовый стержень — анодом. Этот метод применяется, в первую очередь, для получения мишметалла, более легкого и плавящегося при более низкой температуре церия, а также самария, европия и иттербия, для которых 2-й метод дает ионы Ln(II).
2. Металлотермическое восстановление. Этот метод заключается в восстановлении безводных галогенидов металлическим кальцием. Более предпочтительны фториды, поскольку они негигроскопичны, а получаемый CaF2 устойчив, в отличие от других галогенидов кальция, кипящих при температурах, которые достигаются при проведении процесса. Смесь (LnF3 + Ca) нагревают в атмосфере аргона в танталовом тигле до температуры на 50° выше температуры плавления лантанида. После завершения реакции загрузку охлаждают, а шлак и металл (97-99% чистоты) по отдельности измельчают. Основной примесью является кальций, который удаляют плавкой под вакуумом. Этот метод применим для всех лантанидов за исключением самария, европия и иттербия.
Особую проблему представляет разделение лантаноидов, применяются экстракционные и ионообменные методы.
Свойства важнейших соединений
La |
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
А |
|
|||||||||||||
|
В |
В (при высоком давлении) |
||||||||||||
|
С |
|||||||||||||
Оксиды лантанидов Ln2О3 относятся к сильно основным, причем чем меньше атомный номер лантанида, тем основность выше. В воде оксиды лантанидов не растворяются, но поглощают ее с образованием гидроксидов. По химической природе они основны, то есть растворяются в кислотах, а со щелочами практически не реагируют. Оксиды легко растворяются в водных растворах кислот, давая ионы [Ln(H2О)9]3+, при условии, что для подавления гидролиза поддерживается рН < 5.
Э2О3 + 6HCl + (n-3)H2O ® 2[Э(H2O)9]Cl3
Из этих растворов можно осадить гидратированные гидроксиды при добавлении водных растворов аммиака или щелочей.
В присутствии окислителей в щелочных средах оксиды лантаноидов с переменной степенью окисления способны проявлять восстановительные свойства, а в присутствии восстановителей и кислотных реагентов стабилизируются низкие степени окисления.
Восстановительные свойства:
Tb2O3 + 4NaOH + 1/2O2 ® 2Na2TbO3 + 2H2O
Окислительные свойства:
Eu2O3 + 2TiO2 + H2 ® 2EuTiO3 + H2O
La(OH)3 |
ПР |
Lu(OH)3 |
1·10-19 |
2,5·10-24 |
В ряду оксидов и гидроксидов кислотный их характер несколько усиливается, падает термическая устойчивость и растворимость гидроксидов.
Таким образом, наиболее характерны для Э+3 соли катионного типа, которые в растворах подвергаются слабому гидролизу по катиону.
[Э(H2O)n]+3 + Н2О [Э(H2O)n-1(ОН)]+2 + Н3О+
Известны оксиды состава ЭО2. Наиболее важный из них - получаемый при прокаливании бледно-желтый СеО2 со структурой флюорита, он довольно инертен
CeO2 + 2KOH ® K2CeO3 + H2O
CeO2 + 2K2S2O7 ® Ce(SO4)2 + 2K2SO4
однако свежеосажденный гидратированный диоксид церия СеО2·хН2О легко растворяется в кислотах. Аналогичные оксиды образуют прометий и тербий, РrO2 и ТbO2 (оба бурого цвета). Все три диоксида имеют структуру флюорита. Ce+4 по радиусу и большинству свойств соединений похож на Zr+4. Для него известны также фторид CeF4, немногочисленные соли Ce(ClO4)4, Ce(SO4)2.
Из оксидов состава ЭО подтверждено только существование блестящих золотисто-желтых NdO и SmO, темно-красного ЕuО и серовато-белого YbO. Их получают при высоких температурах и, за исключением ЕuО, при высоких давлениях путем восстановления Ln2O3 металлическим Ln. Они имеют кристаллическую решетку типа NaCl.
Оксид ЕuО и соответствующий гидроксид основны и похожи на соответствующие соединения стронция.
EuO + 2HCl ® EuCl2 + H2O
EuO + 4HNO3(конц.) ® Eu(NO3)3 + NO2 + 2H2O
Сульфиды менее устойчивы, чем оксиды. Известны халькогениды лантанидов, составы которых подобны составам оксидов. В целом халькогениды устойчивы в сухой атмосфере, но гидролизуются во влажном воздухе. При нагревании на воздухе они окисляются (особенно сульфиды) до основных солей соответствующего оксоаниона. С кислотами взаимодействуют с выделением H2Z.
Монохалькогениды LnZ (Z = S, Se, Те) получены в основном взаимодействием простых веществ для всех лантанидов, кроме прометия. Почти все они черного цвета и, как и монооксиды, имеют структуру NaCl.
Халькогениды лантанидов (III) Ln2Z3 можно получать различными методами, в том числе и непосредственным взаимодействием простых веществ, а в случае сульфидов — действием H2S на хлорид или оксид. Халькогениды, как и Ln2O3, существуют в различных полиморфных модификациях.
При нагревании Ln2Z3 с избытком халькогена в запаянной трубке при 600°С образуются вещества, составы которых отвечают формуле LnZ2 или приближаются к ней. Они представляют собой, скорее всего, полихалькогениды Ln(III); халькогениды Ln(IV) неизвестны.
Сульфиды легко и необратимо гидролизуются, растворяются в кислотах, окисляются кислородом.
Э2S3 + H2O ® Э(OH)3 + H2S
Э2S3 + 6HCl + 2nH2O ® 2[Э(H2O)n]Cl3 + 3H2S
Э2S3 + O2 ® Э2O3 + SO2
Из галогенидов наиболее прочными являются фториды, при переходе к хлоридам и прочим галогенидам их устойчивость заметно снижается. По ряду лантаноидов устойчивость меняется мало, но сильно снижается у тригалогенидов европия и иттербия из-за пониженных валентных возможностей f-электронов. В воде нерастворимы только фториды. Прочие же галогениды в растворах ведут себя как соли: диссоциируют и гидролизуются по катиону.
Безводные тригалогениды представляют собой ионные, высокоплавкие кристаллические вещества, которые (кроме фторидов) сильно расплываются на воздухе. Координационное число Ln(III) изменяется в зависимости от ионного радиуса от 9 для трифторидов лантанидов с большим ионным радиусом до 6 для иодидов меньших по размеру ионов лантанидов. Тригалогениды применяются в основном для получения чистых металлов.
Дигалогениды получают из соответствующих тригалогенидов, чаще всего восстановлением самим лантанидом в виде металла. Все дигалогениды, за исключением ЕuХ2, очень легко окисляются и выделяют водород даже из воды.
Гидриды ЭН3 – солеподобные вещества с ионным характером связи. Имея в своем составе Н-1, являются весьма активными восстановителями.
Соединения церия в кислой среде – весьма сильные окислители (0Се+4/Се+3=1,61 В).
2CeO2 + 8HCl(конц.) ® 2CeCl3 + Cl2 + 4H2O
Эта степень окисления наиболее характерна для европия, и даже его соединения проявляют активные восстановительные свойства (0Eu+3/Eu+2 = -0.33 В).
