
- •1. Ферменты. Понятие. Строение. Понятие об активном центре. Коферменты.
- •2. Обмен фенилаланина и тирозина. Синтез катехоламинов, тироксина, меланинов. Биологическое значение.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 2
- •1. Обратимое и необратимое ингибирование ферментов, ферментные яды. Примеры.
- •2. Воздействие факторов физической природы на организм человека.
- •Вопрос 1:
- •1. Конкурентное ингибирование
- •1. Специфические и неспецифические ингибиторы
- •Вопрос 2:
- •Билет № 3
- •1. Конкурентное ингибирование. Принцип. Примеры. Пути реактивации ферментов при конкурентном ингибировании.
- •2. Гемоглобин. Синтез гема. Транспорт кислорода и со2. Типы и функциональные формы гемоглобина. Гемоглобинопатии.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 4
- •1. Понятие об аллостерических ферментах. Особенности строения и регуляции. Примеры.
- •2. Компоненты гуморального врожденного иммунитета. Механизмы защитного действия.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 5
- •1. Дезаминирование аминокислот. Обезвреживания аммиака. Токсичность аммиака.
- •2. Иммуноферментный анализ. Принцип. Применение для идентификации микроорганизмов.
- •Вопрос 1:
- •Вопрос 2:
- •Билет 6.
- •1.Оксидоредуктазы. Строение коферментов. Биологическая роль.
- •2. Биогенные амины как нейромедиаторы (катехоламины, серотонин, гамк, гистамин), их метаболизм. Нарушение обмена биогенных аминов при психических заболеваниях.
- •Вопрос1:
- •Вопрос 2:
- •Билет № 7
- •1. Общие принципы взаимодействия регуляторов с клетками-мишенями. Сигнальные пути.
- •2. Катаболизм гема, образование желчных пигментов. Нарушение обмена билирубина.
- •Вопрос 1:
- •1. Передача гормональных сигналов через мембранные рецепторы
- •2. Передача сигналов через внутриклеточные рецепторы
- •3. Передача сигналов через рецепторы, сопряжённые с ионными каналами
- •Вопрос 2:
- •Билет № 8
- •1. Факторы, определяющие нормальный уровень ферментативной активности биологических жидкостей. Причины, приводящие к изменению количества и активности ферментов в биологических жидкостях.
- •2. Воздействие факторов биологической природы на организм человека.
- •Вопрос 1:
- •Вопрос 2:пока засекречен Билет № 9
- •1. Окислительное декарбоксилирование пировиноградной кислоты. Характеристика мультиферментного комплекса пируватдегидрогеназы. Значение процесса.
- •2. Биохимические механизмы токсичности металлов (Pb, Cd, Hg).
- •Вопрос 1:
- •Вопрос2:пока засекречен Билет № 10
- •Вопрос 1:
- •Вопрос2:
- •Билет № 11
- •2. Классы иммуноглобулинов, классификация, функции в иммунном ответе. Клонально-селекционная теория синтеза антител.
- •Вопрос1:
- •Вопрос 2:
- •Билет № 17
- •Гормоны щитовидной железы. Тироксин и трийодтиронин. Строение, метаболизм. Механизм действия на клетки-мишени. Влияние на обмен веществ.
- •Фотометрический метод определения содержания аналитов и активности ферментов в биологических жидкостях. Принцип метода.
- •Вопрос 1:
- •Вопрос 2:пока засекречен Билет № 18
- •1 Регуляция уровня глюкозы в крови.
- •2 Витамин а. Потребность, источники, условия всасывания, транспорт. Биохимические функции. Признаки недостаточности.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 19
- •1. Глюконеогенез. Характеристика основных стадий, субстраты глюконеогенеза, регуляция, значение.
- •2. Метаболизм этанола. Биохимические механизмы токсического действия этанола.
- •Вопрос 1:
- •А. Реакции глюконеогенеза
- •1. Образование фосфоенолпирувата из пирувата - первая из необратимых стадий глюконеогенеза
- •2. Гидролиз фруктозо-1,6-бисфосфата и глюкоза-6-фосфата
- •3.Энергетический баланс глюконеогенеза из пирувата
- •Вопрос 2:
- •1. Синтез гликогена. Ход процесса, регуляция. Биологическое значение.
- •2. Витамины рр и в2. Потребность, источники. Коферментные формы и биохимические функции. Признаки недостаточности.
- •Вопрос 1:
- •Вопрос2:
- •Билет № 21
- •1. Глюкоза-6-фосфат – ключевое соединение в обмене углеводов. Источники и пути использования глюкозо-6-фосфата в клетке.
- •2. Основные этапы биосинтеза нуклеотидов. Биологическая роль. Антиметаболиты – ингибиторы процесса.
- •Вопрос 1:
- •Билет № 22
- •1. Распад гликогена. Регуляция. Биологическое значение. Гликогенозы.
- •2. Репликация. Основные этапы. Биологическая роль процесса.
- •Вопрос 1:
- •Вопрос 2:
- •1 Этап репликации: инициация
- •2 Этап репликации: элонгация
- •3 Этап репликации: терминация
- •Билет № 23
- •1. Молекулярная организация биологических мембран. Трансмембранный перенос веществ.
- •2. Структурная организация монооксигеназной системы окисления. Семейства цитохрома р450. Основные реакции, катализируемые изоферментами цитохрома р450.
- •Вопрос 1:
- •2. Трансмембранная асимметрия липидов
- •3. Жидкостность мембран
- •1. Первично-активный транспорт
- •2. Вторично-активный транспорт
- •Вопрос 2:
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •2. Функционирование цитохрома р450
- •3. Свойства системы микросомального окисления
- •Билет № 24
- •1. Инсулин. Синтез. Механизм действия на клетки-мишени. Физиологические эффекты.
- •2. Переваривание белков и всасывание аминокислот. Биохимическая ценность белков.
- •Вопрос 1:
- •1. Инсулин. Строение, синтез и секреция
- •2. Биологические функции инсулина
- •3. Механизм действия инсулина
- •Вопрос 2:
- •1. Образование и роль соляной кислоты
- •2.Механизм активации пепсина
- •Билет № 25
- •1. Переваривание липидов. Всасывание. Роль желчи. Нарушение процессов переваривания и всасывания липидов.
- •2. Транскрипция. Основные этапы, регуляция, значение. Посттрансляционный процессинг белка.
- •Вопрос 1:
- •Вопрос 2:
- •Билет №26
- •Вопрос 1:
- •Использование холестерина в организме
- •Вопрос 2:
- •Билет № 27
- •Вопрос 1:
- •Вопрос 2:пока засекречен Билет № 28
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 30
- •1. Метаболизм кетоновых тел. Роль кетоновых тел в норме и патологии.
- •2. Трансляция. Основные этапы. Антибиотики – ингибиторы трансляции.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 31
- •1. Депонирование и мобилизация триацилглицеринов. Регуляция.
- •2. Метаболическая биотрансформация ксенобиотиков. Реакции I фазы метаболизма.
- •Вопрос1:
- •Вопрос 2:
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •2. Функционирование цитохрома р450
- •3. Свойства системы микросомального окисления
- •Билет № 32
- •Вопрос 1:
- •Вопрос2:
- •Билет № 33
- •1. Липолиз. Регуляция, значение. Бетта-окисление высших жирных кислот. Энергетическая
- •2. Витамин д. Потребность, источники, метаболизм. Биохимические функции.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 34
- •1. Биосинтез высших жирных кислот. Характеристика мультиферментного комплекса пальмитат-синтетазы. Значение процесса.
- •Вопрос 1:
- •1. Синтез пальмитиновой кислоты
- •2. Регуляция синтеза жирных кислот
- •3. Синтез жирных кислот из пальмитиновой кислоты
- •Вопрос 2:
- •Билет № 35
- •1. Эссенциальные жирные кислоты как предшественники синтеза эйкозаноидов. Простагландины, их биологическая роль.
- •2. Биохимические основы канцерогенеза.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 36
- •1. Синтез нсi и его регуляция. Роль соляной кислоты в переваривании белков.
- •2. Система «ренин-ангиотензин-альдостерон», вазопрессин. Функции.
- •Вопрос 1:
- •1. Образование и роль соляной кислоты
- •2.Механизм активации пепсина
- •3.Возрастные особенности переваривания белков в желудке
- •4. Нарушения переваривания белков в желудке
- •Вопрос 2:
- •1. Синтез и секреция антидиуретического гормона
- •2. Механизм действия
- •3. Несахарный диабет
- •1. Механизм действия альдостерона
- •2. Роль системы ренин-ангиотензин- альдостерон в регуляции водно-солевого обмена
- •3. Восстановление объёма крови при обезвоживании организма
Вопрос 2:
Структура и функции гемоглобина
Гемоглобины - родственные белки, находящиеся в эритроцитах человека и позвоночных животных. Эти белки выполняют 2 важные функции:
перенос О2 из лёгких к периферическим тканям;
участие в переносе СО2 и протонов из периферических тканей в лёгкие для последующего выведения из организма.
Гемоглобины, так же как миоглобин, относят к гемопротеинам, но они имеют четвертичную структуру (состоят из 4 полипептидных цепей), благодаря которой возникает возможность регуляции их функций.
Гемоглобины взрослого человека
В эритроцитах взрослого человека гемоглобин составляет 90% от всех белков данной клетки.
Гемоглобин А - основной гемоглобин взрослого организма, составляет около 98% от общего количества гемоглобина, тетрамер, состоит из 2 полипептидных цепей
Гемоглобин A2 находится в организме взрослого человека в меньшей концентрации, на его долю приходится около 2% общего гемоглобина. Он состоит из 2
Гемоглобин А1с - гемоглобин А, модифицированный ковалентным присоединением к нему глюкозы (так называемый гликозилированный гемоглобин).
Гемоглобины, синтезирующиеся в период внутриутробного развития плода:
Эмбриональный гемоглобин синтезируется в эмбриональном желточном мешке через несколько недель после оплодотворения. Представляет собой тетрамер . Через 2 нед после формирования печени плода в ней начинает синтезироваться гемоглобин F, который к 6 мес замещает эмбриональный гемоглобин.
Гемоглобин F - фетальный гемоглобин, синтезируется в печени и костном мозге плода до периода его рождения. Имеет тетрамерную структуру, состоящую из 2 -цепей. После рождения ребёнка постепенно замещается на гемоглобин А, который начинает синтезироваться в клетках костного мозга уже на 8-м месяце развития плода.
Гем имеет высокое сродство к оксиду углерода (СО). В водной среде свободный от белковой части гем связывается с СО в 25 000 раз сильнее, чем О2. Высокая степень сродства гема к СО по сравнению с О2 объясняется разным пространственным расположением комплексов Fe2+ гема с СО и О2
В комплексе Fe2+ гема с СО атомы Fe2+, углерода и кислорода расположены на одной прямой, а в комплексе Fe2+ гема с О2 атомы железа и кислорода расположены под углом, что отражает их оптимальное пространственное расположение.
Снижение сродства гемсодержащих белков к СО имеет важное биологическое значение. СО образуется в небольших количествах при катаболизме некоторых веществ, в частности гема. Этот эндогенно образующийся СО блокирует около 1% гемсодержащих белков. Если бы сродство тема к СО не уменьшалось под влиянием белкового окружения, эндогенн
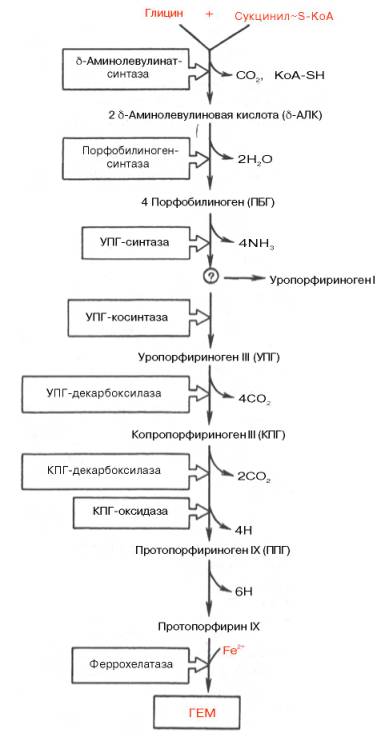
К настоящему времени почти полностью выяснены основные пути образования порфиринов и протопорфиринов, являющихся непосредственными предшественниками гема и хлорофилла. На I стадии, протекающей в 2 этапа, сукцинил-КоА взаимодействует с глицином и образованием δ-аминолевулиновой кислоты (δ-АЛК).
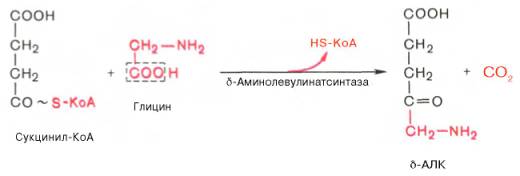
Эту стадию катализирует специфический пиридоксальфосфатзависимый фермент δ-аминолевулинатсинтаза – ключевой, аллостерический фермент синтеза тетрапирролов.
Впервые эта синтаза была обнаружена в эндоплазматической сети клеток печени. Фермент индуцируетсястероидами и другими факторами и ингибируется по типу обратной связи конечным продуктом биосинтеза –гемом.
На II стадии происходит конденсация 2 молекул δ-аминолевулиновой кислоты с образованием первого монопиррольного соединения – порфо-билиногена (ПБГ).
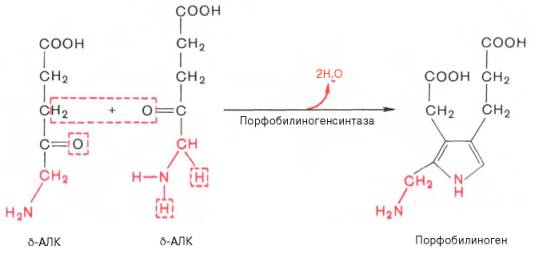
Фермент, катализирующий эту стадию,– порфобилиногенсинтаза также является регуляторным ферментом, подвергаясь ингибированию конечными продуктами синтеза. Предполагают, что механизм этой сложной реакции дегидратации включает образование кетиминной связи (шиффово основание) между кетогруппой одной молекулы δ-аминолевулиновой кислоты и δ-аминогруппой лизина молекулы фермента. В следующей многоступенчатой стадии, катализируемой соответствующими ферментами, из 4 монопиррольных молекул порфобилиногена синтезируется тетра-пиррольный комплекс протопорфирин IX, являющийся непосредственным предшественником гема. Некоторые этапы сложного пути синтеза окончательно не установлены.
В заключительной стадии протопорфирин IX присоединяет молекулу железа при участии феррохелатазы (гемсинтазы), и образуется гем. Последний используется для биосинтеза всех гемсодержащих хромопро-теинов.
Источником железа для этой реакции является ферритин, который считается резервным гемопротеином, откладывающимся в клетках костного мозга, печени и селезенки.
Имеются указания, что, помимо железа, в синтезе гема участвуют некоторые кофакторы, в частности витамин В12, ионы меди, хотя конкретная их роль не раскрыта.
Движущие силы переноса кислорода
- ток крови
- градиент концентраций кислорода между альвеолярным воздухом и межклеточной жидкостью.
В альвеолярном воздухе парциальное давление равно 100 мм. рт. ст. В межклеточной жидкости парциальное давление равно 35 мм. Рт. ст.;
разность концентраций в 65 мм.рт.ст., которая обеспечивает переход кислорода из альвеол в кровь, а из крови - в межклеточную жидкость.
Гемоглобин крови при парциальном давлении, которое имеется в альвеолярном воздухе, насыщается кислородом на 97%.
В венозной крови степень насыщения гемоглобина кислородом равна 64%. При изменении степени насыщения на 33% освобождается 6,6 мл кислорода – такое количество кислорода приносят тканям каждые 100 мл крови.
Транспорт углекислого газа
Примерно 15% углекислого газа, присутствующего в крови, переносится молекулами гемоглобина. Связывание кислорода тесно сопряжено с выдыханием углекислого газа. Это обратимое явление известно как эффект Бора
Гемоглобинопатии (haemoglobinopathia, единственное число; гемоглобин + греческий pathos страдание, болезнь; синонимы гемоглобиноз) — группа наследственных заболеваний, обусловленных наличием в эритроцитах аномальных гемоглобинов либо угнетением синтеза полипептидных цепей нормальных гемоглобинов. К Гемоглобинопатии причисляют как выраженные патологический состояния, протекающие чаще с гемолитической анемией (смотри), так и многочисленные случаи латентного носительства аномальных гемоглобинов или генов талассемии
К наиболее часто встречающимся и известным гемоглобинопатиям относятся серповидно-клеточная анемия, бета-талассемия, персистенция фетального гемоглобина. Гемоглобинопатии классифицируются на качественные и количественные. Качественные обусловлены заменой аминокислот в полипептидных цепях. Замена аминокислоты глутамина 6 на валин в β-цепи приводит к образованию аномального гемоглобина S, что лежит в основе развития серповидно-клеточной анемии. Аномальных гемоглобинов более 300, но не все аномалии проявляются. Первые аномальные гемоглобины назывались буквами латинского алфавита (М, С, Д, S и др.). Но, так как аномальных гемоглобинов много, их названия включают места открытия (Boston, Москва, Волга и др.) или названия госпиталей. Количественные гемоглобинопатии связаны со скоростью синтеза α- или β-полипептидных цепей глобина. Угнетение скорости синтеза α-цепи приводит к развитию α-талассемии, угнетение синтеза β-цепи лежит в основе заболевания β-талассемии. Гемоглобинопатии —наследственные заболевания. Диагностика гемоглобинопатий основывается, кроме клинических данных, на обязательном специальном исследовании электрофорезе гемоглобина. Это исследование проводится не только для больного, но и для ближайших родственников. Данные электрофореза гемоглобина позволяют поставить диагноз талассемии. Для альфа-талассемии характерно обнаружение гемоглобинов-гомотетрамеров Нв-Н и Нв-Bart.Для бета-талассемии характерно повышенное содержание гемоглобина Α2.
Порфирия
наследственное нарушение синтеза гема с повышенным содержанием порфиринов в крови и тканях и усиленным их выделением с мочой и калом. Проявляется фотодерматозом, гемолитическими кризами, желудочно-кишечными и нервно-психическими расстройствами.
