
- •1. Ферменты. Понятие. Строение. Понятие об активном центре. Коферменты.
- •2. Обмен фенилаланина и тирозина. Синтез катехоламинов, тироксина, меланинов. Биологическое значение.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 2
- •1. Обратимое и необратимое ингибирование ферментов, ферментные яды. Примеры.
- •2. Воздействие факторов физической природы на организм человека.
- •Вопрос 1:
- •1. Конкурентное ингибирование
- •1. Специфические и неспецифические ингибиторы
- •Вопрос 2:
- •Билет № 3
- •1. Конкурентное ингибирование. Принцип. Примеры. Пути реактивации ферментов при конкурентном ингибировании.
- •2. Гемоглобин. Синтез гема. Транспорт кислорода и со2. Типы и функциональные формы гемоглобина. Гемоглобинопатии.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 4
- •1. Понятие об аллостерических ферментах. Особенности строения и регуляции. Примеры.
- •2. Компоненты гуморального врожденного иммунитета. Механизмы защитного действия.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 5
- •1. Дезаминирование аминокислот. Обезвреживания аммиака. Токсичность аммиака.
- •2. Иммуноферментный анализ. Принцип. Применение для идентификации микроорганизмов.
- •Вопрос 1:
- •Вопрос 2:
- •Билет 6.
- •1.Оксидоредуктазы. Строение коферментов. Биологическая роль.
- •2. Биогенные амины как нейромедиаторы (катехоламины, серотонин, гамк, гистамин), их метаболизм. Нарушение обмена биогенных аминов при психических заболеваниях.
- •Вопрос1:
- •Вопрос 2:
- •Билет № 7
- •1. Общие принципы взаимодействия регуляторов с клетками-мишенями. Сигнальные пути.
- •2. Катаболизм гема, образование желчных пигментов. Нарушение обмена билирубина.
- •Вопрос 1:
- •1. Передача гормональных сигналов через мембранные рецепторы
- •2. Передача сигналов через внутриклеточные рецепторы
- •3. Передача сигналов через рецепторы, сопряжённые с ионными каналами
- •Вопрос 2:
- •Билет № 8
- •1. Факторы, определяющие нормальный уровень ферментативной активности биологических жидкостей. Причины, приводящие к изменению количества и активности ферментов в биологических жидкостях.
- •2. Воздействие факторов биологической природы на организм человека.
- •Вопрос 1:
- •Вопрос 2:пока засекречен Билет № 9
- •1. Окислительное декарбоксилирование пировиноградной кислоты. Характеристика мультиферментного комплекса пируватдегидрогеназы. Значение процесса.
- •2. Биохимические механизмы токсичности металлов (Pb, Cd, Hg).
- •Вопрос 1:
- •Вопрос2:пока засекречен Билет № 10
- •Вопрос 1:
- •Вопрос2:
- •Билет № 11
- •2. Классы иммуноглобулинов, классификация, функции в иммунном ответе. Клонально-селекционная теория синтеза антител.
- •Вопрос1:
- •Вопрос 2:
- •Билет № 17
- •Гормоны щитовидной железы. Тироксин и трийодтиронин. Строение, метаболизм. Механизм действия на клетки-мишени. Влияние на обмен веществ.
- •Фотометрический метод определения содержания аналитов и активности ферментов в биологических жидкостях. Принцип метода.
- •Вопрос 1:
- •Вопрос 2:пока засекречен Билет № 18
- •1 Регуляция уровня глюкозы в крови.
- •2 Витамин а. Потребность, источники, условия всасывания, транспорт. Биохимические функции. Признаки недостаточности.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 19
- •1. Глюконеогенез. Характеристика основных стадий, субстраты глюконеогенеза, регуляция, значение.
- •2. Метаболизм этанола. Биохимические механизмы токсического действия этанола.
- •Вопрос 1:
- •А. Реакции глюконеогенеза
- •1. Образование фосфоенолпирувата из пирувата - первая из необратимых стадий глюконеогенеза
- •2. Гидролиз фруктозо-1,6-бисфосфата и глюкоза-6-фосфата
- •3.Энергетический баланс глюконеогенеза из пирувата
- •Вопрос 2:
- •1. Синтез гликогена. Ход процесса, регуляция. Биологическое значение.
- •2. Витамины рр и в2. Потребность, источники. Коферментные формы и биохимические функции. Признаки недостаточности.
- •Вопрос 1:
- •Вопрос2:
- •Билет № 21
- •1. Глюкоза-6-фосфат – ключевое соединение в обмене углеводов. Источники и пути использования глюкозо-6-фосфата в клетке.
- •2. Основные этапы биосинтеза нуклеотидов. Биологическая роль. Антиметаболиты – ингибиторы процесса.
- •Вопрос 1:
- •Билет № 22
- •1. Распад гликогена. Регуляция. Биологическое значение. Гликогенозы.
- •2. Репликация. Основные этапы. Биологическая роль процесса.
- •Вопрос 1:
- •Вопрос 2:
- •1 Этап репликации: инициация
- •2 Этап репликации: элонгация
- •3 Этап репликации: терминация
- •Билет № 23
- •1. Молекулярная организация биологических мембран. Трансмембранный перенос веществ.
- •2. Структурная организация монооксигеназной системы окисления. Семейства цитохрома р450. Основные реакции, катализируемые изоферментами цитохрома р450.
- •Вопрос 1:
- •2. Трансмембранная асимметрия липидов
- •3. Жидкостность мембран
- •1. Первично-активный транспорт
- •2. Вторично-активный транспорт
- •Вопрос 2:
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •2. Функционирование цитохрома р450
- •3. Свойства системы микросомального окисления
- •Билет № 24
- •1. Инсулин. Синтез. Механизм действия на клетки-мишени. Физиологические эффекты.
- •2. Переваривание белков и всасывание аминокислот. Биохимическая ценность белков.
- •Вопрос 1:
- •1. Инсулин. Строение, синтез и секреция
- •2. Биологические функции инсулина
- •3. Механизм действия инсулина
- •Вопрос 2:
- •1. Образование и роль соляной кислоты
- •2.Механизм активации пепсина
- •Билет № 25
- •1. Переваривание липидов. Всасывание. Роль желчи. Нарушение процессов переваривания и всасывания липидов.
- •2. Транскрипция. Основные этапы, регуляция, значение. Посттрансляционный процессинг белка.
- •Вопрос 1:
- •Вопрос 2:
- •Билет №26
- •Вопрос 1:
- •Использование холестерина в организме
- •Вопрос 2:
- •Билет № 27
- •Вопрос 1:
- •Вопрос 2:пока засекречен Билет № 28
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 30
- •1. Метаболизм кетоновых тел. Роль кетоновых тел в норме и патологии.
- •2. Трансляция. Основные этапы. Антибиотики – ингибиторы трансляции.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 31
- •1. Депонирование и мобилизация триацилглицеринов. Регуляция.
- •2. Метаболическая биотрансформация ксенобиотиков. Реакции I фазы метаболизма.
- •Вопрос1:
- •Вопрос 2:
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •2. Функционирование цитохрома р450
- •3. Свойства системы микросомального окисления
- •Билет № 32
- •Вопрос 1:
- •Вопрос2:
- •Билет № 33
- •1. Липолиз. Регуляция, значение. Бетта-окисление высших жирных кислот. Энергетическая
- •2. Витамин д. Потребность, источники, метаболизм. Биохимические функции.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 34
- •1. Биосинтез высших жирных кислот. Характеристика мультиферментного комплекса пальмитат-синтетазы. Значение процесса.
- •Вопрос 1:
- •1. Синтез пальмитиновой кислоты
- •2. Регуляция синтеза жирных кислот
- •3. Синтез жирных кислот из пальмитиновой кислоты
- •Вопрос 2:
- •Билет № 35
- •1. Эссенциальные жирные кислоты как предшественники синтеза эйкозаноидов. Простагландины, их биологическая роль.
- •2. Биохимические основы канцерогенеза.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 36
- •1. Синтез нсi и его регуляция. Роль соляной кислоты в переваривании белков.
- •2. Система «ренин-ангиотензин-альдостерон», вазопрессин. Функции.
- •Вопрос 1:
- •1. Образование и роль соляной кислоты
- •2.Механизм активации пепсина
- •3.Возрастные особенности переваривания белков в желудке
- •4. Нарушения переваривания белков в желудке
- •Вопрос 2:
- •1. Синтез и секреция антидиуретического гормона
- •2. Механизм действия
- •3. Несахарный диабет
- •1. Механизм действия альдостерона
- •2. Роль системы ренин-ангиотензин- альдостерон в регуляции водно-солевого обмена
- •3. Восстановление объёма крови при обезвоживании организма
1. Синтез пальмитиновой кислоты
Образование ацетил-КоА и его транспорт в цитозоль
Синтез жирных кислот происходит в абсорбтивный период. Активный гликолиз и последующее окислительное декарбоксилирование пирувата способствуют увеличению концентрации ацетил-КоА в матриксе митохондрий. Так как синтез жирных кислот происходит в цитозоле клеток, то ацетил-КоА должен быть транспортирован через внутреннюю мембрану митохондрий в цитозоль. Однако внутренняя мембрана митохондрий непроницаема для ацетил-КоА, поэтому в матриксе митохондрий ацетил-КоА конденсируется с оксалоацетатом с образованием цитрата при участии цитратсинтазы:
Ацетил-КоА + Оксалоацетат -> Цитрат + HS-КоА.
Затем транслоказа переносит цитрат в цитоплазму .
Перенос цитрата в цитоплазму происходит только при увеличении количества цитрата в митохондриях, когда изоцитратдегидрогеназа и α-кетоглутаратдегидрогеназа ингибированы высокими концентрациями NADH и АТФ. Эта ситуация создаётся в абсорбтивном периоде, когда клетка печени получает достаточное количество источников энергии. В цитоплазме цитрат расщепляется под действием фермента цитратлиазы:
Цитрат + HSKoA + АТФ → Ацетил-КоА + АДФ + Pi + Оксалоацетат.
Ацетил-КоА в цитоплазме служит исходным субстратом для синтеза жирных кислот, а окса-лоацетат в цитозоле подвергается следующим превращениям .
Пируват транспортируется обратно в матрикс митохондрий. Восстановленный в результате действия малик-фермента NADPH используется как донор водорода для последующих реакций синтеза жирных кислот. Другой источник NADPH - окислительные стадии пентозофосфатного пути катаболизма глюкозы.
Образование малонил-КоА из ацетил-КоА - регуляторная реакция в биосинтезе жирных кислот.
Первая реакция синтеза жирных кислот - превращение ацетил-КоА в малонил-КоА. Фермент, катализирующий эту реакцию (ацетил-КоА-карбоксилаза), относят к классу лигаз. Он содержит ковалентно связанный биотин .В первой стадии реакции СО2 ковалентно связывается с биотином за счёт энергии АТФ, во второй стадии СОО- переносится на ацетил-КоА с образованием малонил-КоА. Активность фермента ацетил-КоА-карбоксилазы определяет скорость всех последующих реакций синтеза жирных кислот.
Реакции, катализируемые синтазой жирных кислот, - ферментным комплексом, катализирующим реакции синтеза пальмитиновой кислоты, описывается ниже.
После образования малонил-КоА синтез жирных кислот продолжается на мультиферментном комплексе - синтазе жирных кислот (пальмитоилсинтетазе). Этот фермент состоит из 2 идентичных протомеров, каждый из которых имеет доменное строение и, соответственно, 7 центров, обладающих разными каталитическими активностями .Этот комплекс последовательно удлиняет радикал жирной кислоты на 2 углеродных атома, донором которых служит ма-лонил-КоА. Конечный продукт работы этого комплекса - пальмитиновая кислота, поэтому прежнее название этого фермента - пальмитоилсинтетаза.
Первая реакция - перенос ацетильной группы ацетил-КоА на тиоловую группу цистеина ацетилтрансацилазным центром .Затем от малонил-КоА остаток малонила переносится на сульфгидрильную группу ацилпереносящего белка малонилтрансацилазным центром. После этого комплекс готов к первому циклу синтеза.
Ацетильная группа конденсируется с остатком малонила по месту отделившегося СО2. Реакция катализируется кетоацилсинтазным центром. Образовавшийся радикал ацетоацетила
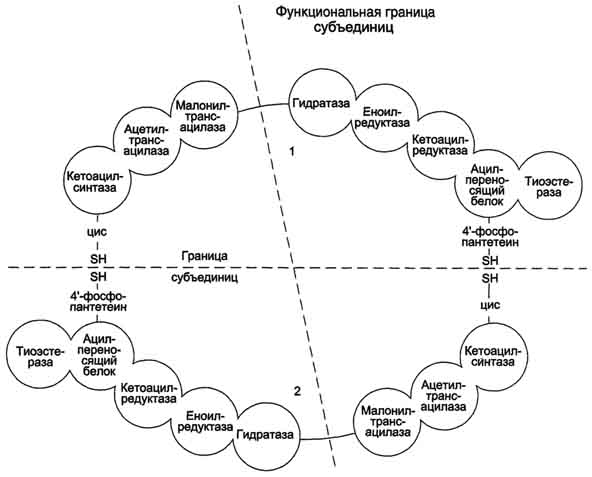
Строение мультиферментного комплекса - синтезы жирных кислот. Комплекс - димер из двух идентичных полипептидных цепей, каждый из которых имеет 7 активных центров и ацилпереносящий белок (АПБ). SH-группы протомеров принадлежат различным радикалам. Одна SH-группа принадлежит цистеину, другая - остатку фосфопантетеиновой кислоты. SH-группа цистеина одного мономера расположена рядом с SH-группой 4-фосфопантетеината другого протомера. Таким образом, протомеры фермента расположены "голова к хвосту". Хотя каждый мономер содержит все каталитические центры, функционально активен комплекс из 2 протомеров. Поэтому реально синтезируются одновременно 2 жирных кислоты. Для упрощения в схемах обычно изображают последовательность реакций при синтезе одной молекулы кислоты.
последовательно восстанавливается кетоацил-редуктазой, затем дегидратируется и опять восстанавливается еноилредуктазой - активными центрами комплекса. В результате первого цикла реакций образуется радикал бутирила, связанный с субъединицей синтазы жирных кислот.
Перед вторым циклом радикал бутирила переносится из позиции 2 в позицию 1 (где находился ацетил в начале первого цикла реакций). Затем остаток бутирила подвергается тем же превращениям и удлиняется на 2 углеродных атома, происходящих из малонил-КоА.
Аналогичные циклы реакций повторяются до тех пор, пока не образуется радикал пальмитиновой кислоты, который под действием тиоэстеразного центра гидролитически отделяется от ферментного комплекса, превращаясь в свободную пальмитиновую кислоту .
Суммарное уравнение синтеза пальмитиновой кислоты из ацетил-КоА и малонил-КоА имеет следующий вид:
CH3-CO-SKoA + 7 HOOC-CH2-CO-SKoA + 14 (NADPH + H+) → C15H31COOH + 7 СО2 + 6 Н2О + 8 HSKoA + 14 NADP+.
Основные источники водорода для синтеза жирных кислот
В каждом цикле биосинтеза пальмитиновой кислоты проходят 2 реакции восстановления,донором водорода в которых служит кофермент NADPH. Восстановление NADP+ происходит в реакциях:
дегидрирования в окислительных стадиях пентозофосфатного пути катаболизма глюкозы;
дегидрирования малата малик-ферментом;
дегидрирования изоцитрата цитозольной NADP-зависимой дегидрогеназой.
