- •1. Ферменты. Понятие. Строение. Понятие об активном центре. Коферменты.
- •2. Обмен фенилаланина и тирозина. Синтез катехоламинов, тироксина, меланинов. Биологическое значение.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 2
- •1. Обратимое и необратимое ингибирование ферментов, ферментные яды. Примеры.
- •2. Воздействие факторов физической природы на организм человека.
- •Вопрос 1:
- •1. Конкурентное ингибирование
- •1. Специфические и неспецифические ингибиторы
- •Вопрос 2:
- •Билет № 3
- •1. Конкурентное ингибирование. Принцип. Примеры. Пути реактивации ферментов при конкурентном ингибировании.
- •2. Гемоглобин. Синтез гема. Транспорт кислорода и со2. Типы и функциональные формы гемоглобина. Гемоглобинопатии.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 4
- •1. Понятие об аллостерических ферментах. Особенности строения и регуляции. Примеры.
- •2. Компоненты гуморального врожденного иммунитета. Механизмы защитного действия.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 5
- •1. Дезаминирование аминокислот. Обезвреживания аммиака. Токсичность аммиака.
- •2. Иммуноферментный анализ. Принцип. Применение для идентификации микроорганизмов.
- •Вопрос 1:
- •Вопрос 2:
- •Билет 6.
- •1.Оксидоредуктазы. Строение коферментов. Биологическая роль.
- •2. Биогенные амины как нейромедиаторы (катехоламины, серотонин, гамк, гистамин), их метаболизм. Нарушение обмена биогенных аминов при психических заболеваниях.
- •Вопрос1:
- •Вопрос 2:
- •Билет № 7
- •1. Общие принципы взаимодействия регуляторов с клетками-мишенями. Сигнальные пути.
- •2. Катаболизм гема, образование желчных пигментов. Нарушение обмена билирубина.
- •Вопрос 1:
- •1. Передача гормональных сигналов через мембранные рецепторы
- •2. Передача сигналов через внутриклеточные рецепторы
- •3. Передача сигналов через рецепторы, сопряжённые с ионными каналами
- •Вопрос 2:
- •Билет № 8
- •1. Факторы, определяющие нормальный уровень ферментативной активности биологических жидкостей. Причины, приводящие к изменению количества и активности ферментов в биологических жидкостях.
- •2. Воздействие факторов биологической природы на организм человека.
- •Вопрос 1:
- •Вопрос 2:пока засекречен Билет № 9
- •1. Окислительное декарбоксилирование пировиноградной кислоты. Характеристика мультиферментного комплекса пируватдегидрогеназы. Значение процесса.
- •2. Биохимические механизмы токсичности металлов (Pb, Cd, Hg).
- •Вопрос 1:
- •Вопрос2:пока засекречен Билет № 10
- •Вопрос 1:
- •Вопрос2:
- •Билет № 11
- •2. Классы иммуноглобулинов, классификация, функции в иммунном ответе. Клонально-селекционная теория синтеза антител.
- •Вопрос1:
- •Вопрос 2:
- •Билет № 17
- •Гормоны щитовидной железы. Тироксин и трийодтиронин. Строение, метаболизм. Механизм действия на клетки-мишени. Влияние на обмен веществ.
- •Фотометрический метод определения содержания аналитов и активности ферментов в биологических жидкостях. Принцип метода.
- •Вопрос 1:
- •Вопрос 2:пока засекречен Билет № 18
- •1 Регуляция уровня глюкозы в крови.
- •2 Витамин а. Потребность, источники, условия всасывания, транспорт. Биохимические функции. Признаки недостаточности.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 19
- •1. Глюконеогенез. Характеристика основных стадий, субстраты глюконеогенеза, регуляция, значение.
- •2. Метаболизм этанола. Биохимические механизмы токсического действия этанола.
- •Вопрос 1:
- •А. Реакции глюконеогенеза
- •1. Образование фосфоенолпирувата из пирувата - первая из необратимых стадий глюконеогенеза
- •2. Гидролиз фруктозо-1,6-бисфосфата и глюкоза-6-фосфата
- •3.Энергетический баланс глюконеогенеза из пирувата
- •Вопрос 2:
- •1. Синтез гликогена. Ход процесса, регуляция. Биологическое значение.
- •2. Витамины рр и в2. Потребность, источники. Коферментные формы и биохимические функции. Признаки недостаточности.
- •Вопрос 1:
- •Вопрос2:
- •Билет № 21
- •1. Глюкоза-6-фосфат – ключевое соединение в обмене углеводов. Источники и пути использования глюкозо-6-фосфата в клетке.
- •2. Основные этапы биосинтеза нуклеотидов. Биологическая роль. Антиметаболиты – ингибиторы процесса.
- •Вопрос 1:
- •Билет № 22
- •1. Распад гликогена. Регуляция. Биологическое значение. Гликогенозы.
- •2. Репликация. Основные этапы. Биологическая роль процесса.
- •Вопрос 1:
- •Вопрос 2:
- •1 Этап репликации: инициация
- •2 Этап репликации: элонгация
- •3 Этап репликации: терминация
- •Билет № 23
- •1. Молекулярная организация биологических мембран. Трансмембранный перенос веществ.
- •2. Структурная организация монооксигеназной системы окисления. Семейства цитохрома р450. Основные реакции, катализируемые изоферментами цитохрома р450.
- •Вопрос 1:
- •2. Трансмембранная асимметрия липидов
- •3. Жидкостность мембран
- •1. Первично-активный транспорт
- •2. Вторично-активный транспорт
- •Вопрос 2:
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •2. Функционирование цитохрома р450
- •3. Свойства системы микросомального окисления
- •Билет № 24
- •1. Инсулин. Синтез. Механизм действия на клетки-мишени. Физиологические эффекты.
- •2. Переваривание белков и всасывание аминокислот. Биохимическая ценность белков.
- •Вопрос 1:
- •1. Инсулин. Строение, синтез и секреция
- •2. Биологические функции инсулина
- •3. Механизм действия инсулина
- •Вопрос 2:
- •1. Образование и роль соляной кислоты
- •2.Механизм активации пепсина
- •Билет № 25
- •1. Переваривание липидов. Всасывание. Роль желчи. Нарушение процессов переваривания и всасывания липидов.
- •2. Транскрипция. Основные этапы, регуляция, значение. Посттрансляционный процессинг белка.
- •Вопрос 1:
- •Вопрос 2:
- •Билет №26
- •Вопрос 1:
- •Использование холестерина в организме
- •Вопрос 2:
- •Билет № 27
- •Вопрос 1:
- •Вопрос 2:пока засекречен Билет № 28
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 30
- •1. Метаболизм кетоновых тел. Роль кетоновых тел в норме и патологии.
- •2. Трансляция. Основные этапы. Антибиотики – ингибиторы трансляции.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 31
- •1. Депонирование и мобилизация триацилглицеринов. Регуляция.
- •2. Метаболическая биотрансформация ксенобиотиков. Реакции I фазы метаболизма.
- •Вопрос1:
- •Вопрос 2:
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •2. Функционирование цитохрома р450
- •3. Свойства системы микросомального окисления
- •Билет № 32
- •Вопрос 1:
- •Вопрос2:
- •Билет № 33
- •1. Липолиз. Регуляция, значение. Бетта-окисление высших жирных кислот. Энергетическая
- •2. Витамин д. Потребность, источники, метаболизм. Биохимические функции.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 34
- •1. Биосинтез высших жирных кислот. Характеристика мультиферментного комплекса пальмитат-синтетазы. Значение процесса.
- •Вопрос 1:
- •1. Синтез пальмитиновой кислоты
- •2. Регуляция синтеза жирных кислот
- •3. Синтез жирных кислот из пальмитиновой кислоты
- •Вопрос 2:
- •Билет № 35
- •1. Эссенциальные жирные кислоты как предшественники синтеза эйкозаноидов. Простагландины, их биологическая роль.
- •2. Биохимические основы канцерогенеза.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 36
- •1. Синтез нсi и его регуляция. Роль соляной кислоты в переваривании белков.
- •2. Система «ренин-ангиотензин-альдостерон», вазопрессин. Функции.
- •Вопрос 1:
- •1. Образование и роль соляной кислоты
- •2.Механизм активации пепсина
- •3.Возрастные особенности переваривания белков в желудке
- •4. Нарушения переваривания белков в желудке
- •Вопрос 2:
- •1. Синтез и секреция антидиуретического гормона
- •2. Механизм действия
- •3. Несахарный диабет
- •1. Механизм действия альдостерона
- •2. Роль системы ренин-ангиотензин- альдостерон в регуляции водно-солевого обмена
- •3. Восстановление объёма крови при обезвоживании организма
Вопрос2:пока засекречен Билет № 10
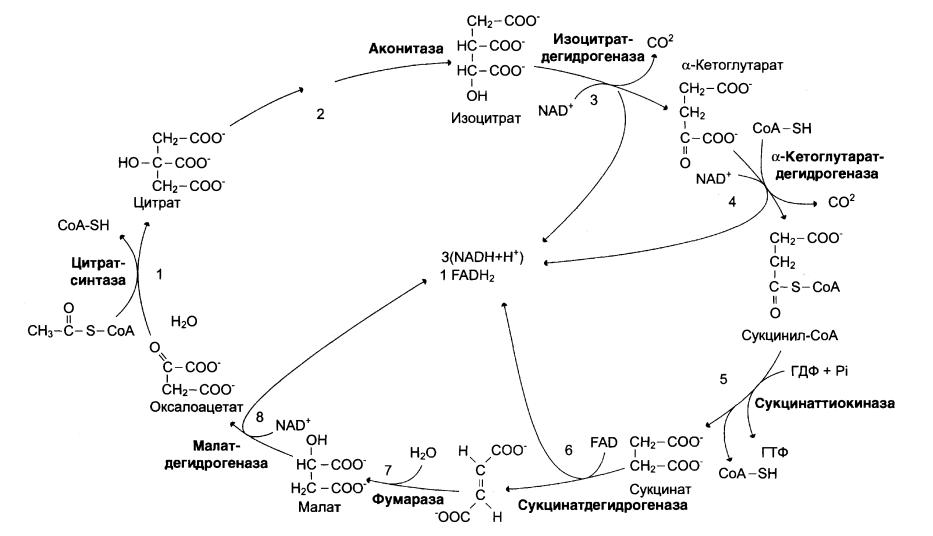
1. Цикл трикарбоновых кислот. Ход процесса, регуляция, значение.
2. Витамин В6. Источники, потребность. Строение и биохимические функции. Признаки недостаточности.
Вопрос 1:
Цикл лимонной к-ты (цикл трикарбоновых кислот) – заключительный этап катаболизма, в котором углерод ацетильного остатка ацетил-КоА окисляется до 2 молекул СО2. Атомы водорода, освобождающиеся в окислительно-восстановительных реакциях, доставляется в ЦПЭ при участии NAD- и FAD-зависимых дегидрогеназ, в результате чего происходят синтез воды окислительноефосфорилирование АДФ. Связь между атомами углерода в ацетил-КоА устойчива к окислению.
Последовательность комплексов реакций цитратного цикла
Образование цитрата
В реакции образования цитрата углеродный атом метильной группы ацетил-КоА связывается с карбонильной группой оксалоацетата; одновременно расщепляется тиоэфирная связь и освобождается коэнзим А. реакция сопровождается потерей большого количества энергии в виде теплоты. Катализирует реакцию цитратсинтаза, фермент, локализованный в матриксе митохондрий.
Превращение цитрата в изоцитрат.
Вторая реакция цитратного комплекса – обратимое превращение цитрата в изоцитрат. Фермент, катализирующий эту реакцию, назван аконитазой по промежуточному продукту, цис-аконитовой кислоте, которая предположительно образуется в реакции. Однако это соединение не обнаруживается в свободном виде, так ка не отделяется от активного центра фермента до завершения реакции.
Окислительное декарбоксилированиеизоцитрата.
Эту реакцию катализирует изоцитратдегидрогеназа. Существует 2 формы изоцитратдегидрогеназы: одна содержит в качестве кофермента NAD+, вторая – NADP+. Над-зависимый фермент локализован в митохондриях и участвует в ЦТК; в результате действия этого фермента на изоцитрат образуется альа-кетоглутарат.
Ракция катализируемая над-зависимой изоцитратдегидрогеназой,-самая медленная реакция цитратного цикла. АДФ –аллостеричесийактиватор фермента.
Окислительное декарбоксилирование альфа-кетоглутарата.
В этой реакции альфа-кетоглутаратподвнргается окислительному декарбоксилированию с образованием в качестве конечных продуктов сукцинил-КоА, СО2, и NADH+H+. В результате этой реакции образуется сукцинил-КоА.
Реакция катализирует альфа-кетоглутаратдегидрогеназный комплекс, который по структуре и функциям сходен с пируватдегидрогеназным комплексом(ПДК). Подобно ПДК, он состоит из 3 ферментов: альфа-кетоглутаратдеарбоксилаза, дигидролипоилтранссукцинилазы и дигидролипоилдегидрогеназы. Кроме того, в этот ферментный комплес входят 5 коферментов: тиаминдифосфат, кофермент А, липоевая к-та, NAD+, FAD. Существенное отличие этой ферментной системы от ПДК- то, что она не имеет сложного механизма регуляции. В частности, в этом комплексе отсутствуют регуляторные субъединицы. Равновесие реакции окислительного декарбоксилирования альфа-кетоглутарата сильно сдвинуто в сторону образования сукцинил-КоА. И ее можно считать однонаправленной.
Превращение сукцинил-КоА в сукцинат.
Сукцинил-КоА-высокоэнергетическое соединение. В митохондриях разрыв тиоэфирной связи сукцинил-КоА сопряжен с реакцией фосфорилирования ГДФ до ГТФ. Эту сопряженную реакцию катализирует сукцинаттиокиназа. Промежуточный этап реакции-фосфорилирование молекулы фермента по одному из гистидиновых остатков активного центра. Затем остаток фосфорной кислоты присоединяется к ГДФ с образованием ГТФ.
С ГТФ концевая фосфатная группа может переноситься на АДФ с образованием АТФ; эту обратимую реакцию катализирует нуклеозиддифосфаткиназа. ГТФ+АДФ↔ГДФ+АТФ.
Дегидрирование скуцината.
Образовавшийся на предыдущем этапе сукцинат превращается в фумарат под действием сукцинатдегидрогеназы. этот фермент-флавопротеин, молеула которого содержит прочно связанный кофермент FAD.
Сукцинатдегидрогеназа прочно связана с внутренней митохондриальной мембраной.
Образование малата из фумората.
Образование малата происходит при участии фермента фумаратгидратазы. Более известен какфумараза.
Фумараза-олигомерный белок, состоящий из 4 идентичных полипептидных цепей. Он расположен в матриксе митохондрий.Фумаразу относят к ферментам с абсолютной субстратной специфичностью: она катализирут гидратацию только транс-формуфумарата.
Дегидрирование малата.
В заключительной стадии цитратного цикла малатдегидрируетя с образованием оксалооцетата. Реакцию катализирует NAD-зависимая малатдегидроеназа, содержащаяся в мартиксе митохондрий.
Малатдегидрогензаный реакции сильно сдвинуто влево. Тем не менее, в интактных клетках эта реакция идет слева направо, потому что продукт реакции, оксалоацетат, активно используется в цитратсинтазнореакции.вцитозоле содержится изоформамалатдегидрогеназы, также NAD-зависимая, но не принимающая
Участия в цитратном цикле. Обе формы малатдегидрогеназы-димеры.