
- •1. Ферменты. Понятие. Строение. Понятие об активном центре. Коферменты.
- •2. Обмен фенилаланина и тирозина. Синтез катехоламинов, тироксина, меланинов. Биологическое значение.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 2
- •1. Обратимое и необратимое ингибирование ферментов, ферментные яды. Примеры.
- •2. Воздействие факторов физической природы на организм человека.
- •Вопрос 1:
- •1. Конкурентное ингибирование
- •1. Специфические и неспецифические ингибиторы
- •Вопрос 2:
- •Билет № 3
- •1. Конкурентное ингибирование. Принцип. Примеры. Пути реактивации ферментов при конкурентном ингибировании.
- •2. Гемоглобин. Синтез гема. Транспорт кислорода и со2. Типы и функциональные формы гемоглобина. Гемоглобинопатии.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 4
- •1. Понятие об аллостерических ферментах. Особенности строения и регуляции. Примеры.
- •2. Компоненты гуморального врожденного иммунитета. Механизмы защитного действия.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 5
- •1. Дезаминирование аминокислот. Обезвреживания аммиака. Токсичность аммиака.
- •2. Иммуноферментный анализ. Принцип. Применение для идентификации микроорганизмов.
- •Вопрос 1:
- •Вопрос 2:
- •Билет 6.
- •1.Оксидоредуктазы. Строение коферментов. Биологическая роль.
- •2. Биогенные амины как нейромедиаторы (катехоламины, серотонин, гамк, гистамин), их метаболизм. Нарушение обмена биогенных аминов при психических заболеваниях.
- •Вопрос1:
- •Вопрос 2:
- •Билет № 7
- •1. Общие принципы взаимодействия регуляторов с клетками-мишенями. Сигнальные пути.
- •2. Катаболизм гема, образование желчных пигментов. Нарушение обмена билирубина.
- •Вопрос 1:
- •1. Передача гормональных сигналов через мембранные рецепторы
- •2. Передача сигналов через внутриклеточные рецепторы
- •3. Передача сигналов через рецепторы, сопряжённые с ионными каналами
- •Вопрос 2:
- •Билет № 8
- •1. Факторы, определяющие нормальный уровень ферментативной активности биологических жидкостей. Причины, приводящие к изменению количества и активности ферментов в биологических жидкостях.
- •2. Воздействие факторов биологической природы на организм человека.
- •Вопрос 1:
- •Вопрос 2:пока засекречен Билет № 9
- •1. Окислительное декарбоксилирование пировиноградной кислоты. Характеристика мультиферментного комплекса пируватдегидрогеназы. Значение процесса.
- •2. Биохимические механизмы токсичности металлов (Pb, Cd, Hg).
- •Вопрос 1:
- •Вопрос2:пока засекречен Билет № 10
- •Вопрос 1:
- •Вопрос2:
- •Билет № 11
- •2. Классы иммуноглобулинов, классификация, функции в иммунном ответе. Клонально-селекционная теория синтеза антител.
- •Вопрос1:
- •Вопрос 2:
- •Билет № 17
- •Гормоны щитовидной железы. Тироксин и трийодтиронин. Строение, метаболизм. Механизм действия на клетки-мишени. Влияние на обмен веществ.
- •Фотометрический метод определения содержания аналитов и активности ферментов в биологических жидкостях. Принцип метода.
- •Вопрос 1:
- •Вопрос 2:пока засекречен Билет № 18
- •1 Регуляция уровня глюкозы в крови.
- •2 Витамин а. Потребность, источники, условия всасывания, транспорт. Биохимические функции. Признаки недостаточности.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 19
- •1. Глюконеогенез. Характеристика основных стадий, субстраты глюконеогенеза, регуляция, значение.
- •2. Метаболизм этанола. Биохимические механизмы токсического действия этанола.
- •Вопрос 1:
- •А. Реакции глюконеогенеза
- •1. Образование фосфоенолпирувата из пирувата - первая из необратимых стадий глюконеогенеза
- •2. Гидролиз фруктозо-1,6-бисфосфата и глюкоза-6-фосфата
- •3.Энергетический баланс глюконеогенеза из пирувата
- •Вопрос 2:
- •1. Синтез гликогена. Ход процесса, регуляция. Биологическое значение.
- •2. Витамины рр и в2. Потребность, источники. Коферментные формы и биохимические функции. Признаки недостаточности.
- •Вопрос 1:
- •Вопрос2:
- •Билет № 21
- •1. Глюкоза-6-фосфат – ключевое соединение в обмене углеводов. Источники и пути использования глюкозо-6-фосфата в клетке.
- •2. Основные этапы биосинтеза нуклеотидов. Биологическая роль. Антиметаболиты – ингибиторы процесса.
- •Вопрос 1:
- •Билет № 22
- •1. Распад гликогена. Регуляция. Биологическое значение. Гликогенозы.
- •2. Репликация. Основные этапы. Биологическая роль процесса.
- •Вопрос 1:
- •Вопрос 2:
- •1 Этап репликации: инициация
- •2 Этап репликации: элонгация
- •3 Этап репликации: терминация
- •Билет № 23
- •1. Молекулярная организация биологических мембран. Трансмембранный перенос веществ.
- •2. Структурная организация монооксигеназной системы окисления. Семейства цитохрома р450. Основные реакции, катализируемые изоферментами цитохрома р450.
- •Вопрос 1:
- •2. Трансмембранная асимметрия липидов
- •3. Жидкостность мембран
- •1. Первично-активный транспорт
- •2. Вторично-активный транспорт
- •Вопрос 2:
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •2. Функционирование цитохрома р450
- •3. Свойства системы микросомального окисления
- •Билет № 24
- •1. Инсулин. Синтез. Механизм действия на клетки-мишени. Физиологические эффекты.
- •2. Переваривание белков и всасывание аминокислот. Биохимическая ценность белков.
- •Вопрос 1:
- •1. Инсулин. Строение, синтез и секреция
- •2. Биологические функции инсулина
- •3. Механизм действия инсулина
- •Вопрос 2:
- •1. Образование и роль соляной кислоты
- •2.Механизм активации пепсина
- •Билет № 25
- •1. Переваривание липидов. Всасывание. Роль желчи. Нарушение процессов переваривания и всасывания липидов.
- •2. Транскрипция. Основные этапы, регуляция, значение. Посттрансляционный процессинг белка.
- •Вопрос 1:
- •Вопрос 2:
- •Билет №26
- •Вопрос 1:
- •Использование холестерина в организме
- •Вопрос 2:
- •Билет № 27
- •Вопрос 1:
- •Вопрос 2:пока засекречен Билет № 28
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 30
- •1. Метаболизм кетоновых тел. Роль кетоновых тел в норме и патологии.
- •2. Трансляция. Основные этапы. Антибиотики – ингибиторы трансляции.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 31
- •1. Депонирование и мобилизация триацилглицеринов. Регуляция.
- •2. Метаболическая биотрансформация ксенобиотиков. Реакции I фазы метаболизма.
- •Вопрос1:
- •Вопрос 2:
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •2. Функционирование цитохрома р450
- •3. Свойства системы микросомального окисления
- •Билет № 32
- •Вопрос 1:
- •Вопрос2:
- •Билет № 33
- •1. Липолиз. Регуляция, значение. Бетта-окисление высших жирных кислот. Энергетическая
- •2. Витамин д. Потребность, источники, метаболизм. Биохимические функции.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 34
- •1. Биосинтез высших жирных кислот. Характеристика мультиферментного комплекса пальмитат-синтетазы. Значение процесса.
- •Вопрос 1:
- •1. Синтез пальмитиновой кислоты
- •2. Регуляция синтеза жирных кислот
- •3. Синтез жирных кислот из пальмитиновой кислоты
- •Вопрос 2:
- •Билет № 35
- •1. Эссенциальные жирные кислоты как предшественники синтеза эйкозаноидов. Простагландины, их биологическая роль.
- •2. Биохимические основы канцерогенеза.
- •Вопрос 1:
- •Вопрос 2:
- •Билет № 36
- •1. Синтез нсi и его регуляция. Роль соляной кислоты в переваривании белков.
- •2. Система «ренин-ангиотензин-альдостерон», вазопрессин. Функции.
- •Вопрос 1:
- •1. Образование и роль соляной кислоты
- •2.Механизм активации пепсина
- •3.Возрастные особенности переваривания белков в желудке
- •4. Нарушения переваривания белков в желудке
- •Вопрос 2:
- •1. Синтез и секреция антидиуретического гормона
- •2. Механизм действия
- •3. Несахарный диабет
- •1. Механизм действия альдостерона
- •2. Роль системы ренин-ангиотензин- альдостерон в регуляции водно-солевого обмена
- •3. Восстановление объёма крови при обезвоживании организма
Билет № 1
1. Ферменты. Понятие. Строение. Понятие об активном центре. Коферменты.
2. Обмен фенилаланина и тирозина. Синтез катехоламинов, тироксина, меланинов. Биологическое значение.
Вопрос 1:
Ферменты (fermentum лат. - закваска) – специфические высокоэффективные биологические катализаторы, синтезируемые живыми клетками.
Строение: Протеины -Содержат только белковую часть
Протеиды (содержат небелковые компоненты: - кофакторы . Все ферменты – глобулярные белки
Все ферменты имеют активный центр (АЦ), в котором происходит узнавание, связывание субстрата и превращение его в продукт реакции.
Виды ферментов по строению
Изостерические ферменты – имеют только активный центр
Аллостерические ферменты кроме АЦ, имеют 1 или более регуляторных (аллостерических) центров, в которых связываются вещества – регуляторы
Аллостерические ферменты обычно являются ОЛИГОМЕРАМИ, т.е. состоят из 2 – 12 отдельных белковых субъединиц
Свойства ферментов
Высокая каталитическая активность
Специфичность
Регулируемость
Активный центр - уникальная комбинация аминокислотных остатков в молекуле фермента, обеспечивающая непосредственное связывание её с молекулой субстрата и прямое участие в акте катализа
В результате исследований было показано, что молекула фермента, как правило, во много раз больше молекулы субстрата, подвергающегося химическому превращению этим ферментом. В контакт с субстратом вступает лишь небольшая часть молекулы фермента, обычно от 5 до 10 аминокислотных остатков, формирующих активный центр фермента. Роль остальных аминокислотных остатков состоит в обеспечении правильной конформации молекулы фермента для оптимального протекания химической реакции.
Активный центр на всех этапах ферментативного катализа нельзя рассматривать как пассивный участок для связывания субстрата. Это комплексная молекулярная "машина", использующая разнообразные химические механизмы, способствующие превращению субстрата в продукт.
В активном центре фермента субстраты располагаются таким образом, чтобы участвующие в реакции функциональные группы субстратов находились в непосредственной близости друг к другу. Это свойство активного центра называют эффектом сближения и ориентации реагентов. Такое упорядоченное расположение субстратов вызывает уменьшение энтропии и, как следствие, снижение энергии активации (Еа), что определяет каталитическую эффективность ферментов.
Активный центр фермента также способствует дестабилизации межатомных связей в молекуле субстрата, что облегчает протекание химической реакции и образование продуктов. Это свойство активного центра называют эффектом деформации субстрата (рис. 2-12).
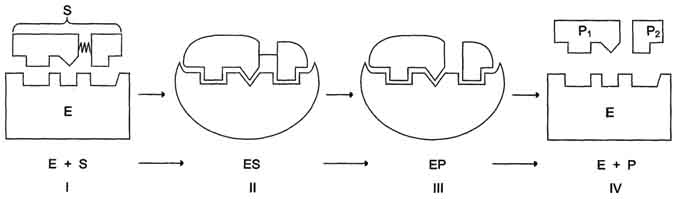
Рис. 2-12. Этапы ферментативного катализа. I - этап сближения и ориентации субстрата относительно активного центра фермента; II - образование фермент-субстратного комплекса (ES) в результате индуцированного соответствия; III - деформация субстрата и образование нестабильного комплекса фермент-продукт (ЕР); IV- распад комплекса (ЕР) с высвобождением продуктов реакции из активного центра фермента и освобождением фермента.
Коферменты – органические вещества неаминокислотной природы, непосредственно участвующие в катализе в составе фермента.
Кофермент + апофермент « холофермент
Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например тиаминдифосфат.
Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры - NAD+, NADP+.
Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот.
Химическая природа коферментов, их функции в ферментативных реакциях чрезвычайно разнообразны. Традиционно к коферментам относят производные витаминов, хотя помимо них есть значительный класс небелковых соединений, принимающих участие в
проявлении каталитической функции ферментов.
К коферментам относят следующие соединения:
производные витаминов;
гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы и являющиеся простетической группой ферментов;
нуклеотиды - доноры и акцепторы остатка фосфорной кислоты;
убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ;
фосфоаденозилфосфосульфат, участвующий в переносе сульфата;
S-аденозилметионин (SAM) - донор метильной группы;
глутатион, участвующий в окислительно-восстановительных реакциях.
