
- •Органическая химия
- •1. Классификация органических соединений
- •3. Типы химических реакций
- •Циклоалканы (циклопарафины)
- •1. Получение
- •2. Физические свойства
- •3. Химические свойства
- •Диеновые углеводороды (алкадиены)
- •1. Получение
- •2. Химические свойства
- •Ароматические углеводороды (арены)
- •1 Строение молекулы бензола
- •2. Изомерия и номенклатура
- •3. Получение
- •4. Химические свойства
- •5. Реакции присоединения. В реакции присоединения, приводящие к разрушению ароматической структуры бензольного кольца, арены могут вступать с большим трудом:
- •Галогенопроизводные углеводородов
- •1. Классификация
- •2. Изомерия и номенклатура
- •3. Получение
- •4. Физические свойства
- •5. Химические свойства
- •6. Применение
- •Карбоновые кислоты
- •Основные карбоновые кислоты
- •1. Изомерия
- •2. Получение
- •3. Физические свойства
- •4. Химические свойства
- •Азотсодержащие органические соединения
- •1 Амины
- •1. Номенклатура
- •2. Химические свойства
- •2 Ароматические амины
- •1. Анилин (фениламин)
- •1. Физические свойства
- •2. Химические свойства
- •Высокомолекулярные соединения (вмс) или полимеры
- •1. Физические свойства
- •2. Классификация
- •П олимеризационные полимеры
- •Поликонденсационные полимеры
- •3. Химические свойства
- •4. Применение
3. Получение
Реакции замещения атомов водорода в углеводородах на галоген. В результате галогенирования алканов, циклоалканов, бензола и его гомологов, алкенов (в определенных условиях) происходит замещение атомов водорода на галоген
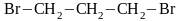


 +
+
 1,3-дибромпропан
1,3-дибромпропан
циклопропан
Бензол и его гомологи хлорируются легче, чем алканы. На холоду в присутствии катализаторов (AℓCℓ3, FeCℓ3) галоген замещает атомы водорода в бензольном ядре, а при нагревании или на свету в отсутствие катализатора замещаются атомы водорода в боковой цепи

 CH
CH CH
CH
AℓCℓ ,FeCℓ Cℓ
 и
и
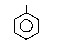 CH
- HCℓ
CH
- HCℓ
о-хлор-толуол
+ Сℓ2 Сℓ
CH Cℓ п-хлор-толуол
Cℓ п-хлор-толуол
толуол t, свет
-НСℓ
хлористый бензил
Если катализатор обладает достаточной активностью (AℓCℓ3), все шесть атомов водорода в молекуле бензола могут быть замещены на хлор
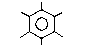 Cℓ
Cℓ
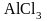 Cℓ Cℓ
Cℓ Cℓ
 +
6Cℓ
+ 6 HCℓ
+
6Cℓ
+ 6 HCℓ
Cℓ Cℓ
бензол Cℓ
гексахлорбензол
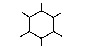
Под действием УФ-излучения в отсутствие катализатора к молекуле бензола могут присоединяться три молекулы хлора или брома
 Cℓ
Cℓ
Cℓ Cℓ
+
3Cℓ

Cℓ Cℓ
Cℓ
гексахлорциклогексан (гексахлоран)
Это основной промышленный способ получения гексахлорана.
Реакции присоединения галогенов к ненасыщенным углеводородам. При высоких температурах (400-600 ºС) удается заместить атомы водорода в алкенах, не затрагивая двойной связи
436 оС
С Н2
= СН2 + Сℓ2
СН2 = СНСℓ + НСℓ
Н2
= СН2 + Сℓ2
СН2 = СНСℓ + НСℓ
избыток этилена
этилен хлористый винил

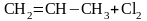 500-550ºС
500-550ºС
пропилен хлористый аллил


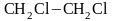
этилен 1,2-дихлорэтан
Реакции присоединения галогеноводородов к ненасыщенным углеводородам

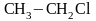
этилен хлористый
этил
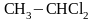
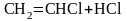

ацетилен хлористый 1,1-дихлорэтан
винил
4. Физические свойства
Физические свойства галогенопроизводных зависят от строения радикала, вида и количества атомов галогена в молекуле. Большинство их обладают специфическим, часто резким запахом, раздражающим слизистую оболочку, некоторые обладают анестезирующим действием (CH2Cℓ2), токсичны, являются антисептиками (CHJ3).
5. Химические свойства
Химические свойства галогеналканов определяются присутствием в молекуле атома галогена. Последний образует с атомом углерода простую σ-связь, которая в отличие от неполярных или особо полярных С – С и С – Н-связей, как правило, заметно поляризо-вана , и электронная плотность смещена к более электроотрицательному атому галогена. Очевидно, что большинство реакций галогенопроизводных связано с разрывом связи:
-Сδ+ -Гδ-.
На полярность связи влияют как природа атома галогена (чем больше ЭО галогена, тем полярнее связь), так и величина и строение углеводородного радикала. На связанном с галогеном углеродном атоме возникает частичный положительный заряд. Поэтому он подвергается действию нуклеофильных реагентов, предоставляющих свою электронную пару для образования новой связи. Подавляющее большинство реакций галогеналканов, широко используемых в органическом синтезе, связано с нуклеофильной атакой электронодефицитного атома углерода и замещением галогена на остаток нуклеофила.
Практика показывает, что в подобных реакциях наименее реакционноспособными оказываются фторпроизводные. Атом фтора очень компактен благодаря маленькому радиусу. При этом, хотя связь С – F наиболее полярная, она также самая короткая и прочная. Поэтому у фторпроизводных легче разорвать связь С – С, нежели С – F. Отсюда многие нижеперечисленные свойства характерны не для фторалканов, а для йод-, бром- и хлорпроизводных. Среди упомянутых производных наибольшую активность проявляют йодзамещенные. Это объясняется наименьшей среди галогенов электроотрицательностью атома йода; его оболочка будучи достаточно большой, легко деформируется под внешним воздействием, то есть связь С – J легко поляризуется. Именно фактор поляризуемости оказывается решающим для химического поведения галогеналканов во многих реакциях.
Для галогеналканов характерны реакции нуклеофильного замещения, отщепления галогеноводородов (элиминирование) с образованием алкенов, взаимодействие с металлами (получение металлорганических соединений), восстановление (образование алкенов). В органическом синтезе особенно широко распространены реакции замещения, позволяющие получать на основе галогеналканов самые разнообразные органические соединения.
Реакции нуклеофильного замещения. Примерами реакций замещения могут служить следующие превращения


метанол 
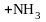
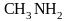
метиламин

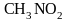
нитрометан
Реагенты (OH-, J-, CN-, NO2-, NH3) называются нуклеофильными (от греческого слова «нуклеус»- ядро), а реакции замещения, протекающие с их участием, - реакциями нуклеофильного замещения. Реакция обнаруживает целый ряд особенностей. Оказывается, в частности, что лёгкость реакции необычным образом зависит от строения исходного галогеналкана. А именно, наиболее реакционноспособными являются третичные соединения, затем следуют первичные, наименьшую активность проявляют вторичные галогеналканы
R
׀
R-С-Г > R-CH2-Г > R – CH-Г.
׀
R
В значительной мере на реакционную способность алкилгалогенидов влияет природа галогена. Реакционная способность падает и в ряду R–J > R–Br > R–Cℓ > R–F ,так как увеличивается энергия связи и уменьшается её поляризуемость. Очевидно, чем прочнее связь, тем труднее её разорвать.
Дегидрогалогенирование галогеналканов. Галогеналкилы под действием спиртовых растворов щелочей отщепляют галогеноводороды с образованием непредельных соединений (см. получение алкенов)
спиртовый р-р
 щёлочи
щёлочи
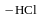
хлористый этил этилен
Реакции отщепления протекают в соответствии с правилом А. М. Зайцева.
