
- •Органическая химия
- •1. Классификация органических соединений
- •3. Типы химических реакций
- •Циклоалканы (циклопарафины)
- •1. Получение
- •2. Физические свойства
- •3. Химические свойства
- •Диеновые углеводороды (алкадиены)
- •1. Получение
- •2. Химические свойства
- •Ароматические углеводороды (арены)
- •1 Строение молекулы бензола
- •2. Изомерия и номенклатура
- •3. Получение
- •4. Химические свойства
- •5. Реакции присоединения. В реакции присоединения, приводящие к разрушению ароматической структуры бензольного кольца, арены могут вступать с большим трудом:
- •Галогенопроизводные углеводородов
- •1. Классификация
- •2. Изомерия и номенклатура
- •3. Получение
- •4. Физические свойства
- •5. Химические свойства
- •6. Применение
- •Карбоновые кислоты
- •Основные карбоновые кислоты
- •1. Изомерия
- •2. Получение
- •3. Физические свойства
- •4. Химические свойства
- •Азотсодержащие органические соединения
- •1 Амины
- •1. Номенклатура
- •2. Химические свойства
- •2 Ароматические амины
- •1. Анилин (фениламин)
- •1. Физические свойства
- •2. Химические свойства
- •Высокомолекулярные соединения (вмс) или полимеры
- •1. Физические свойства
- •2. Классификация
- •П олимеризационные полимеры
- •Поликонденсационные полимеры
- •3. Химические свойства
- •4. Применение
5. Реакции присоединения. В реакции присоединения, приводящие к разрушению ароматической структуры бензольного кольца, арены могут вступать с большим трудом:
а) гидрирование.
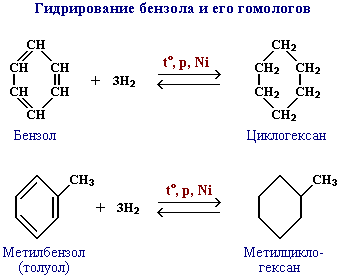
Эта реакция является обратной реакции образованию бензола при дегидрировании циклогексана;
б) радикальное хлорирование. В условиях радикальных реакций (ультрафиолетовый свет, повышенная температура) возможно присоединение галогенов к ароматическим соединениям. Практическое значение имеет радикальное хлорирование бензола для получения «гексахлорана» (средство борьбы с вредными насекомыми).
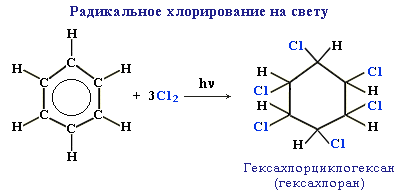
В случае гомологов бензола более легко происходит реакция радикального замещения атомов водорода в боковой цепи.
6. Реакции окисления. Бензол не окисляется даже под действием сильных окислителей (KМnO4, K2Cr2O7 и т.п.), поэтому он часто используется как инертный растворитель при проведении реакций окисления других органических соединений. В отличие от бензола его гомологи окисляются довольно легко:
а) при действии раствора KМnO4 и нагревании в гомологах бензола окислению подвергаются только боковые цепи.
О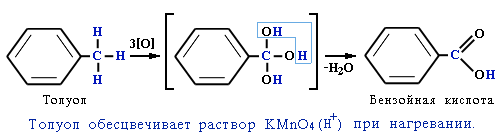 кисление
других гомологов (этилбензол, пропилбензол
и т.д.) также приводит к образованию
бензойной кислоты. Разрыв связи при
этом происходит между двумя ближайшими
к кольцу атомами углерода в боковой
цепи
кисление
других гомологов (этилбензол, пропилбензол
и т.д.) также приводит к образованию
бензойной кислоты. Разрыв связи при
этом происходит между двумя ближайшими
к кольцу атомами углерода в боковой
цепи
б) бензол и его гомологи на воздухе горят коптящим пламенем, что обусловлено высоким содержанием углерода в их молекулах

Бензол и его летучие гомологи образуют с воздухом и кислородом взрывоопасные смеси.
Галогенопроизводные углеводородов
1. Классификация
Это продукты замещения одного или нескольких атомов водорода в молекуле углеводорода на галоген. По степени замещения различают:
1) моногалогенопроизводные: СН3Сl - хлорметан (метилхлорид), CH3-CH2-Br - бромэтан (этилбромид);
2) дигалогенопроизводные:
- геминальныe - оба атома галогена находятся при одном углеродном атоме, например СН3-СНСl2 - 1,1- дихлорэтан;
- вицинальные - атомы галогенов находятся у соседних углеродных атомов, например Cl-CH2-CH2-Cl - 1,2-дихлорэтан;
3) полигалогенопроизводные, например, CHCl3 – трихлорметан (хлороформ), CCl4 – тетрахлорметан (четыреххлористый углерод).
Из галогенопроизводных непредельного ряда теоретический и практический интерес представляют соединения двух типов:
1) типа винилхлорида, когда атом галогена находится рядом с двойной связью (CH2=CH-Cl - хлорэтен);
2) типа аллилхлорида, когда атом галогена отделен от кратной связи одним метиленовым звеном (CH2=CH-CH2-Cl - 3-хлорпропен).
Соединения, в которых двойная связь и атом галогена далеко отстоят друг от друга, химически не отличаются от обычных алкенов и галогенопроизводных насыщенных углеводородов. В зависимости от характера углеводорода, в молекулу которого введен галоген, их делят на насыщенные (галогеналкилы), ненасыщенные, ароматические (галогенарилы).
2. Изомерия и номенклатура
По рациональной номенклатуре название галогенопроизводных образуют из названия углеводородного радикала и галогена, указывая в необходимых случаях положение последнего




бромистый вторичный хлористый хлористый
этил бутил винил
(этилбромид) (винилхлорид)
По номенклатуре ИЮПАК положение атома галогена указывают цифрой, которая вместе с его названием располагается перед наименованием углеводородного радикала. Нумерацию атомов углерода главной цепи начинают с того конца, к которому ближе расположен атом галогена


6 5 4 3 2 1
2-хлор-4,5-диметилгексан
В отдельных случаях применяются тривиальные названия: СHCℓ3- хлороформ; CHJ3- йодоформ. Изомерия в ряду галогенопроизводных связана с особенностями строения углеродного скелета и положением атомов галогена
Сℓ


1-хлорбутан
2-хлор-2-метилпропан

1-хлор-2-метилпропан
