
- •Міністерство освіти, науки, молоді та спорту україни дніпродзержинський державний технічний університет
- •Конспект лекцій
- •6.050802 „Електронні пристрої та системи” (ес),
- •6.050801 “Мікро та наноелектроніка” (фбе).
- •Тема 1. Вступ до фізичної хімії. Будова речовини.
- •Тема 2. Перший закон термодинаміки
- •1.2. Основні поняття і визначення
- •Тема 3. Другий закон термодинаміки
- •Тема 4. Хімічна рівновага. Хімічна спорідненість.
- •Тема 5. Хімічна кінетика
- •Тема 6. Розчини. Властивості розчинів електролітів
- •Тема 7. Електропровідність електролітів.
- •Тема 8. Електрохімічні процеси
Тема 7. Електропровідність електролітів.
Провідники першого і другого роду. Питома і еквівалентна електропровідність. Залежність питомої електропровідності від концентрації і температури. Залежність еквівалентної електропровідності від концентрації. Гранична електропровідність. Вимірювання електропровідності розчинів.
Згідно номенклатурі, яку ввів Фарадей, відрізняють два типу провідників струму: першого і другого роду. За сучасними уявленнями у разі провідників першого роду електропровідність забезпечують електрони, а у разі провідників другого роду – іони. До провідників першого роду відносять метали і сплави, графіт, деякі тугоплавкі оксиди. До провідників другого роду відносять електроліти – речовини, які в розплавленому чи розчиненому стані спроможні розпадатися на іони.
Провідність провідників характеризується електропровідністю – L, яка оборотна опору:
L
=
![]() .
.
Опір провіднику R прямо пропорційний його довжині l і зворотно пропорційний перетику S:
R
=![]() ,
,
де:
![]() - питомий опір, характеризує опір
провіднику з одиничними розмірами:
довжиною і перетином, які дорівнюють
одиниці. Величина, яка зворотна питомому
опору:
- питомий опір, характеризує опір
провіднику з одиничними розмірами:
довжиною і перетином, які дорівнюють
одиниці. Величина, яка зворотна питомому
опору:
![]() ,
,
зветься
питомою електропровідністю
![]() (каппа). Вона має основну одиницю виміру
См/м,
і може визначатися у
См/см (См – сименс = ом-1).
(каппа). Вона має основну одиницю виміру
См/м,
і може визначатися у
См/см (См – сименс = ом-1).
У разі розчинів електролітів величина S – площа електродів, між якими знаходиться розчин; l - відстань між ними, тобто - це електропровідність 1м3 розчину, який міститься між плоскими паралельними електродами, що знаходяться на відстані 1 м один від одного.
В зв’язку з тим, що електропровідність електроліту обумовлена пересуванням іонів у розчині, величина питомої електропровідності визначається спроможністю іонів до пересування, концентрацією іонів у розчині і температурою.
Для бінарного одно-одновалентного електроліту при постійній температурі залежність питомої електропровідності від швидкості пересування іонів і їх концентрації у розчині для сильних електролітів визначається рівнянням:
=
Ci![]() F(Uk
+ Ua),
F(Uk
+ Ua),
де: F - число Фарадея;
Ci - концентрація розчину, моль-екв./л;
- коефіцієнт електропровідності;
Uk, Ua - швидкість пересування іонів при градієнті потенціалу 1 В/м.
Попереднє рівняння частіше записують у вигляді:
=
![]() Ci
(
Ci
(![]() +
+
![]() )
,
)
,
де: = Uk F і = Uа F величини, які звуться електропровідностями катіону і аніону. Для слабких електролітів рівняння (5) має вигляд:
=
Ci
![]() (
+
),
(
+
),
де: - ступінь дисоціації.
Залежність питомої електропровідності від концентрації електроліту у дійсності складніша, ніж можна очікувати за наведеними рівняннями, оскільки із змінюванням концентрації міняється швидкість пересування іонів.
Питома електропровідність для сильних і більшості слабких електролітів залежить від концентрації розчину. При цьому з ростом концентрації питома електропровідність досягає максимуму, а потім зменшується (рисунок). Така залежність для сильних електролітів обумовлена протилежним впливом на електропровідність ефекту зростання концентрації іонів і ефекту між іонної взаємодії, яка зростає з ростом концентрації розчину. Після максимуму між іонна взаємодія впливає більше, ніж зростання концентрації іонів. Для слабких електролітів ріст концентрації іонів з ростом концентрації електроліту змінюється у точці максимуму зменшенням абсолютної кількості іонів внаслідок суттєвого зменшення ступеню дисоціації.
З ростом температури на один кельвін питома електропровідність зростає приблизно на 2-2,5 %. Це пояснюється зниженням густини розчинів, зменшенням гідратації іонів, а для слабких електролітів збільшенням їх ступеню дисоціації.
χ, См/см
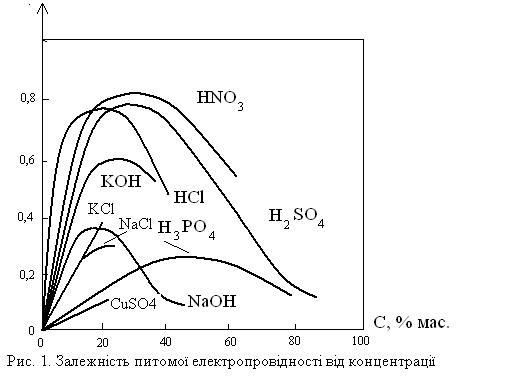
Рисунок - Залежність питомої електропровідності від концентрації
Залежність питомої електропровідності розбавлених розчинів від температури підкорюється емпіричному рівнянню:
![]() =
=![]() [1+
(t
– 25) +
[1+
(t
– 25) +
![]() (t
- 25)2],
(t
- 25)2],
де: - питома електропровідність при 250С;
- питома електропровідність при температурі t;
і - температурні коефіцієнти електропровідності, де:
= 0,0163( - 0,0174).
Коефіцієнти і залежать від природи електроліту. Для сильних кислот = 0,0164 , для сильних основ = 0,0190 , для солей =0,0220.
Нарівні з питомою електропровідністю використовують також величину еквівалентної електропровідності – електропровідність такого об’єму розчину електроліту, в якому міститься 1 моль-еквівалент розчиненої речовини і розчин вміщений між плоскими паралельними електродами, що знаходяться на одиничній відстані один від одного:
=
![]() =
=
![]() v,
v,
де: v - розведення,
C– еквівалентна концентрація розчину, моль-екв/л.
Основна одиниця еквівалентної електропровідності См*м2/моль-екв. На практиці використовують См*см2/моль-екв і якщо виражати у См/см, а концентрацію у моль-екв/л, то:
![]() .
.
Еквівалентна
електропровідність зі збільшенням
розведення спочатку збільшується
достигаючи сталого значення
![]() ,
а потім перестає змінюватися.
носить
назву граничної електропровідності і
характеризує такий стан розчину, коли
іони вже не взаємодіють один з одним. У
такому розчині еквівалентна
електропровідність визначається згідно
закону Кольрауша:
,
а потім перестає змінюватися.
носить
назву граничної електропровідності і
характеризує такий стан розчину, коли
іони вже не взаємодіють один з одним. У
такому розчині еквівалентна
електропровідність визначається згідно
закону Кольрауша:
=![]() ,
,
де:
![]() - граничні електропровідності катіону
і аніони, які визначають з таблиць. Таким
чином, для сильних електролітів коефіцієнт
електропровідності:
- граничні електропровідності катіону
і аніони, які визначають з таблиць. Таким
чином, для сильних електролітів коефіцієнт
електропровідності:
=![]() ,
,
а для слабких електролітів:
= .
Для
розбавлених розчинів сильних
електролітів(C![]() 0,01н)Залежність
еквівалентної електропровідності від
концентрації виражається емпіричним
рівнянням Кольрауша:
0,01н)Залежність
еквівалентної електропровідності від
концентрації виражається емпіричним
рівнянням Кольрауша:
![]() ,
,
де:
-
гранична еквівалентна електропровідність(![]() при C
0),
при C
0),
А – емпірична стала, яка залежить від природи розчинника і температури.
Кондуктометричні вимірювання можливо здійснювати на змінному і сталому струмі. Вимірювання на сталому струмі виконують рідко. Це пов’язано з поляризацією електродів і неможливістю точно виміряти електропровідність розчину. Частіше виконують виміри електропровідності за допомогою пристроїв, які працюють на змінному струмі. В цьому випадку спотворення результатів внаслідок поляризації електродів на 2 порядки менше, чим на сталому струмі. Такі пристрої включають в себе електролітичну комірку для вимірювання електропровідності, джерело змінного струму і вимірювальну схему.
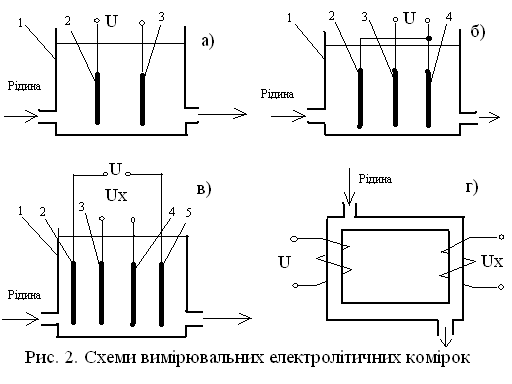
Рисунок 3.22 – Схеми вимірювальних електролітичних комірок
Електролітичні комірки можуть бути контактними і безконтактними. Самою простою з них є двохелектродна комірка (рисунок 3.22 а), яка складається із сосуду 1 з двома інертними металічними електродами 2 і 3. Для зменшення зовнішніх електричних наводок на результат вимірювання застосовують 3-х електродні комірки (рисунок 3.22 б), які представляють собою, по суті, дві двохелектродні комірки, які підключені паралельно. Для зменшення впливу явища поляризації електродів на результат вимірювання, застосовують 4-х електродні комірки (рисунок 3.22 в). В цих комірках електроди 2 і 5 виконують функції підвода електричної енергії до комірки а електроди 3 і 4 використовуються для отримання вимірювальної інформації.
Безконтактні електролітичні комірки (рисунок 3.22 г) можуть бути використані для вимірювання електропровідності рідких середовищ, які містять зважені, колоїдні частки, а також кристалізуючи речовини. Такі комірки можуть робити при коливаннях до 1000 Гц (безконтактна низькочастотна кондуктометрія) і на більш високих частотах 105-108 Гц (високочастотна кондуктометрія).
Як джерела живлення при вимірюванні електропровідності розчинів використовують генератори звуковою частоти та високочастотні генератори.
Вимірювальні схеми лабораторних та промислових кондуктометрів в більшості випадків побудовані за мостовою схемою з ручним (рисунок 3.23 а), або автоматичним (рисунок 3.23 б) урівноваженням.
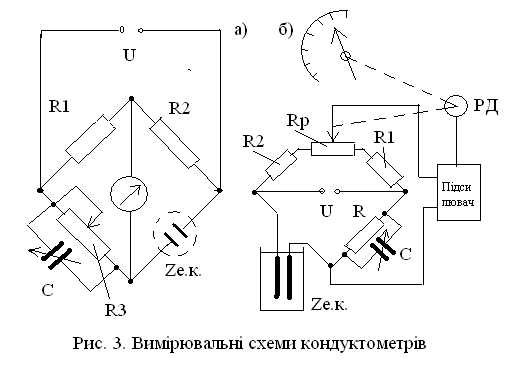
а – з ручним урівноваженням; б- з автоматичним урівноваженням
Рисунок 3.23 – Вимірювальні схеми кондуктометрів
При ручному урівноваженню (рисунок 3.30 а) переміщенням движку реохорду R3 досягають рівно важності мосту, яке визначається умовою:
R1*Rе.к. = R2*R3.
На змінному струмі досягнути повного урівноваження не можливо внаслідок присутності в електролітичній комірці крім активної складової Rе.к також реактивної складової RC,L:
Zе.к. = Rе.к+ RC,L.
Для часткової компенсації ємнісної складової паралельно резистору R3 підключають ємність С, яка регулюється під дану електролітичну комірку. При вимірах переміщенням движку реохорду R3 досягають мінімальної сили струму в вимірювальній діагоналі мосту, що контролюється за допомогою мілівольтметру, осцилографу, або по найменший гучності звуку, що контролюється за допомогою телефону.
Принцип дії автоматичного мосту (рисунок 3.23 б) засновано на підсилюванні напруги розбалансу, яка знімається з вимірювальної діагоналі і яка керує переміщенням реверсивного двигуна (РД). Він переміщує движок реохорду Rp до встановлення рівноваги мосту і одночасно покажчик, який фіксує виміряне значення електропровідності.
Сучасний розвиток вимірювальної техніки дозволив створити високоточні прилади для вимірювання електропровідності, які засновані на вимірюванні падіння напруги на прецензійному резисторі в залежності від сили струму в електролітичній комірці. В таких приборах використовуються простіша комірка. Завдяки високому вхідному опору підсилювача забезпечується вимірювання електропровідності розчинів з дуже низьким значенням питомої електропровідності.
