
- •Міністерство освіти, науки, молоді та спорту україни дніпродзержинський державний технічний університет
- •Конспект лекцій
- •6.050802 „Електронні пристрої та системи” (ес),
- •6.050801 “Мікро та наноелектроніка” (фбе).
- •Тема 1. Вступ до фізичної хімії. Будова речовини.
- •Тема 2. Перший закон термодинаміки
- •1.2. Основні поняття і визначення
- •Тема 3. Другий закон термодинаміки
- •Тема 4. Хімічна рівновага. Хімічна спорідненість.
- •Тема 5. Хімічна кінетика
- •Тема 6. Розчини. Властивості розчинів електролітів
- •Тема 7. Електропровідність електролітів.
- •Тема 8. Електрохімічні процеси
Тема 3. Другий закон термодинаміки
Самочинні та не самочинні процеси. Формулювання другого закону термодинаміки і його аналітичний вираз. Розрахунок зміни ентропії у різних процесах. Статистичний характер другого закону термодинаміки. Термодинамічна вірогідність. Ентропія як міра вірогідності. Формула Больцмана. Абсолютні значення ентропії. Постулат Планка. Третій закон термодинаміки. Залежність ентропії від температури. Функції Гіббса і Гельмгольца як критерій напряму процесу
Перший принцип термодинаміки стверджує еквівалентність різних форм енергії і дає кількісні співвідношення, справедливі при будь-яких переходах. Але він не дає ніяких відомостей про напрям, в якому відбувається перехід насправді.
Наприклад, якщо система цинк — сірчана кислота, що знаходиться у певному стані, будь-яким шляхом переходить у новий певний стан сульфат цинку — водень, то згідно з першим законом загальна кількість теплоти і роботи залишається незмінною. Крім того, при зворотному переході загальний енергетичний баланс буде тим же, але з протилежним знаком. Однак з досвіду відомо, що цинк самочинно реагує із сірчаною кислотою, у той час як зворотний перехід вимагає втручання ззовні, витрати роботи.
Таким чином, всі процеси можуть бути поділені на дві групи: процеси самочинні, або спонтанні (позитивні), які проходять самі по собі, і процеси не самочинні (негативні), які вимагають для свого проходження витрати роботи.
Самочинні процеси проходять у напрямі наближення системи до рівноважного стану. Ідеальним граничним випадком процесів, які лежать між самочинними і не самочинними, є рівноважні процеси, при яких відбувається перехід системи у прямому або зворотному напрямі через послідовність рівноважних станів.
Другий закон термодинаміки дає можливість передбачити напрям перебігу процесу в заданих умовах, а також характеризувати рівноважний стан системи.
Другий закон (принцип) термодинаміки, як і перший, є постулатом, який неможливо довести на основі інших положень. Неможливий самочинний перехід теплоти від менш нагрітого тіла до більш нагрітого. Отже, неможливо сконструювати машину, яка б у круговому процесі тільки переносила тепло від більш холодного тіла до більш нагрітого.
Інше формулювання запропоноване В. Томсоном (лордом Кельвіном, 1851):
Неможливо побудувати періодично діючу машину, яка б тільки одержувала тепло від теплового резервуару і повністю перетворювала його в еквівалентну кількість роботи (принцип неможливості вічного двигуна другого роду).
З
другого закону термодинаміки випливає,
що люба форма енергії – механічна,
електрична, хімічна – може повністю
переходити в тепло, однак зворотній
повний перехід не можливий, тому що
частина теплової енергії розсіюється.
Для характеристики незворотності
енергетичних переходів при різних
фізичних і хімічних процесах застосовується
особа величина – ентропія S,
як та частина енергії, яка не перетворюється
у корисну роботу. Зміна ентропії при
оборотному процесі визначається
рівнянням(оскільки
![]() ):
):
![]() =
=
![]() .
.
В цьому рівнянні С – теплоємкість при постійному тиску Ср, або постійному об’ємі Сv.
Для
не оборотних процесів
![]() .
Таким чином, зміни ентропії в ізольованій
системі вказують на можливість самочинних
переходів у системі(збільшення ентропії),
або на стан рівноваги(сталість ентропії).
.
Таким чином, зміни ентропії в ізольованій
системі вказують на можливість самочинних
переходів у системі(збільшення ентропії),
або на стан рівноваги(сталість ентропії).
Можна сказати що ентропія є мірою невпорядкованості стану системи. Системи прагнуть перейти з більш впорядкованого стану до менш впорядкованого стану, який характеризується збільшенням ентропії.
Виходячи із рівняння можна розрахувати зміну ентропії у різних процесах:
1.для ізотермічного процесу(при переході речовини з одного агрегатного стану у інше):
![]() .
.
Для процесу плавлення q – теплота плавлення і т.д.
2.Змішання двох ідеальних газів при сталих температурі і тиску:
![]() .
.
3.Нагрівання при сталому об’єму або тиску:
![]() .
.
Стан системи можна характеризувати мікро станами часток, які її складають – їх миттєвими координатами і швидкостями різних видів руху у різних напрямках. Число мікро станів системи зветься термодинамічною вірогідністю системи W. Оскільки число часток у системі значне, імовірність виражається значними числами. Тому користуються логарифмом термодинамічної вірогідності, який зв’язане з ентропією формулою Больцмана: S = кlnW і є ентропією системи. Множник к дорівнює сталій Больцмана. Статистичний характер другого закону термодинаміки вказує на те, що збільшення ентропії відображає найбільш вірогідний шлях змін.
Розглянуті вище співвідношення дають можливість розрахувати тільки зміни ентропії, але не дозволяють знайти її абсолютне значення. Ентропію можна обчислити на основі постулату Планка (1912), згідно з яким ентропія ідеального кристала індивідуальної речовини дорівнює нулю при абсолютному нулі температури S0 = 0. Цей постулат називають також третім законом термодинаміки.
Зі збільшенням температури зростає швидкість різних видів руху часток, а відповідно і число їх мікро станів і термодинамічна імовірність і ентропія. При переході речовини з твердого стану у рідкий значно збільшується невпорядкованість і ентропія речовини. Особливо різко збільшується ентропія при переході з рідкого у газоподібний стан. Збільшення числа атомів у молекулі і ускладнення молекули призводять до збільшення ентропії. Можна розрахувати зміну ентропії хімічної реакції яка дорівнює різниці(з урахуванням стехіометричних коефіцієнтів) між сумою ентропій продуктів реакції і сумою ентропій вихідних речовин.
У довідкових таблицях термодинамічних властивостей речовин звичайно наводяться величини S — стандартні ентропії при 298 К і р = 1,013 105 Па. Для знаходження абсолютних ентропій в інших умовах необхідно до цих значень додати зміни, пов'язані з переходом із стандартного стану в новий.
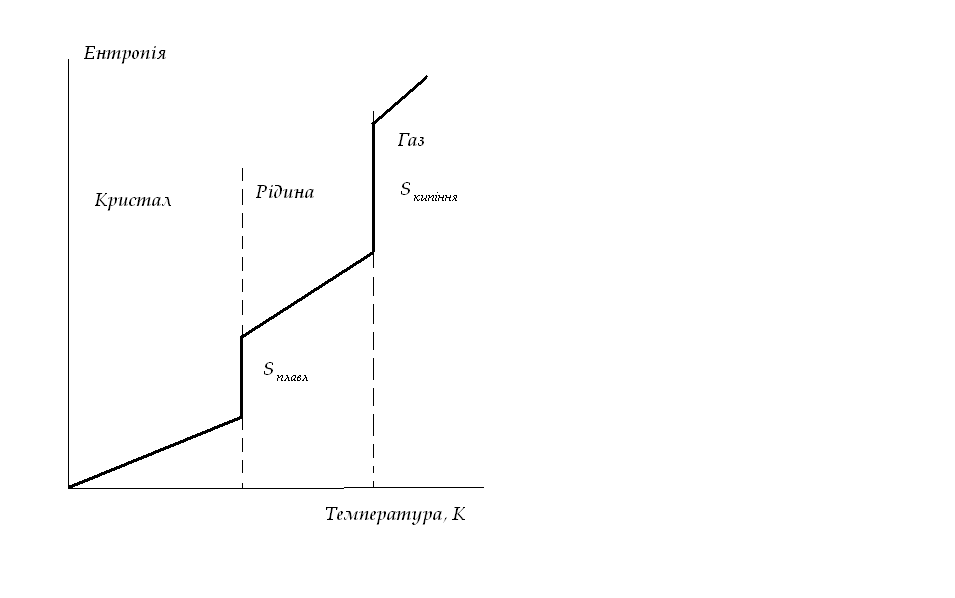
Рисунок. Зміна ентропії речовини зі збільшенням температури.
Таким чином для систем, які не обмінюються з зовнішнім середовищем ні енергією ні речовиною другий закон термодинаміки можна сформулювати наступним чином: в ізольованих системах самочинно йдуть тільки такі процеси, які супроводжуються зростанням ентропії.
Однак,
системи, в яких перебігають хімічні
реакції не ізольовані, тому що вони
супроводжуються зміною внутрішньої
енергії(тепловим ефектом реакції),
обмінюються енергією з зовнішнім
середовищем і таким чином зазвичай
супроводжуються як зміною ентропії,
так і зміною ентальпії. В хімічних
процесах проявляються дві протилежні
тенденції: а) прагнення до утворення
міцних зв’язків між частками, виникнення
більш складних речовин, що супроводжується
зменшенням енергії системи(ентальпійний
фактор -
![]() );
б) прагнення до роз’єднанню часток, до
безладдя, що характеризується збільшенням
ентропії(ентропійний фактор -Т
);
б) прагнення до роз’єднанню часток, до
безладдя, що характеризується збільшенням
ентропії(ентропійний фактор -Т![]() ).
Кожний з зих факторів окремо не може
бути критерієм самочинності хімічної
реакції. Для ізобаро-ізотермічного
процесу їх об’єднує термодинамічна
функція, яка зветься енергією Гіббса(
).
Кожний з зих факторів окремо не може
бути критерієм самочинності хімічної
реакції. Для ізобаро-ізотермічного
процесу їх об’єднує термодинамічна
функція, яка зветься енергією Гіббса(![]() ):
):
![]() .
.
Це рівняння можна записати у вигляді:
![]() .
.
Ентальпія
хімічної реакції складається з двох
частин. Перша (
)
дорівнює максимальній роботі Аmax,
яку може виконати система, або частина
енергетичного ефекту хімічної реакції,
яку можна перетворити в роботу:
![]() Аmax,
або її ще називають вільною енергією.
Друга частина(ентропійний фактор) – це
частина енергетичного ефекту, яку не
можливо перетворити на роботу, вона
розсіюється у зовнішнє середовище у
вигляді теплоти і ентропійний фактор
Аmax,
або її ще називають вільною енергією.
Друга частина(ентропійний фактор) – це
частина енергетичного ефекту, яку не
можливо перетворити на роботу, вона
розсіюється у зовнішнє середовище у
вигляді теплоти і ентропійний фактор
![]() зветься зв’язаною енергією. Енергія
Гіббса є критерій самочинності перебігання
хімічної реакції при ізобаро-ізотермічних
процесах. Хімічна реакція принципово
можлива коли
зветься зв’язаною енергією. Енергія
Гіббса є критерій самочинності перебігання
хімічної реакції при ізобаро-ізотермічних
процесах. Хімічна реакція принципово
можлива коли
![]() .
Якщо
.
Якщо
![]() ,
хімічна реакція не може перебігати
самочинно. Якщо
,
хімічна реакція не може перебігати
самочинно. Якщо
![]() ,
реакція зворотна і може перебігати як
у прямому, так і у зворотному напрямках.
,
реакція зворотна і може перебігати як
у прямому, так і у зворотному напрямках.
Напрямок
реакції залежить від її характеру. Якщо
реакція екзотермічна(![]() )
і в результаті реакції збільшується
число моль газоподібних речовин(
)
і в результаті реакції збільшується
число моль газоподібних речовин(![]() ),
то вона перебігає у прямому напрямку
при любих температурах. Навпаки, якщо
),
то вона перебігає у прямому напрямку
при любих температурах. Навпаки, якщо
![]() і зменшується число моль газоподібних
речовин
і зменшується число моль газоподібних
речовин
![]() ,
реакція не може перебігати самочинно
у прямому напрямку при любій температурі.
,
реакція не може перебігати самочинно
у прямому напрямку при любій температурі.
Якщо
![]() ,
і
,
і
![]() самочинно може перебігати пряма реакція
при низьких температурах Т
самочинно може перебігати пряма реакція
при низьких температурах Т![]() Тр=
Тр=![]() і зворотна при високих.
і зворотна при високих.
Якщо
,
і
самочинно може перебігати пряма реакція
при високих температурах Т![]() Тр=
і
зворотна при низьких.
Тр=
і
зворотна при низьких.
В
довідниках наведені стандартні значення
зміни енергії Гіббса при утворенні 1
моль речовини з простих речовин, стійких
при 298 К(енергі Гіббса утворення речовини
-
![]() ).
Енергію Гіббса хімічної реакції можна
розрахувати як різницю між сумою енергій
Гіббса утворення продуктів реакції і
сумою енергій Гіббса утворення вихідних
речовин з урахуванням стехіометричних
коефіцієнтів. Отримане значення
зветься стандартною енергією Гіббса
хімічної реакції і є критерієм самочинного
перебігання реакції при стандартних
станах вихідних речовин і продуктів
реакції.
).
Енергію Гіббса хімічної реакції можна
розрахувати як різницю між сумою енергій
Гіббса утворення продуктів реакції і
сумою енергій Гіббса утворення вихідних
речовин з урахуванням стехіометричних
коефіцієнтів. Отримане значення
зветься стандартною енергією Гіббса
хімічної реакції і є критерієм самочинного
перебігання реакції при стандартних
станах вихідних речовин і продуктів
реакції.
Для
ізохоро-ізотермічних умов максимальна
робота системи при рівноважному
проведенню процесу дорівнює зміні
енергії Гельмгольца
![]() :
:
![]() .
.
Енергія
Гельмгольца характеризує напрямок
самочинного перебігання хімічної
реакції при ізохоро-ізотермічних умовах,
що можливо, коли
![]() .
.
Зв’язок розглянутих термодинамічних функцій між собою наведено на рисунку.
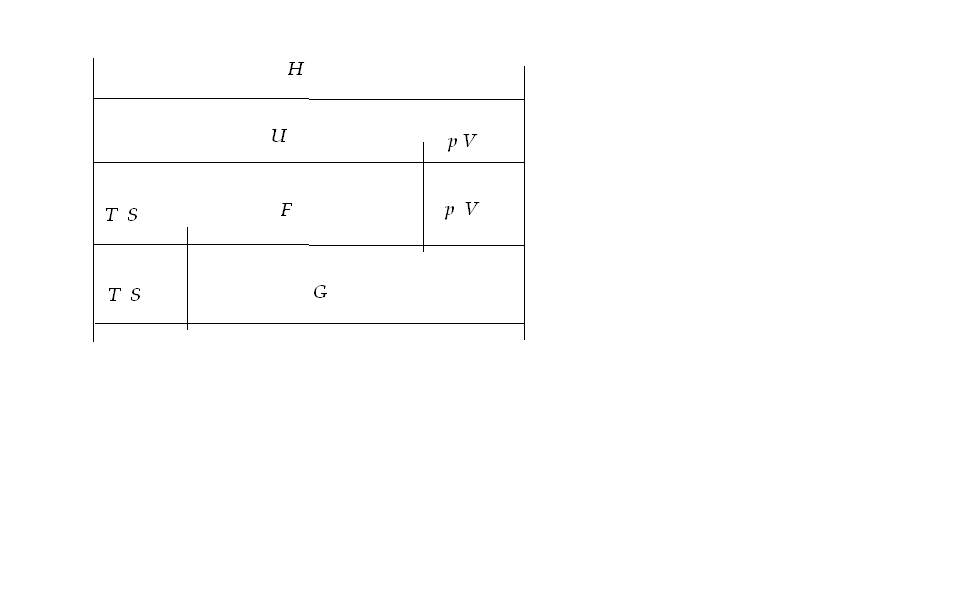
Рисунок. Зв’язок термодинамічних функцій між собою.
